质谱技术在磷脂分析中的应用研究进展
2012-05-07田庆龙赵丽丽冯毅凡
田庆龙,赵丽丽,冯毅凡
(广东药学院中心实验室,广东 广州 510006)
磷脂具有多种重要的生理功能,大量研究表明磷脂代谢紊乱可引发诸多疾病,如糖尿病[1~7]、肥胖症[8]、动脉硬化症[9]、冠心病[2]、阿尔茨海默病[10,11]、脑损伤[12]、癌症[13,14]、脂肪肝[15]及巴特综合症[16]等。因此,生命体中磷脂类物质及其代谢过程的研究已成为疾病发病机理和诊断治疗以及医药研发的重点。为了得到生物样本中更为全面的磷脂信息,更好地反映生物体内磷脂类物质的作用机制,并找到与疾病相关的生物标志物或代谢规律,为疾病的早期诊断提供科学依据,科学家已经将磷脂的整体分析作为研究的重点。
随着磷脂分析技术的不断发展,人们对磷脂在生物膜的组成、结构及功能的研究日益深入。大多数甘油磷脂作为脂质第二信使的前体,如含有花生四烯酸和二十二碳六烯酸磷脂与磷脂酰胆碱就是磷脂酸的前体。磷脂在急性炎症、血小板聚集和神经递质的释放中扮演了血小板激活因子的角色[17]。
2008年,德国不莱梅大学Jan等[18]提出了磷脂组学的概念。磷脂组学是对整体磷脂进行系统分析的一门新兴学科,是脂质组学的一个分支,通过比较不同生理状态下磷脂代谢网络的变化,进而识别代谢调控中关键的磷脂生物标志物,最终揭示磷脂在各种生命活动中的作用机制。电喷雾-质谱技术(ESI-MS)是磷脂组学领域最核心的研究手段,目前已能对磷脂进行高分辨率、高灵敏度、高通量的分析。随着液质联用技术(LC-MS)的发展,磷脂组学在疾病磷脂生物标志物的识别、疾病诊断、药物靶点及先导化合物的发现和药物作用机制的研究等方面已展现出广阔的应用前景,具有十分重要的意义。
1 磷脂的分类
磷脂的结构特点:具有由磷酸相连的取代基团(含氨碱或醇类)构成的亲水头(Hydrophilic head)和由脂肪酸链构成的疏水尾(Hydrophobic tail)。磷脂根据醇成分的不同分为甘油磷脂和鞘磷脂(SM)。
甘油磷脂是机体含量最高的一类磷脂,它除了构成生物膜外,还是胆汁和膜表面活性物质等的成分之一,并参与细胞膜对蛋白质的识别和信号转导。甘油磷脂依据极性头的不同分为磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)、磷脂酰肌醇(PI)、磷脂酰甘油(PG)和磷脂酸(PA)6大类,在每一大类下由于脂肪酸链的不同又分为多种结构相似的亚类,如缩醛磷脂、溶血磷脂等。心磷脂(CL)为双磷脂酰甘油,是广泛存在于线粒体内膜的一种复杂磷脂,可调节氧化磷酸化相关酶的活性,在维持线粒体功能和膜完整性方面发挥重要作用。
鞘磷脂也称神经鞘磷脂,广泛存在于生物组织内,尤其在脑组织中含量特别多。
各类磷脂的化学结构如图1所示。
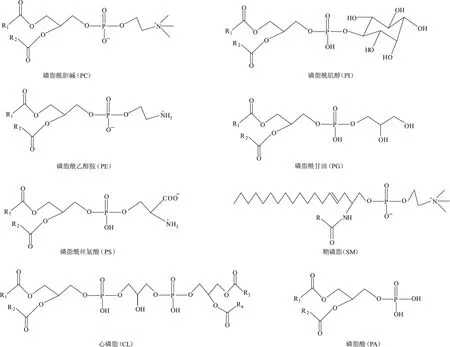
图1 各类磷脂的化学结构
2 磷脂的提取
2.1 组织磷脂提取
取40 mg组织,加入0.8 mL冷的CH3OH-0.1 mol·L-1HCl(1∶1,体积比)在冰上匀浆1 min,将得到的悬浮液移至冷的离心管中;再加入0.4 mL 冰氯仿,涡旋1 min,离心(4 ℃,18 000×g,5 min),分层,将下层有机相移至离心管中,用氮气吹干于-20 ℃保存。进样前采用初始流动相复溶,在样品中加入10 μL NH3·H2O(1.8 mol·L-1)以提高离子化效率。
2.2 细胞磷脂提取
取大约1×107个细胞,先用5 mL冰预冷的1×PBS洗2遍,然后将1.5 mL细胞悬浮液移至离心管中,离心(4 ℃,600×g,10 min),去上清;再加入0.8 mL冷的CH3OH-0.1 mol·L-1HCl(1∶1,体积比)、0.4 mL 冰冷的氯仿,涡旋1 min ,离心(4 ℃,18 000×g,5 min),分层,将下层有机相移至离心管中,并用氮气吹干于-20 ℃保存。进样前采用初始流动相复溶,在样品中加入10 μL NH3·H2O(1.8 mol·L-1)以提高离子化效率。
2.3 血浆磷脂提取
将全血离心后取300 μL血浆,加入8 mL含0.01%2,6-二叔丁基-4-甲基苯酚的CH3Cl-CH3OH(2∶1,体积比),超声60 s,涡旋30 s,室温放置0.5 h;再加入1.3 mL 50 mmol·L-1KCl溶液,离心(2000×g,15 min),分层,将上层水相溶液再用2 mL CH3Cl萃取1次,合并2次得到的下层有机相溶液,用氮气吹干于-20 ℃保存。进样前采用初始流动相复溶。
3 磷脂的质谱分析方法
传统的分析方法操作复杂且灵敏度低,如HPLC、TLC、GC-MS等。用GC-MS分析的时候需要先对磷脂进行水解,再衍生化,且只能提供脂肪酰基的结构,并不能对磷脂准确定性。
虽然磷脂结构的多样性增大了分析的难度,但是随着现代分析技术的发展,可行的分析方法越来越多,如鸟枪法和高效液相色谱-电喷雾-质谱法(HPLC-ESI-MS)等。电喷雾-质谱法(ESI-MS)具有样品前处理简单、分辨率高、容易实现自动化等优点,尤其适合对磷脂混合物进行快速、灵敏和高通量的定性定量分析。液质联用技术极大地推动了磷脂组学的发展,其核心技术就是ESI-MS,加上色谱技术对样品中磷脂分离的强化,实现了磷脂分离鉴定的高通量、高灵敏度和高效率。多维质谱技术在磷脂组学的研究中也取得了新的进展。鸟枪法具有灵敏度高、快速、易于自动化等优点,但在分析磷脂的同分异构体时有一定的局限性。液质联用技术可以有效改善鸟枪法中低含量磷脂受离子抑制影响和无法准确分析同分异构体的缺陷。目前,液质联用技术已经成为磷脂分析中应用最广泛的技术。
3.1 电喷雾质谱鸟枪法
鸟枪法作为磷脂研究的重要新兴手段,在创立和发展初期便已显示出惊人的潜力,随着相关技术的进一步完善和发展,必将成为系统生物学的组成部分,在生物医学的研究和应用中发挥重要作用。鸟枪法利用质谱技术对单一或全部磷脂及其相关分子进行系统分析,研究其改变对生物体所产生的作用并探讨可能的作用机制。传统磷脂分析中的瓶颈问题在以电喷射离子质谱为基础的方法出现后获得了突破,使磷脂分析进入高通量、高精度和高效能的时代。
磷脂在生物体内分布广泛、种类众多,并且与人类疾病密切相关。将磷脂组学分析方法运用于疾病相关的特异磷脂类标志物的发现并揭示其在疾病发生发展等复杂过程中的作用,可能为疾病的诊断治疗提供新的思路和策略。
利用常规生物样本磷脂提取方法,在有效源内分离基础上,根据磷脂类离子或碎片内在带电特性的不同,选择适当的多维阵列分析方法,以实现对目的磷脂分子的定性及定量分析。源内分离的基本原理是利用电喷雾离子源在高电势(通常为4 kV)的作用下,使样本中的生物大分子解离成带有不同电荷的离子,进一步历经类似电泳的分离过程得到选择性的解析。由于不同的磷脂分子具有不同的电离特性,所带电荷较大程度上依赖于其极性头簇(Polar head groups)的化学特征,因此通过源内分离可根据磷脂分子内在携带电荷情况的不同将其进行初步分离,进而通过后续的分析步骤获得生物样品中一系列磷脂分子组成的质谱图[19]。
目前利用鸟枪法对多种疾病相关磷脂变化的研究已经获得初步进展。研究表明,在阿尔茨海默病的不同病程阶段都伴有特殊磷脂成分的变化,利用电喷射离子对不同程度阿尔茨海默病患者脑组织中各叶区的灰质和白质的磷脂进行系统分析,发现与同龄正常对照人群相比,临床确诊为早期阿尔茨海默病患者的神经系统可呈现多种脂类成分的改变,其中以缩醛磷脂酰乙醇胺(pPE)的减少最为明显[11]。这一发现揭示pPE可能在阿尔茨海默病的发病过程与发病机理方面发挥重要的作用,特别是与阿尔茨海默病发病的早期事件(包括神经退行性改变、突触缺失或功能异常等现象)密切相关。该研究可能为阿尔茨海默病的发病从机制水平上提供诊断依据。
在链脲佐菌素诱导的糖尿病大鼠模型中,鸟枪法借助电喷射离子技术对心肌组织磷脂进行系统分析发现,多种特异性脂类成分的改变与胰岛素在脂代谢中的作用及其相关的酶促反应机制密切关联。糖尿病大鼠的心肌样本与对照组相比,可检出PI含量增加了46%、pPE含量增加了44%、PE(18:0/20:4)含量减少了22%[3]。糖尿病大鼠经胰岛素治疗后,心肌磷脂及其亚类在分子构成上的变化可以被纠正。Han等[4]研究发现,糖尿病小鼠心肌中CL含量在链脲佐菌素诱导的6 周内被显著性消耗,在糖尿病早期采用鸟枪法证明经链脲佐菌素诱导后心肌中大量CL丢失了,剩余的CL发生重构,CL(18:2/22:6~22:6/22:6)的含量增加了16倍,这些结果为糖尿病的预防和缓解提供了重要的理论基础。以上研究表明鸟枪法在磷脂代谢分析研究中潜力巨大。
与正常组织能量代谢的巴斯德效应(Pasteur effect),即有氧氧化抑制无氧酵解的现象有所不同,肿瘤细胞的能量代谢方式表现为无氧代谢异常旺盛的瓦尔堡效应(Warburg effect)。这可能是由于线粒体不可逆损伤所导致的,但是其确切的机制仍不清楚。
Kiebish等[14]将脑肿瘤(包括星形细胞瘤及成室管膜细胞瘤)接种于C57BL/6J(B6)小鼠和VM/Dk(VM)小鼠皮下后,荷瘤小鼠脑细胞线粒体CL的组成及含量均发生异常,中间产物的分子种类增多,成熟的分子种类减少,揭示CL合成及重构存在缺陷,为瓦尔堡假说提供了更加丰富的证据。因此,鸟枪法在肿瘤发生发展机制的研究中将发挥更为重要的作用,特别是以磷脂代谢物作为诊断和疗效生物标志物的尝试将备受关注。
3.2 高效液相色谱-电喷雾-质谱法
根据各类磷脂的结构特点可以总结出:中性磷脂PC、PE、SM在正离子模式下响应好,酸性甘油磷脂如PS、PG、PI、PA、CL在负离子模式下响应好。在二维质谱图上根据保留时间(Retention time)和质荷比(m/z)可以对磷脂结构进行初步解析,磷脂同分异构体能在高效液相色谱柱上有效分离。根据表1可以得到磷脂的极性头信息而对磷脂进行归类,根据表2可以得到磷脂的碳链信息,因此利用高效液相色谱-电喷雾-质谱法可以较容易分析组织、细胞和血浆中的磷脂轮廓。
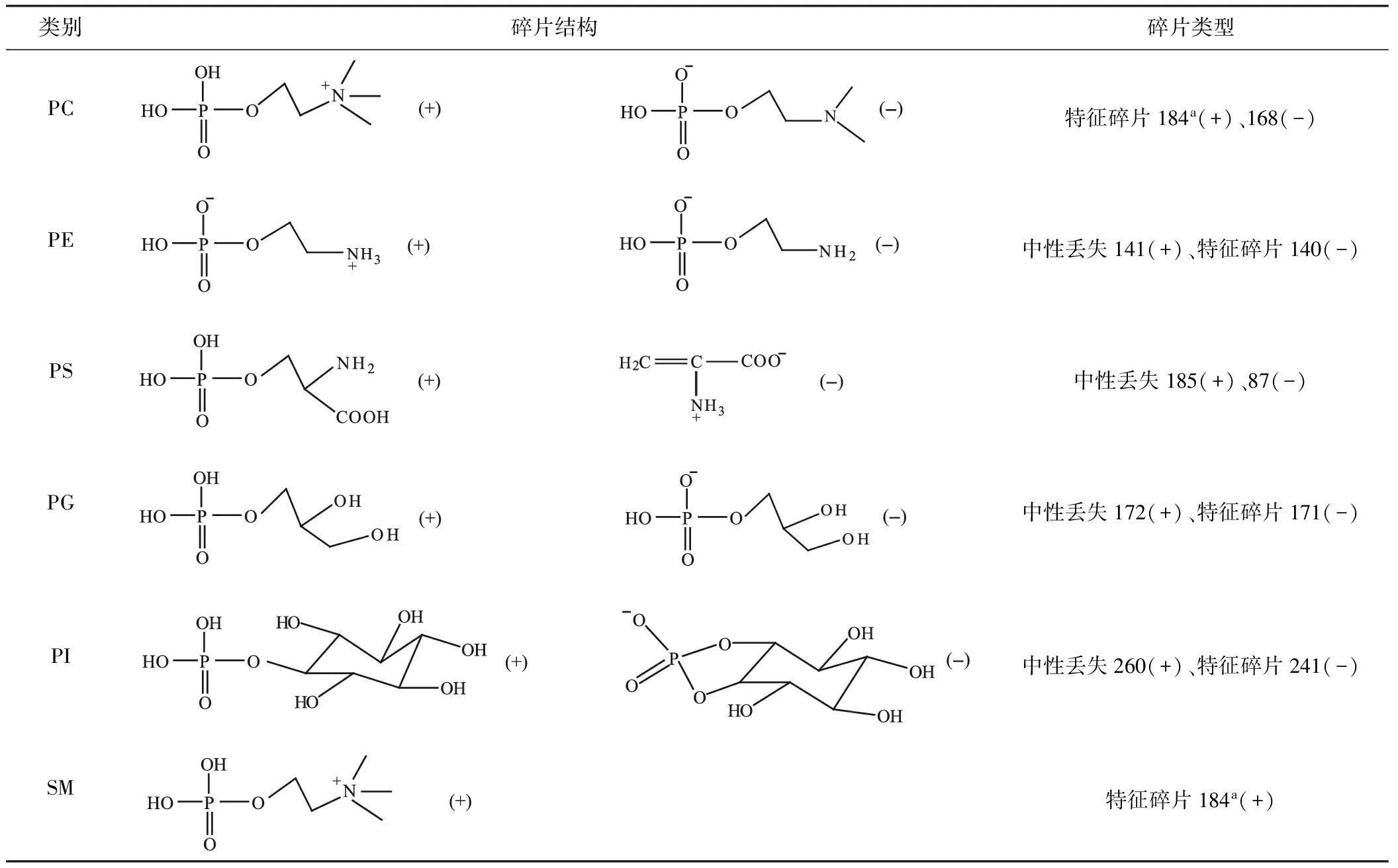
表1 各类磷脂在ESI+和ESI-模式下的特征碎片离子与中性丢失碎片信息

表2 各类磷脂在ESI+和ESI-模式下的分子离子与主要碎片离子信息
Uran等[20]采用NPLC-ESI-MS方法分析人血浆中的磷脂轮廓,依次按照PG、PC、PE(pPE与SM)、溶血磷脂酰胆碱(Lyso-PC)、PI、PS的顺序出峰,成功鉴定了20个PG,此外还在人血液中新发现了17个双饱和磷脂。Malavolta等[21]采用NPLC-ESI-MS方法分析健康受试者与囊胞性纤维症患者血液单核细胞中的磷脂轮廓,鉴定了140多个磷脂,其中囊胞性纤维症患者血液单核细胞中的pPE(p16:0/22:6)、pPE(p18:0/22:6)、PE(16:0/20:4)和PC(16:0/18:2)的含量明显低于健康受试者,而PC(16:0/16:1)的含量却明显高于健康受试者,这些磷脂的变化可能与肠吸收障碍或营养失调有关。该研究为囊胞性纤维症的预防和缓解提供了重要的理论基础。
Bird等[22]采用RPLC-ESI-MS方法在负离子模式下分析并鉴定了线粒体中的28个CL和2个单溶血心磷脂,这些磷脂的变化与线粒体应力和功能障碍密切相关。Wang等[23]采用正相液相色谱-四极杆线性离子阱技术成功分析了人血浆中的磷脂轮廓,由于同时联合了具有高选择性的三重四级杆和高灵敏度的离子阱2种质谱技术,所得到的信息比前人报道的更加丰富,一共鉴定了106个磷脂,包括17个PS、31个PE、9个pPE、16个PC、7个Lyso-PC、14个PI和12个SM,其中PE(18:1/20:6)和PS(18:0/22:7) 是首次从人血浆中鉴定得到的磷脂。
Gao等[24]建立了快速、有效、高灵敏度的NPLC-ESI-MS分离检测痕量磷脂的方法,分析了大鼠腹膜表层的磷脂轮廓,成功分离并鉴定了75个磷脂,包括11个PE、8个pPE、13个PI、10个PS、15个PC、11个SM和7个Lyso-PC,且pPE在其sn-2酰基位置上富含多不饱和脂肪酸。研究表明,腹膜表面存在一层由腹膜间壁细胞分泌的透明质酸、磷脂双分子层及表面蛋白组成的表面活性层。在腹膜透析中,此活性层在腹膜溶质和水的转运中起很重要的作用。然而,在长期透析过程中,腹透液的冲刷可能使磷脂脱落或降解,导致这一表面活性层结构被破坏,疏水性降低,对水的重吸收增加,从而引起超滤功能下降。因此,进一步分析腹膜的磷脂组成,能够为长程腹膜透析过程中腹膜结构和功能的改变机制与腹膜透析的临床治疗提供更多的证据与支持。
Pang等[5]建立了NPLC-ESI-MS分析人血浆中PC、PE、PG、PI、PS、SM和Lyso-PC等7类磷脂的方法,定量分析正常人与糖尿病肾病不同分期患者血浆样品中7类磷脂,发现了7类磷脂在糖尿病肾病患者不同分期阶段的变化规律,为糖尿病肾病患者磷脂代谢研究提供了有效可靠的方法。该课题组在后期研究中同样采用NPLC-ESI-MS方法分析健康受试者、糖尿病患者和糖尿病肾病患者的血浆,得到了18个磷脂生物标志物,包括3个糖尿病磷脂生物标志物、8个糖尿病肾病磷脂生物标志物以及7个糖尿病和糖尿病肾病共有的磷脂生物标志物,其中PI(18:0/22:6)和SM(d18:0/20:2)是2个新发现的磷脂生物标志物[6]。该研究结果表明通过分析血浆磷脂的变化能够对糖尿病及糖尿病肾病的病程进行监控,为临床早期诊断及新药研发提供依据。
4 质谱技术在磷脂分析中的应用
磷脂代谢与机体的生理及病理过程密切相关,通过分析组织、细胞或血浆中的磷脂轮廓寻找生物标志物来阐明相关疾病的代谢途径及可能的病理机制,可以为临床早期诊断提供依据,对疾病的预防、控制及缓解疾病的发展进程具有重要意义。基于HPLC-ESI-MS分析平台寻找磷脂生物标志物的流程如图2所示。
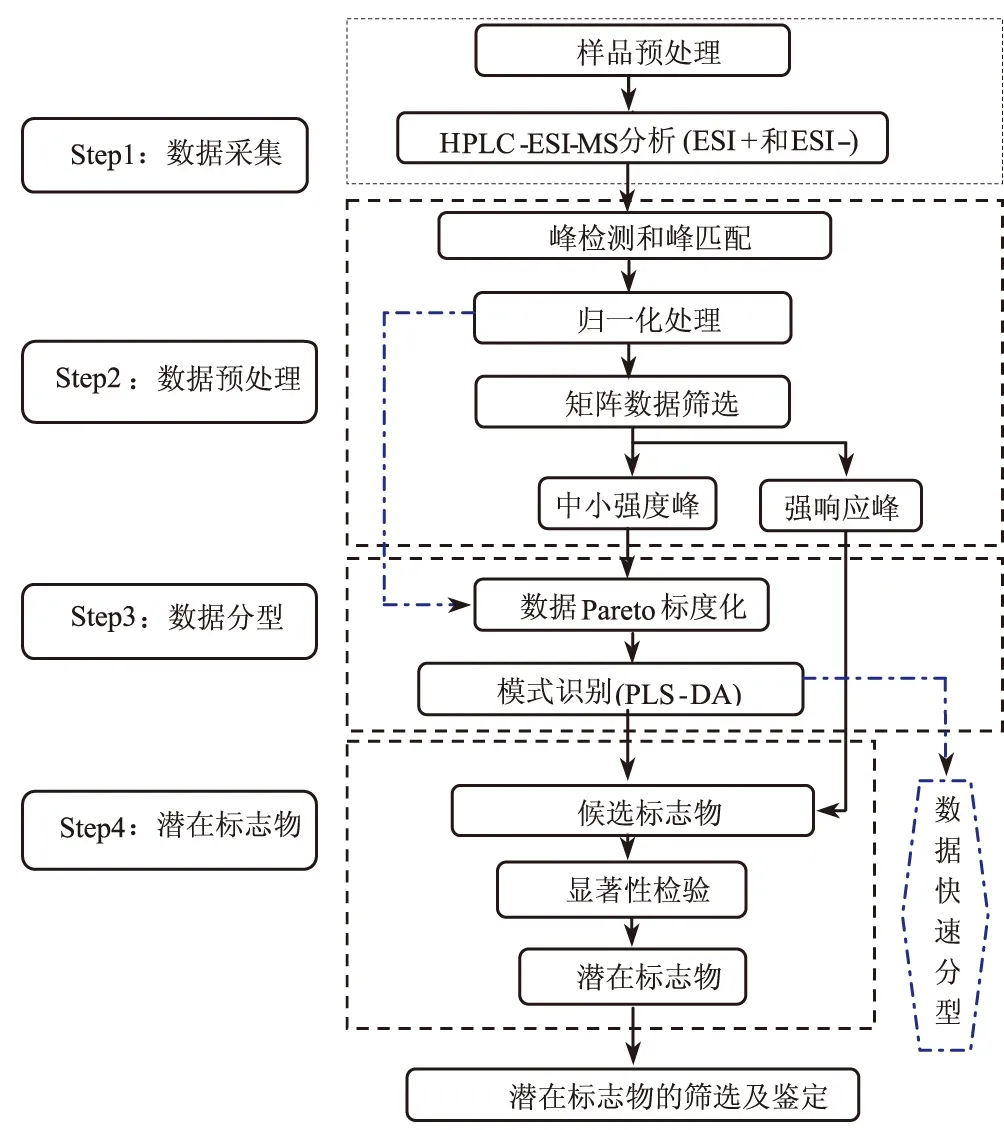
图2 基于HPLC-ESI-MS分析平台寻找磷脂生物标志物的流程
随着鸟枪法的不断发展,低丰度磷脂分子的定量测定也是可以实现的。更多磷脂轮廓的建立会加强磷脂在细胞膜和代谢功能障碍中特殊作用的解释,有利于发现具有更好选择性和非毒性的药物靶点。迄今为止,将鸟枪法应用于临床疾病的诊断已初露端倪,如肠道易激综合症(IBS)病人与健康受试者相比Lyso-PC含量明显升高[25],这些Lyso-PC参与了腹痛敏感性和肠道渗透压的调节,揭示其与腹痛和肠道屏障功能异常相关。这一研究成果可能为肠道易激综合症的早期诊断提供新的思路和策略。
Wang等[7]应用NPLC-ESI-MS分析正常人与Ⅱ型糖尿病患者的血浆磷脂轮廓,并结合多元统计分析得到了4个生物标志物PE(16:0/22:6)、PE(18:0/20:4)、Lyso-PC(16:0)和Lyso-PC(18:0),为类似疾病药物靶标的发现提供了参考依据。Jia等[26]将NPLC-ESI-MS与主成分分析(PCA)结合,成功应用于正常受试者与慢性血管球性肾炎患者的血浆磷脂轮廓分析,得到了19个生物标志物,包括10个PI和9个PS。该研究结果表明通过监测磷脂生物标志物的变化可以监控原发性慢性肾小球肾炎的发病过程,为临床早期诊断提供依据。
研究生物体在正常状态和疾病状态下磷脂代谢的整体差异、识别疾病磷脂生物标志物为阐明相应磷脂代谢调控的生理或病理机制,揭示关键性调控位点及其对应的关键基因/蛋白质/酶,发掘新的药物靶点,为相关疾病的预防、诊治及新药研发等提供了重要基础。此外,通过监测组织或细胞膜磷脂组成的变化,将有助于通过药物治疗引发的异常磷脂代谢来更好地评价药物的潜在毒性。磷脂组学还能作为评价药物疗效的辅助手段,通过监测药物作用后机体内磷脂代谢变化情况,及时反映机体生理生化状态的改变,有助于评价药物的疗效及确定可能的副作用。通过计算机模式合理设计寻找靶向受体[27],使得磷脂在新药开发中越来越受到重视。
5 结语
随着磷脂组学研究的发展,磷脂在生物体内的功能将得到进一步的揭示。应用质谱技术分析生物体内磷脂轮廓的变化、寻找潜在的生物标志物将会在以下方面得到广泛的应用:(1)早期诊断,通过寻找可靠的生物标志物与预后间的相关性,为选择合理的治疗方案提供依据;(2)病程监控,监测磷脂类生物标志物种类或数量的变化,以反映疾病的发展进程;(3)新药开发,在揭示发病机制的基础上为药物的设计提供潜在的靶点。研究生物体在正常状态和疾病状态下磷脂代谢的整体差异,识别疾病磷脂生物标志物,结合相关酶的研究,就有可能深入地研究代谢途径或致病机制,最终寻找到有效的诊断和治疗手段。可以预见,随着磷脂组学研究的不断进步,人们对磷脂的结构及作用机制的认识将逐步加深,从磷脂代谢水平诊断疾病和监测病程的准确率将进一步提高,可望通过调控机体内磷脂代谢网络达到治疗疾病的目的。
参考文献:
[1] Hodge A M,English D R,O′Dea K,et al.Plasma phospholipid and dietary fatty acids as predictors of type 2 diabetes:Interpreting the role of linoleic acid[J].Am J Clin Nutr,2007,86(1):189-197.
[2] Attia N,Domingo N,Lorec A M,et al.Reverse modulation of the HDL anionic peptide factor and phospholipid transfer protein activity in coronary artery disease and type 2 diabetes mellitus[J].Clin Biochem,2009,42(9):845-851.
[3] Han X,Abendschein D R,Kelley J G,et al.Diabetes-induced ch-anges in specific lipid molecular species in rat myocardium[J].Biochem J,2000,352(1):79-89.
[4] Han X,Yang J,Yang K,et al.Alterations in myocardial cardiolipin content and composition occur at the very earliest stages of diabetes:A shotgun lipidomics study[J].Biochemistry,2007,46(21):6417-6428.
[5] Pang L Q,Liang Q L,Wang Y M,et al.Simultaneous determination and quantification of seven major phospholipid classes in human blood using normal-phase liquid chromatography coupled with electrospray mass spectrometry and the application in diabetes nephropathy[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,869(1-2):118-125.
[6] Zhu C,Liang Q L,Hu P,et al.Phospholipidomic identification of potential plasma biomarkers associated with type 2 diabetes mellitus and diabetic nephropathy[J].Talanta,2011,85(4):1711-1720.
[7] Wang C,Kong H,Guan Y,et al.Plasma phospholipid metabolic profiling and biomarkers of type 2 diabetes mellitus based on high-performance liquid chromatography/electrospray mass spectrometry and multivariate statistical analysis[J].Anal Chem,2005,77(13):4108-4116.
[8] de Vries R,Kappelle P J,Dallinga-Thie G M,et al.Plasma phospholipid transfer protein activity is independently determined by obesity and insulin resistance in non-diabetic subjects[J].Atherosclerosis,2011,217(1):253-259.
[9] Krauss R M.Phospholipid transfer protein and atherosclerosis:Genetic studies take aim at a moving target[J].Circulation,2010,122(5):452-454.
[10] Igarashi M,Ma K,Gao F,et al.Disturbed choline plasmalogen and phospholipid fatty acid concentrations in Alzheimer′s disease prefrontal cortex[J].J Alzheimer′s Dis,2011,24(3):507-517.
[11] Han X.Multi-dimensional mass spectrometry-based shotgun lipidomics and the altered lipids at the mild cognitive impairment stage of Alzheimer′s disease[J].Biochim Biophys Acta,2010,1801(8):774-783.
[12] Pasvogel A E,Miketova P,Moore I M.Differences in CSF phospholipid concentration by traumatic brain injury outcome[J].Biol Res Nurs,2010,11(4):325-331.
[13] Jeong R U,Lim S,Kim M O,et al.Effect of D-allose on prostate cancer cell lines:Phospholipid profiling by nanoflow liquid chromatography-tandem mass spectrometry[J].Anal Bioanal Chem,2011,401(2):689-698.
[14] Kiebish M A,Han X,Cheng H,et al.Cardiolipin and electron tr-ansport chain abnormalities in mouse brain tumor mitochondria:Lipidomic evidence supporting the Warburg theory of cancer[J].J Lipid Res,2008,49(12):2545-2556.
[15] Loguercio C,Federico A,Trappoliere M,et al.The effect of a silybin-vitamin E-phospholipid complex on nonalcoholic fatty liver disease:A pilot study[J].Dig Dis Sci,2007,52(9):2387-2395.
[16] Schlame M,Ren M.Barth syndrome,a human disorder of cardiolipin metabolism[J].FEBS Lett,2006,580(23):5450-5455.
[17] Tian X,Bazan N G.Neuroprotection by platelet-activating factor antagonism[J].Ann N Y Acad Sci,2005,1053(1):455-456.
[18] Jan W,Dieter L,Herbert T.Hyphenated tools for phospholipidomics[J].J Biomol Tech,2008,19(3):211-216.
[19] Han X,Yang K,Yang J,et al.Factors influencing the electrospray intrasource separation and selective ionization of glycerophospholipids[J].J Am Soc Mass Spectrom,2006,17(2):264-274.
[20] Uran S,Larsen A,Jacobsen P B,et al.Analysis of phospholipid species in human blood using normal-phase liquid chromatography coupled with electrospray ionization ion-trap tandem mass spectrometry[J].J Chromatogr B Biomed Sci Appl,2001,758(2):265-275.
[21] Malavolta M,Bocci F,Boselli E,et al.Normal phase liquid chromatography-electrospray ionization tandem mass spectrometry analysis of phospholipid molecular species in blood mononuclear cells:Application to cystic fibrosis[J].J Chromatogr B Analyt Technol Biomed Life Sci,2004,810(2):173-186.
[22] Bird S S,Marur V R,Sniatynski M J,et al.Lipidomics profiling by high-resolution LC-MS and high-energy collisional dissociation fragmentation:Focus on characterization of mitochondrial cardiolipins and monolysocardiolipins[J].Anal Chem,2011,83(3):940-949.
[23] Wang C,Xie S G,Yang J,et al.Structural identification of human blood phospholipids using liquid chromatography/quadrupole-linear ion trap mass spectrometry[J].Analytica Chimica Acta,2004,525(1):1-10.
[24] Gao F,Tian X,Wen D,et al.Analysis of phospholipid species in rat peritoneal surface layer by liquid chromatography/electrospray ionization ion-trap mass spectrometry[J].Biochim Biophys Acta,2006,1761(7):667-676.
[25] Kajander K,Myllyluoma E,Kyrönpalo S,et al.Elevated pro-inflammatory and lipotoxic mucosal lipids characterise irritable bowel syndrome[J].World J Gastroenterol,2009,15(48):6068-6074.
[26] Jia L,Wang C,Zhao S,et al.Metabolomic identification of potential phospholipid biomarkers for chronic glomerulonephritis by using high performance liquid chromatography-mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,860(1):134-140.
[27] Fujiwara Y,Sardar V,Tokumura A,et al.Identification of residues responsible for ligand recognition and regioisomeric selectivity of lysophosphatidic acid receptors expressed in mammalian cells[J].J Biol Chem,2005,280(41):35038-35050.
