健康志愿者单次口服壮骨胶囊的安全性及耐受性研究
2012-05-02李进峰闫秀娟
王 冰,李进峰,闫秀娟
(威海市立医院,山东 威海 264200)
壮骨胶囊为治疗骨质疏松症药物,其主要成分为淫羊藿苷(Icarrin),分子式为 C33H40O15,分子量为 676.65,结构上属于8-异戊烯基黄酮醇苷类化合物[1].淫羊藿苷是多年生的草本植物淫羊藿(Herba epimedii)主要的有效成分,在传统中医药中,淫羊藿属补益药,具有补肾壮阳、强筋骨、祛风除湿的功效,可增强机体免疫力,降压理气[2],对治疗骨质疏松症有显著作用[3~5].
本试验选择健康志愿者,进行壮骨胶囊单次口服给药的安全性和耐受性试验,评价其耐受性和安全性,为制定Ⅱ期临床试验方案和指导临床用药提供依据.
1 对象与方法
1.1 志愿者选择 纳入标准:34名健康志愿者,男女各半,年龄19~26岁,身高、体重不超常;不嗜烟酒,并同意在试验期间内不吸烟、饮酒以及含乙醇、咖啡因等饮料,身体健康,体格检查心肺听诊及血压正常,胸、腹部叩诊、触诊无异常发现,无明显浅表淋巴结肿大,无心、肺、肝、肾、消化道、代谢异常等病史;实验室检查血常规、凝血功能、尿常规、血液生化、性激素、肝功能、肾功能正常,心电图检查正常,B超(肾、肝、胆、脾、胰)及胸部透视检查正常;无药物过敏史和神经精神系统疾病史;无体位低血压史,心率60~90次·min-1;试验前2周及试验期间不服用任何其他药物;无影响药物吸收、分布、代谢和排泄等因素;3个月内未用过已知对某脏器有损害的药物,4周内未参加过其他新药临床试验;女性志愿者排除怀孕、月经期;签署知情同意书.
排除标准:健康检查不符合标准;经常用药、嗜烟酒,4周内参加过其他临床试验;3个月内用过已知对某脏器有损害的药物,或目前正在使用药物.试验前患过重病;有胃肠、肝、肾疾病史,或现有上述疾病;有其他影响药物吸收、分布、代谢和排泄的因素.
1.2 药品 壮骨胶囊,规格:200 mg/粒,含淫羊藿提取物100 mg/粒.北京世佳九生源药业科技有限公司提供,批号:070105.试验用药,为中试放大产品,经检验合格,按临床研究要求包装.
1.3 试验设计 根据国家食品药品监督管理局2003L03779临床研究批件及药物临床研究指导原则,设计临床试验方案,报山东大学齐鲁医院国家药品临床研究基地伦理委员会讨论通过.所有志愿者人选后均自愿签订知情同意书.
1.3.1 剂量设计和志愿者分组 根据改良的Blach well法确定试验的起始剂量.采用大鼠长期毒性实验最大剂量的1/60计算起始剂量,确定最小初试剂量为600 mg,最大耐受剂量为3000 mg,共分5 个剂量组,分别为 600、1200、1800、2400及3000 mg.34名男女健康志愿者筛选合格后分别按性别、体重大小编号,随机分配到5个剂量组中,其中600 mg剂量组4名,1200 mg剂量组6名,1800、2400和3000 mg剂量组每组8名.由最小剂量组开始逐组进行试验,在确定前一个剂量组安全耐受的前提下开始下个剂量,每人只接受一个剂量,未在同一志愿者中进行剂量递增连续试验.
1.3.2 试验方法 试验在山东大学齐鲁医院药物临床研究基地Ⅰ期病房内进行.病房条件符合GCP要求.志愿者于试验前24~48 h内进行体格检查、心电图、B超检查及实验室检查,包括尿常规、血常规、凝血酶原时间、血生化、性激素及病毒学指标检查,女性志愿者进行尿HCG检查,以排除怀孕可能.筛选合格的志愿者于试验前1日入住Ⅰ期病房,晚上统一进食清淡饮食,然后禁食10 h,不禁水过夜.试验当日统一在7点空腹给药,给药后2h进食标准早餐.志愿者服药后24 h完成各项检查后方能离开Ⅰ期病房.
1.4 观察指标
1.4.1 症状和体征 由经过国家新药临床研究培训的临床医生对志愿者实施昼夜监护,观察、记录志愿者服药后不同时间的生命体征,包括体温、脉搏、呼吸、血压;观察、记录临床表现,包括神经、呼吸、泌尿、消化、心血管等系统症状和体征,以及志愿者自觉症状.
1.4.2 实验室检查 试验前日、次日不同时间进行实验室检查,包括尿常规:pH值、尿蛋白、尿糖、酮体、尿胆原、尿胆素等;血常规:红细胞(RBC)、白细胞(WBC)、中性粒细胞(NEU)、血红蛋白(Hb)、血小板(PLT)等,凝血酶原时间(PT);血生化:钾(K+)、钠(Na+)、氯(Cl-)、钙(Ca2+)、磷(P)、尿素氮(BUN)、肌酐(Cr)、总蛋白(TP)、白蛋白(ALB),丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(GGT)、碱性磷酸酶(AKP)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL),空腹血糖(GLU);性激素(雌二醇E2,睾酮T).试验前、试验当日和试验次日进行心电图检查;试验前和试验次日进行胸部透视.
1.4.3 不良事件 记录志愿者用药后主观症状及理化检查,不良事件出现的时间、程度、持续时间及处理经过.判断不良事件的发生与药物的关系,按“肯定、很可能、可能、可疑、不可能”5级分类.确定不良事件的程度:轻度(不处理、不停药)、中度(停药、不处理)、重度(停药、对症处理)、危重(住院治疗、抢救).一旦出现严重不良事件,及时抢救,并按规定记录和上报.对试验中出现不良反应者,应观察和随访至症状或体征及相应理化检查恢复正常.
1.5 数据处理 将病例资料核对无误后,双份录入计算机,建立数据库.数值变量资料以表示,用SAS软件对志愿者给药前后实验室检查指标的差异进行配对t检验,给药后的组间差异进行方差分析,对不良事件进行描述性分析.
2 结果
2.1 志愿者一般资料 各组志愿者一般资料见表1.各组志愿者用药前体格检查合格,心电图、胸透及B超检查正常,实验室检查除极个别指标超过正常参考值范围,但无临床意义外,其余检查指标均正常.试验期间无退出和剔除病例.各组性别相当,无既往病史和药物过敏史.各组志愿者年龄、身高、体重及体重指数方差分析无统计学意义(P>0.05).提示各组志愿者一般条件均衡,具有较好可比性,试验结果具有合理性及可信性.

表1 志愿者一般资料
2.2 心电图变化 各组志愿者用药前、后12 h、用药后24 h进行心电图检查,未发现有临床意义的异常变化.
2.3 尿常规变化 用药后,600 mg、3000 mg组各有1名,1200 mg、1800 mg组各有2名志愿者RBC出现升高,无临床意义;1200 mg、1800 mg组各有1名志愿者EC出现升高,无临床意义.
2.4 血常规及凝血酶原时间变化 各组志愿者用药前后血常规及凝血酶原时间检查指标见表2.各检查指标同一剂量组用药前后进行配对t检验、不同剂量组的组间差异进行方差分析.用药后个别指标超过正常值范围,但无临床意义.
表2 志愿者用药前后血常规及凝血酶原时间检查结果()

表2 志愿者用药前后血常规及凝血酶原时间检查结果()
检查指标 600 mg组1200 mg 组1800 mg 组2400 mg 组3000 mg 组±1.28 5.62 ±1.60 NEU(%) 59.45 ±7.47 59.03 ±4.20 53.40 ±4.43 53.78 ±4.66 52.75 ±9.50 52.63 ±5.90 50.97 ±7.35 53.05 ±6.87 61.02 ±6.20 849.17 ±1953.65 RBC(1012· L -1) 4.85 ±0.52 16.05 ±23.31 4.52 ±0.40 4.25 ±0.45 4.53 ±0.48 4.53 ±0.43 4.50 ±1.01 4.43 ±1.01 4.50 ±0.43 4.47 ±0.45 LYM(%) 34.33 ±6.54 34.85 ±6.56 37.75 ±8.62 37.32 ±8.61 40.40 ±10.08 39.94 ±7.87 40.03 ±7.08 38.90 ±6.35 30.92 ±14.60 40.62 ±6.50 PLT(109·L -1)212.75 ±21.06210.25 ±29.44 205.17 ±39.03184.33 ±28.58 203.83 ±24.15201.67 ±34.45 276.50 ±54.75210.67 ±30.84 313.50 ±33.05 223.00 ±27.76用药前 用药后WBC(109·L -1) 6.73 ±1.20 6.53 ±0.50 6.13 ±1.81 12.58 ±15.46 5.43 ±0.58 4.85 ±0.45 5.70 ±1.53 5.55 ±1.91 5.37用药前 用药后 用药前 用药后 用药前 用药后 用药前 用药后
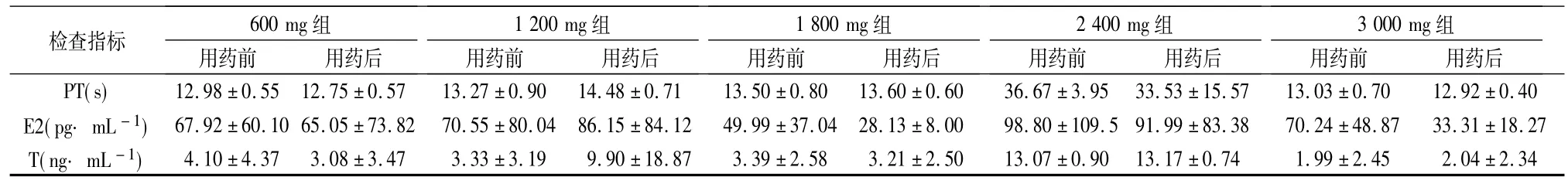
续表2:
2.5 血液生化变化 各组志愿者用药前后血液生化检查指标见表3.各检查指标同一剂量组用药前后进行配对t检验、不同剂量组的组间差异进行方差分析.
表3 志愿者用药前后血生化检查结果()
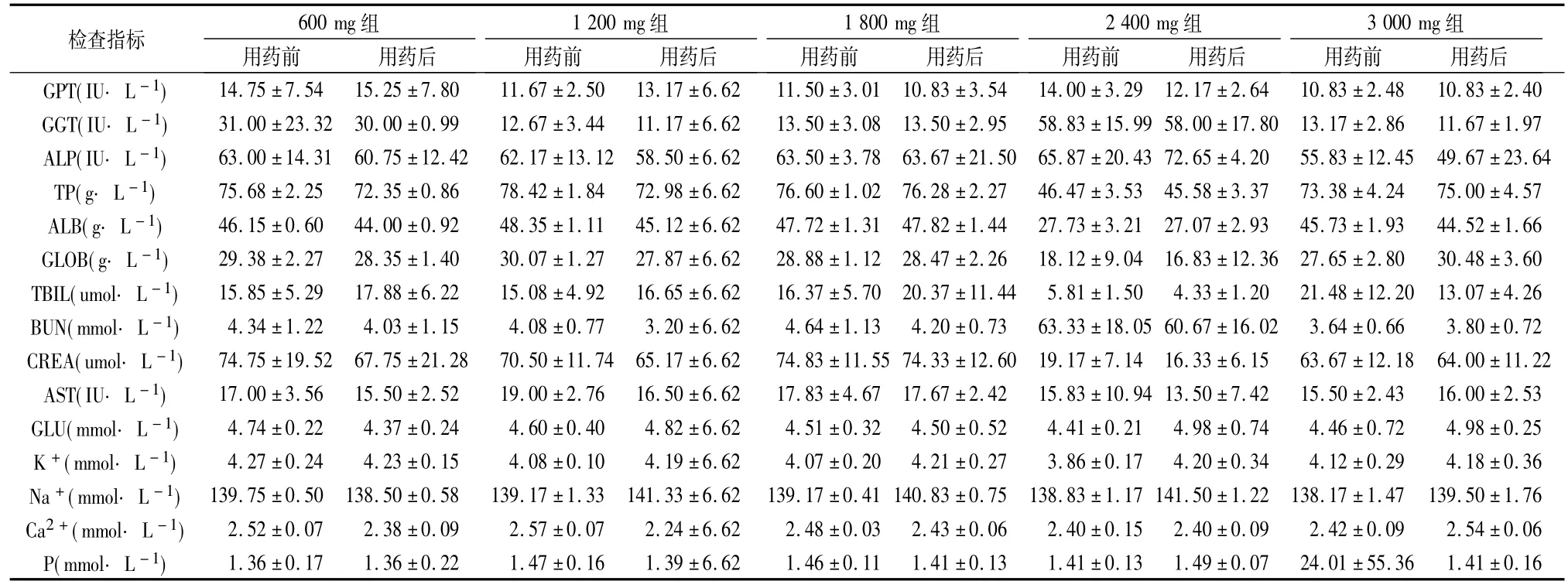
表3 志愿者用药前后血生化检查结果()
3 讨论
本研究结果表明,壮骨胶囊600~3000 mg的剂量递增耐受性方案是安全、科学、可行的.淫羊藿在中医临床应用已有千年的历史,为小檗科植物.据«中国药典»记载,淫羊藿味辛、甘,性温,归肝、肾经,具有补肾壮阳、强筋骨、祛风除湿的功效,可增强机体免疫力,降压理气.
用药前后尿常规实验室指标检查,600 mg、3000 mg组各有1名,1200 mg、1800 mg组各有2名志愿者RBC出现升高;1200 mg、1800 mg组各有1名志愿者EC出现升高,t检验无统计学意义(P>0.05),其组间差异经方差分析无统计学意义,且均未超过正常参考值范围,故无临床意义.
血常规指标,600 mg、1800 mg组各1名,3000 mg组2名志愿者LYM(%)升高;1800、2400 mg组各1名志愿者NEU(%)升高;3000 mg组2名志愿者NEU(%)降低.
血液生化指标,1800 mg组1名志愿者GLU降低,2400 mg组1名志愿者GLU升高;3000 mg组4名志愿者GLB升高;1名志愿者TBIL及P升高;各剂量组的组间差异无统计学意义.
此外,本试验中未发现性别差异.因样本量较少,尚无法明确判定,有待于临床试验及上市后大样本研究.
本试验进行中国健康志愿者单次口服壮骨胶囊的耐受性研究,壮骨胶囊给药剂量在3000 mg内较安全,志愿者耐受性良好.
[1]李梨,周岐新,石京山.淫羊藿苷药理作用研究进展[J].中国药房,2005,16(12):952 -954.
[2]张艺,肖崇厚,孟宪丽,等.HPLC法测定川产淫羊藿属植物的淫羊藿疳含量[J].中国中药杂志,1995,20(5):265-266.
[3]李青南,廖进民,吴铁,等.淫羊藿提取液防治激素所致大鼠骨质疏松的实验研究[J].中国药学杂志,1996,31(8):19-22.
[4]季晖,刘康,李绍平,等.淫羊藿总黄酮对维A酸诱导大鼠骨质疏松症的防治作用[J].中国药科大学学报,2000,31(3):64 -67.
[5]季晖,刘康,龚晓健,等.淫羊藿总黄酮对摘除卵巢大鼠骨质疏松症的防治作用[J].中国骨质疏松杂志,2001,7(1):8-12.
