中药中玉米赤霉烯酮的残留测定
2012-02-02毛丹,许勇,郑荣,陈钶,王柯,季申
毛 丹,许 勇,郑 荣,陈 钶,王 柯,季 申
(上海市食品药品检验所,上海201203)
玉米赤霉烯酮(zearalenone,ZEN),又称F2毒素,它首先从有赤霉病的玉米中分离得到,是由禾谷镰刀菌(F.graminearum)和三线镰刀菌(F.tricinctum)等镰刀菌属产生,主要污染玉米、小麦、大米、大麦等谷物.玉米赤霉烯酮具有生殖毒性、血液毒性、细胞毒性、免疫毒性和遗传毒性,可导致生殖障碍、消化系统功能紊乱[1].玉米赤霉烯酮广泛存在于霉变的玉米、高粱、小麦等谷类作物和奶制品中,A.K.ROY等人从蒺藜等六种草药中检测到了玉米赤霉烯酮[2],而Trucksess MW等人则曾报道过玉米赤霉烯酮存在于干燥人参的根粗提物中[3].为此,建立中药中玉米赤霉烯酮的检测方法,不仅可以确保人民用药安全,也可以为监督执法提供强有力的技术支撑.
目前玉米赤霉烯酮的分析测定方法基本应用于食品领域,一般采用薄层色谱法(TLC)、酶联吸附免疫法(ELISA)和高效液相色谱法(HPLC)[4~8].TLC法繁琐、耗时、灵敏度低,进行目视定量时主观性影响较大,且测定时大量接触到ZEN标准品,不利于实验人员的健康保护.而ELISA法适用于大量样品的筛选和普查,但由于酶本身的不稳定性,用此方法进行玉米赤霉烯酮的检验有可能带来假阳、阴性结果,难以达到定量的相关技术要求.目前食品中比较常用的玉米赤霉烯酮高效液相色谱测定方法,采用免疫亲和柱进行供试品溶液的净化,由于免疫亲和柱对玉米赤霉烯酮具有专属性吸附,出现假阳性的情况少.本文鉴于中药基质的复杂性,经实验摸索研究,建立了中药中免疫亲和净化-高效液相色谱的测定方法,若有阳性样品,则采用液相色谱-串联质谱进行确证.该方法重复性好、回收率高、简便灵敏,可作为中药中玉米赤霉烯酮的测定方法.
1 仪器与材料
高速均质器(德国IKA公司提供,转速采用12 500 r⋅min-1);玉米赤霉烯酮免疫亲和柱(美国VICAM公司);美国AgiLent 1100高效液相色谱仪,荧光检测器;玉米赤霉烯酮对照品(ALEXIS公司提供,Lot:L16748/b).薏苡仁、麦芽、绿豆药材均由华宇药材有限公司提供,经上海市食品药品检验所鉴定.
2 方法与结果
2.1 色谱条件 色谱柱为Inertsil ODS-3柱(4.6 mm×150 mm,5 μm),流动相为乙腈 -水(50∶50),流速1.0 mL⋅min-1,以荧光检测器检测,激发波长232 nm,发射波长460 nm,柱温:30℃,各色谱峰与相邻色谱峰的分离度均大于1.5,结果见图1.
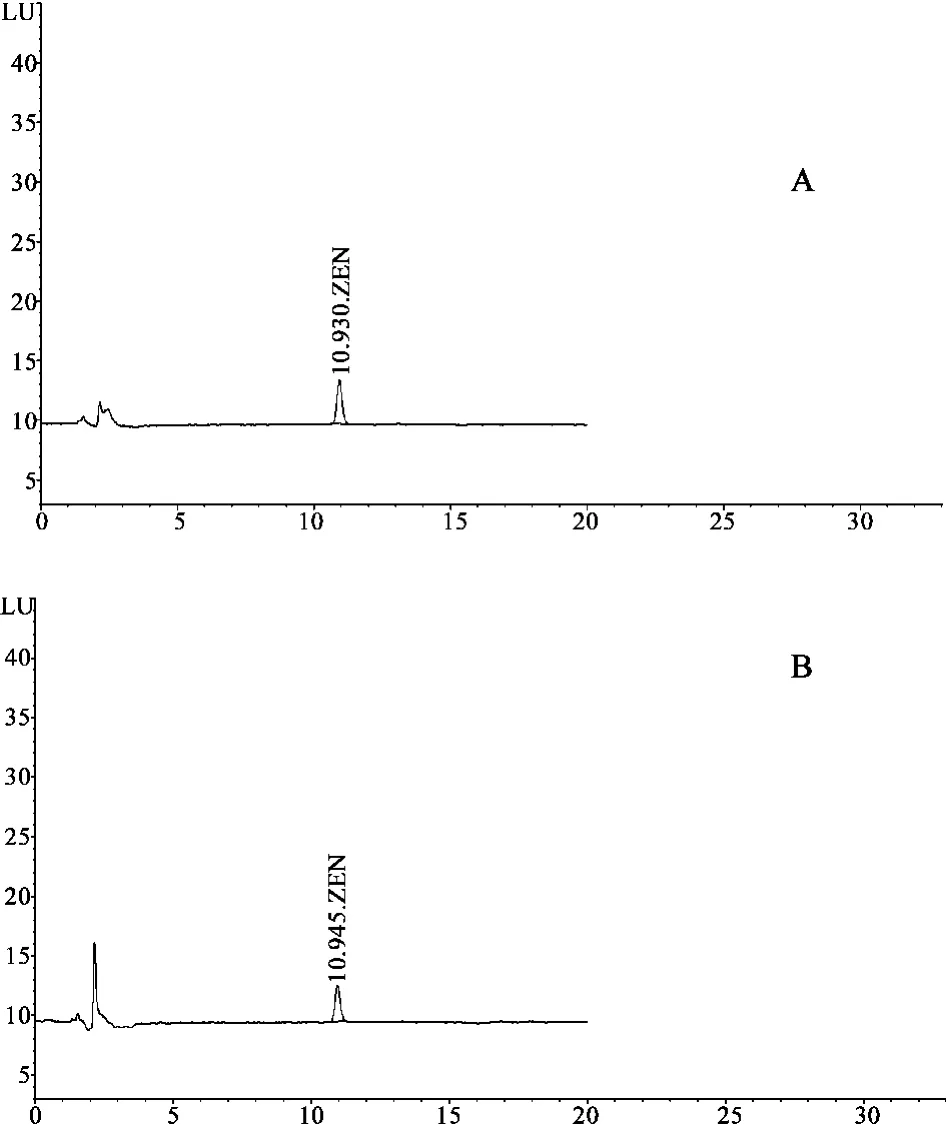
图1 高效液相色谱图
2.2 供试品溶液的制备 取样品粉末40 g(过二号筛),精密称定,置均质杯中,加入氯化钠4 g,精密加入90%乙腈100 mL,高速搅拌2 min,离心5 min(离心速度4 000 r⋅min-1),精密吸取上清液10 mL,用水稀释至50 mL,摇匀,离心,精密吸取上清液10 mL,通过免疫亲合柱(流速3 mL⋅min-1),随后用水10 mL洗脱(流速6 mL⋅min-1),洗脱液弃去,精密量取1.5 mL甲醇洗脱(流速1 mL⋅min-1),收集甲醇洗脱液,置2ml量瓶中,加甲醇至刻度,摇匀,即得.
2.3 线性关系考察 精密称取玉米赤霉烯酮对照品适量,加甲醇制成每1 mL含250 ng的溶液,作为对照品溶液(1).精密吸取对照品溶液(1)1 mL,置10 mL量瓶中,加甲醇稀释至刻度,摇匀,作为对照品溶液(2).分别精密吸取上述对照品溶液(1)2 μL、5 μL、10 μL、15 μL,对照品溶液(2)5 μL、10 μL,注入液相色谱仪,记录峰面积.以进样量(pg)为横坐标,峰面积为纵坐标,绘制标准曲线并进行回归计算,回归方程为:Y=1.970 7×10-2X-1.273 66×10-1,r=0.999 83(n= 6);结果表明,玉米赤霉烯酮在进样量为125~375 0 pg范围内峰面积与进样量线性关系良好.
2.4 进样精密度试验 精密吸取上述对照品溶液(1),按上述色谱条件连续进样6次,测定,计算玉米赤霉烯酮色谱峰面积的RSD为0.7%,结果表明仪器精密度良好.
2.5 重复性试验 取薏苡仁阳性样品粉末40 g(过二号筛),一式6份,精密称定,,按供试品溶液的制备项下依法操作,进样分析,计算RSD为5.2%,表明重复性试验结果良好.供试品溶液采用LC-MS-MS进行阳性确证,结果供试品溶液中定性离子的丰度比与对照品溶液中定性离子的丰度比相接近(见表1).
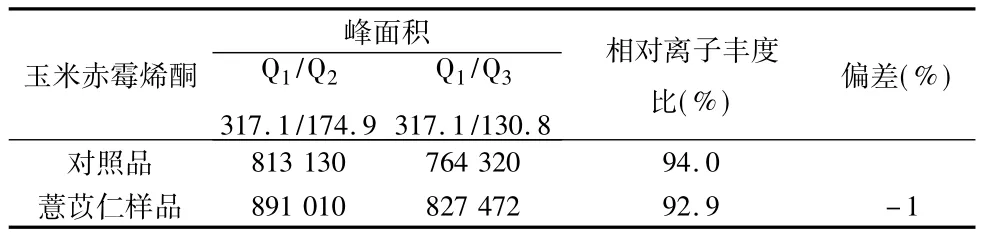
表1 质谱确证结果
2.6 回收率试验 取本品粉末(过二号筛)40 g,精密称定,一式3份,按低、中、高三种浓度水平分别精密加入玉米赤霉烯酮对照品1 μg、2.5 μg及7.5 μg,依法制备供试品溶液并测定含量,计算平均回收率(见表2),结果表明回收率试验结果良好.

表2 回收率试验结果
2.7 稳定性试验 取重复性试验用样品,每隔5 h进样分析,记录峰面积并计算RSD为3.0%,结果表明,在0~25 h之内,供试品溶液保持稳定.
2.8 检测限 测定低浓度回收率供试品溶液的信噪比,以信噪比3∶1计算得本方法检测限为15 μg⋅kg-1,以信噪比10∶1计算得本方法定量限为50 μg⋅kg-1.
2.9 样品测定
2.9.1 国际实验室能力测试结果 按照本实验所述方法参加由英国实验室CSL主办的能力验证测试项目,结果为满意.
2.9.2 样品测定结果 对上述3种共计11批样品进行检验,结果4批薏苡仁均检出玉米赤霉烯酮,结果分别为325 μg⋅kg-1、30 μg⋅kg-1、268 μg⋅kg-1、178 μg⋅kg-1.
2.10 确证实验 供试品溶液制备方法中使用的免疫亲和柱对玉米赤霉烯酮具有专属性吸附,因此一般情况下供试品溶液的高效液相色谱图比较干净,出现假阳性的情况比较少.笔者在近几年的实验中发现,随着监测品种范围和检验样品数量的扩大,某些基质复杂的样品,有时会出现假阳性的情况.因此进一步的确证实验就显得非常必要.通常,建议通过改变色谱条件比如更换仪器和色谱柱,调节流动相比例等手段进行考察.有条件的实验室,则应通过LC-MS进行确证.
本实验采用LC-MS-MS对上述阳性样品进行了确证实验.色谱柱为Acquity Uplc Beh C18(1.7 μm,2.1 mm×100 mm);以甲醇为流动相A相,以0.01%甲酸为流动相B相,流速0.3 mL⋅min-1,按表3方法进行梯度洗脱.
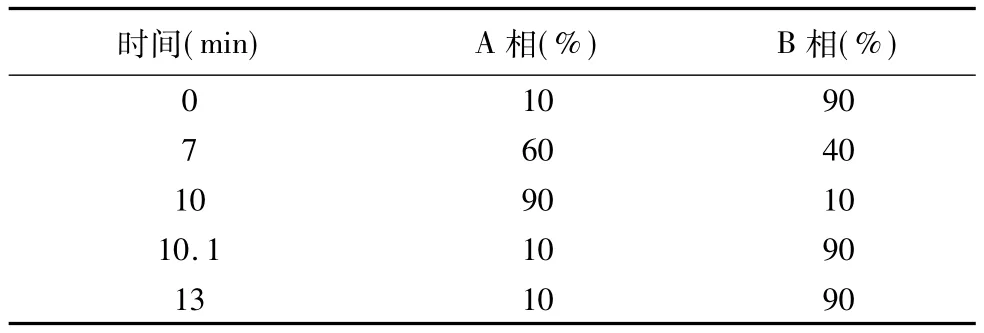
表3 流动相梯度
离子源为电喷雾离子化源ESI(-)源;毛细管去簇电压、碰撞池能量等质谱参数见表4.
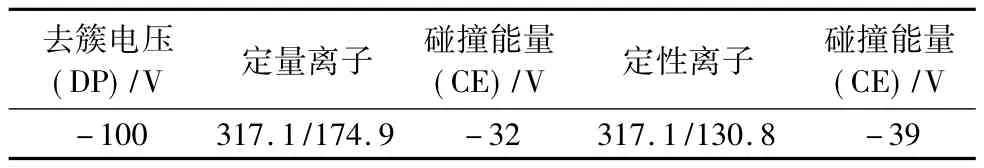
表4 质谱参数表
3 讨论
3.1 色谱条件与系统适用性试验
3.1.1 波长的选择 分别考察了:①激发波长232 nm,发射波长460 nm;②激发波长274 nm,发射波长460 nm;③激发波长274 nm,发射波长440 nm.结果以激发波长232 nm,发射波长460 nm所得色谱峰峰面积最大,峰高最高.
3.1.2 流动相系统的选择 分别考察了:①乙腈 -水(50∶50);②乙腈-水-甲醇(46∶46∶8);③1%磷酸溶液-甲醇-乙腈(40∶30∶30)3种流动相,对称因子分别为0.83、0.66、0.70.故选用对称因子较好且毒性相对较小的乙腈-水(50∶50)为流动相.
3.1.3 色谱柱的选择 分别考察了:①Intersil-ODS3(4.6 mm×150 mm,5 μm);②Agilent CB-C18(4.6 mm×250 mm,5 μm);③Waters C18(2.1 mm ×150 mm,5 μm)3种色谱柱,对称因子分别为0.95、0.74、0.88,色谱柱①的对称因子相对较好,本次实验选择色谱柱①进行研究.
3.2 供试品溶液制备方法的考察
3.2.1 提取过程 为有效的提取出玉米赤霉烯酮成分,对供试品溶液制备方法中提取溶剂、提取方式、提取时间等分别进行了考察.试验中对提取溶剂进行选择时,分别筛选了90%乙腈、90%甲醇、50%乙腈、50%甲醇4种溶剂,结果发现用90%乙腈匀浆提取2 min效率最高,故被采用.
3.2.2 净化过程 为得到较好的色谱分离效果,采用可以特效性分离出玉米赤霉烯酮的免疫亲和柱对3.2.1中提取液进行净化,同时对淋洗液及洗脱溶剂进行了选择.其中对淋洗液的种类(淋洗缓冲液和水)及用量分别进行了考察,本次试验选用的3种药材(麦芽、绿豆和薏苡仁)用水10 mL淋洗即可除去杂质干扰,得到满意的色谱分离效果;若其他样品中出现干扰杂质特别多的情况,可以先用5 mL淋洗缓冲液洗脱,再用5 mL水洗脱.
3.2.3 浓缩过程 氮吹为浓缩过程的常用方法.本次试验比较了氮吹与不氮吹的效果,结果表明,氮吹与否并不影响最终测定结果.氮吹步骤相对繁琐,因此在玉米赤霉烯酮含量可以满足色谱分析需求的情况下则不采用氮吹的步骤.若玉米赤霉烯酮含量过低,无法满足检测灵敏度要求时,可通过氮吹方式进行浓缩,以得到满意的测定结果.
3.3 确证实验 鉴于中药基质的复杂程度,若采用免疫亲和净化-高效液相色谱法测定玉米赤霉烯酮的结果为阳性,则建议采用液相色谱-串联质谱法进行进一步确证.
3.4 中药中玉米赤霉烯酮的限量 目前国内外暂无中药中玉米赤霉烯酮的限量标准,而在食品标准中对玉米赤霉烯酮的限量则有严格的规定.欧盟规定除玉米粉外的谷粉限量为75 μg⋅kg-1.巴西规定玉米中限量为200 μg⋅kg-1,奥地利规定小麦中限量为60 μg⋅kg-1.我国规定谷物及其制品如小麦、小麦粉、玉米、玉米面(渣、片)中玉米赤霉烯酮的限量标准为60 μg⋅kg-1[9],饲料中玉米赤霉烯酮的限量标准为500 μg⋅kg-1[10].鉴于玉米赤霉烯酮易滋生于谷物类产品,参照上述的玉米赤霉烯酮限量标准,建议将中药中玉米赤霉烯酮的限度规定为60 μg⋅kg-1.
[1] 姜淑贞,杨维仁,杨在宾.玉米赤霉烯酮的污染和残留及其作用机制[J].中国饲料,2011,2:41-44.
[2] Roy AK,Chourasia HK.Mycoflora,mycotoxin producibility and mycotoxins traditional herbal drugs from India[J].J Gen Appl Microbiol,1990,36(5):295-302.
[3] Trucksess MW,Scott PM.Mycotoxins in botanicals and dried fruits:a review[J].Food Addit Contam Part A Chem Anal Control Expo Risk Assess,2008,25(2):181-192.
[4] 中华人民共和国卫生部.食品中真菌毒素限量[S].食品安全国家标准GB 2715-2005,2005.
[5] 国家认证认可监督管理委员会.进出口大豆、油菜籽和食用植物油中玉米赤霉烯酮的检验方法[S].出入境检验检疫行业标准SN/T 1745-2006,2006.
[6] Kruger SC,Kohn B,Ramsey CS,et al.Rapid immunoaffinity-based method for determination of zearalenone in corn by fluorometry and liquid chromatography[J].J AOAC Int,1999,82(6):1364-1368.
[7] 叶蔚云,陈永红.高效液相色谱法测定小麦、玉米中玉米赤霉烯酮[J].中国公共卫生,1998,14(1):49.
[8] 杨福江.玉米赤霉烯酮检测方法比对研究[J].现代预防医学,2006,33(10):1824-1826.
[9] 中华人民共和国卫生部.食品中真菌毒素限量[S].食品安全国家标准GB 2761-2011,2011.
[10]中华人民共和国国家质量监督检验检疫总局.饲料中赭曲霉毒素A和玉米赤霉烯酮的允许量[S].饲料卫生标准GB 13078.2-2006,2006.
