白介素-1对培养人表皮黑素细胞增殖及黑素合成的影响研究
2012-04-29林新瑜王芳林鸿刚段西凌
林新瑜 王芳 林鸿刚 段西凌

[摘要]目的: 建立正常人表皮黑素细胞体外培养体系, 观察不同浓度的白介素-1α,白介素-1β对体外培养正常人黑素细胞的细胞增殖及黑素合成的影响。方法:采用四甲基偶氮唑盐(MTT)法测定白介素-1α及白介素-1β对黑素细胞增值的影响,NaOH裂解法测定黑素生成量,流式细胞仪检测黑素细胞的凋亡率。结果:白介素-1α及白介素-1β对黑素细胞活力有抑制作用,能使细胞增殖能力降低,黑素合成减少,增加黑素细胞的凋亡率。结论:白介素-1α及白介素-1β对体外培养的黑素细胞增殖及黑素生成都有抑制作用, 这为临床应用白介素-1α及白介素-1β治疗色素性疾病提供了实验依据。
[关键词]白介素-1α;白介素-1β;黑素细胞
[中图分类号]R758[文献标识码]A[文章编号]1008-6455(2012)06-0952-04
黑素的合成是个极其复杂的过程,在体内受金属离子、细胞因子、激素等各种因素的调节。多种细胞因子对于黑素细胞的数量、形态、酪氨酸酶活性、细胞间粘附分子-1等均有不同程度的影响[1]。IL-1是一个多功能的促炎症细胞因子家族,几乎所有有核细胞均能产生IL-1。为了研究白介素-1(Interleutin-1, IL-1)对人表皮黑素细胞增殖及黑素合成的影响,为临床应用IL-1治疗色素性疾病提供实验依据,笔者建立了正常人表皮黑素细胞体外培养体系,采用不同浓度的白介素-1α及白介素-1β作用于体外培养的黑素细胞, 观察了IL-1α及IL-1β对表皮黑素细胞增殖及黑素合成的调节作用, 现将结果报道如下。
1材料和方法
1.1 材料及仪器:MCDB-153培养基,牛胰岛素,人转铁蛋白,L-Dopa, IL-1α,IL-1β,DMSO,MTT 均购自美国Sigma公司。重组人表皮生长因子( rhEGF)购于美国Peprotech公司。牛垂体提取物(BPE)购于美国Invitrogen公司。10%新生小牛血清购自Hyclone公司。EDTA-Na2购自美国Gibco公司。氢化可的松0.5μg/ml,青霉素100IU/ml,链霉素100IU/ml,胰蛋白酶,苔盼兰均系国产。培养瓶、96孔板和6孔板均购于美国Corning公司;显微镜:观察细胞用的是OLYMPUSCK2型号;细胞计数用的是OLYMPUSCKX41型号, 照相用的OLYMPUSCH2型号;酶联免疫检测仪;流式细胞仪。标本经患者知情同意后取自18~35岁行包皮环切术的正常人包皮。
1.2 方法
1.2.1 正常人黑素细胞的培养[2-3]:将上述包皮标本消毒、修剪,用含0.2g/L EDTA-Na2的0.25%胰蛋白酶消化和离心后,将获得的MC 进行培养。在倒置显微镜下观察, 细胞呈明显的两极或多极树突形态。
1.2.2 黑素细胞鉴定[4-5]
1.2.2.1L-Dopa染色:将传代纯化后的黑素细胞,经含0.2 g/L EDTA- Na2的0.25%胰蛋白酶消化后接种于已预先放置盖玻片的 6 孔板内,待细胞贴壁并稳定生长后弃去培养液,并用预热的PBS液洗涤数次。用2.5g/L戊二醛固定后,加入用黑素细胞培养液配制的1g/L L-Dopa,37℃ 孵育4h,其间换液1次,风干后甘油封片,照相。
1.2.2.2Fontana银染:在0.15%硝酸银溶液中加入适量氨水配制成氨银液,将传代纯化的黑素细胞用戊二醛固定后加入氨银液,避光浸染约30min,PBS液漂洗3次后置倒置显微镜下观察,照相。
1.2.2.3S-100 蛋白免疫组化染色:将传代纯化后的黑素细胞,经消化后接种于已预先放置盖玻片的 6 孔培养板内,待细胞贴壁后去掉培养液。用2.5g/L 戊二醛固定后,PBS液洗涤数次,加入3%的H2O2,室温30min,以去除内源性过氧化物酶;再次用PBS液洗涤数次,滴加1:20稀释的羊血清,室温下处理15min;加入1:200兔抗 S-100蛋白的多克隆抗体,4℃ 过夜;洗涤后加入生物素标记的羊抗兔抗体,37℃、湿盒孵育1h,再次洗涤后加入辣根过氧化物酶标记的链霉卵白素,37℃、湿盒孵育1h。洗涤后DAB染色,蒸馏水适时终止,苏木素复染后用加拿大胶封片,照相。
1.2.3 黑素细胞增殖的测定:采用四甲基偶氮唑蓝比色法(MTT法)。 倒置显微镜下观察,细胞培养至80%汇合时,弃培养液上清,加入含0.2 g/L EDTA- Na2的0.25%胰蛋白酶共1~1.5ml,在75cm2的细胞培养瓶内37℃孵育3~5 min,镜下观察约80%脱落,加入5ml左右的含有10%新生小牛血清的MDCB-153培养基终止消化,转移细胞悬液到15ml离心管,1 500rpm离心3min,弃去上清,加入适量含有10%血清的MDCB-153培养基重悬细胞团块,吸取100μl到一个无菌的500μl的EP管中,加入等量的0.8%的苔盼兰溶液,室温下混匀5min,吸取100μl混合液于血细胞计数板计数。按20000个/ml接种到96孔板中,每孔150μl,37℃,5%CO2孵箱过夜培养。
第二天,弃去培养基上清,加入新鲜的MDCB-153培养基100μl /孔,备用。以无菌PBS配置的IL-1α,IL-1β溶液,其终浓度分别为50,100,200ng/ml,备用。无菌加入100μl相应浓度的IL-1α,IL-1β溶液,同时设立PBS和空白对照组,各个浓度各设5个复孔。处理后分别培养24h,48h,72h。相应处理时间后,分别弃去培养基上清,加入含MTT终浓度为0.5mg/ml的新鲜MDCB-153培养基继续培养4h,800rpm离心3min,弃去培养基上清,加入150μl的DMSO溶解甲瓒,37℃孵育15min,于波长为495nm处测吸光度值,记录数据,按公式计算其抑制率。抑制率=(对照组-实验组)/对照组x100%。
1.2.4黑素合成的测定:采用NAOH法。将处理后的黑素细胞弃去上清液。PBS洗3次,用含0.2 g/L EDTA- Na2的0.25%胰蛋白酶消化3min后,分别计数后调整细胞数目,取等数量的细胞离心后重悬于100μl的0.5mmol/L的NAOH溶液中, 37℃孵育1h后,各管加入400μl的蒸馏水稀释后,分别于405nm处和450nm测量吸光度值,按公式计算其抑制率。黑素合成抑制率 =[1-(药物孔吸光度值÷药物孔细胞密度)÷(对照孔吸光度值÷对照孔细胞密度)]×100%。
1.2.5 流式细胞术检测:细胞培养,计数等如前,按2×105/孔接种到6孔板,浓度100ng/ml的IL-1α处理组,IL-1β处理组和PBS组,空白对照组设置如前,细胞处理72h后,分别收集培养基上清到离心管中,用不含EDTA的0.25%胰蛋白酶消化贴壁细胞,消化终止如前。分别收集细胞悬液转到相应的已经收集有各自上清的离心管里,1500rpm离心3min,弃去上清,加入无菌的PBS重悬细胞团块,1500rpm离心3min,重复3次PBS清洗过程后,弃去上清,加入PI溶液,室温避光孵育30min,上机检测。
1.3 统计学处理:全部数据采用 SPSS 统计软件10.0版进行分析。
2结果
2.1 形态学结果:体外培养的正常人黑素细胞为双极、 三极和多极的树突状细胞,细胞增殖良好,细胞树突之间交织成网 (见图 1)。
2.2 黑素细胞鉴定
2.2.1 L-Dopa染色:第3代黑素细胞经0.1 %L-Dopa染色后镜下见黑素细胞胞质及树突均被染成灰黑色 (见图2)。
2.2.2Fontana银染:第3代黑素细胞经氨银液避光浸染30min,细胞被染成黑色(见图3)。
2.2.3 S-100蛋白染色:黑素细胞胞质及树突呈棕黄色阳性着色,从而可以鉴定为黑素细胞(见图4)。
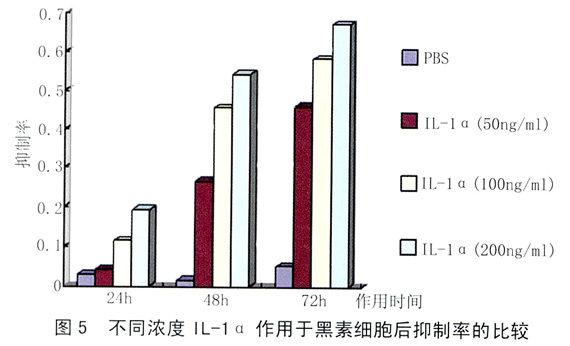
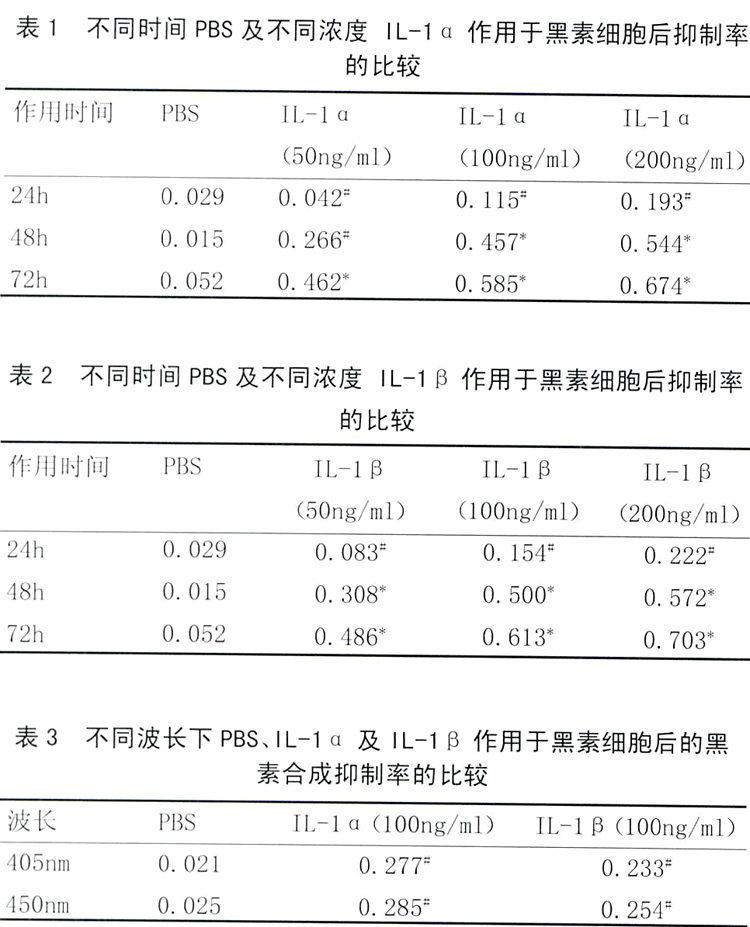
2.3 不同浓度IL-1α对人正常皮肤黑素细胞增殖率(%)的影响:黑素细胞增殖的测定结果见表1。各浓度IL-1α实验组对黑素细胞的抑制率较PBS对照组相比有统计学意义(P <0.05#或P<0.01*) 。从表1中可以看出随作用时间增加,黑素细胞抑制率逐渐增加,而且随IL-1的浓度增加,黑素细胞的抑制率也逐渐增加,说明其对黑素细胞的作用呈现出时间和剂量的相关性。
2.4 不同浓度IL-1β对人正常皮肤黑素细胞增殖率(%)的影响:黑素细胞增殖的测定结果见表2。各浓度IL-1β实验组对黑素细胞的抑制率较PBS对照组相比有统计学意义(P <0.05#或P<0.01*) 。从表2中可以看出随作用时间增加,黑素细胞抑制率逐渐增加,而且随IL-1β的浓度增加,黑素细胞的抑制率也逐渐增加,说明其对黑素细胞的作用呈现出时间和剂量的相关性。
2.5黑素合成的测定结果:见表3。405nm处和450nm处分别测量吸光度值,按公式计算其黑素合成抑制率,均可见IL-1α及IL-1β作用后黑素合成抑制率增加,而且IL-1α及IL-1β组与PBS组比较统计学上均有显著性差异(P<0.05#),但IL-1α及IL-1β两组之间比较统计学上无显著性差异(P>0.05)。
2.6流式细胞术检测:浓度为100ng/ml 的IL-1α及IL-1β作用于黑素细胞72h后用流式细胞术检测的结果:空白对照组黑素细胞凋亡率为5.5%,溶剂PBS组黑素细胞凋亡率为6.7%,IL-1α(100ng/ml)组黑素细胞凋亡率为57.3%。IL-1β(100ng/ml)组黑素细胞凋亡率为56.6%。IL-1α(100ng/ml)组黑素细胞凋亡率与空白对照组及溶剂PBS组比较差异有统计学意义(P<0.01)。IL-1β(100ng/ml)组黑素细胞凋亡率与空白对照组及溶剂PBS组比较差异也有统计学意义(P <0.01)。但IL-1α及IL-1β两组之间黑素细胞凋亡率的比较统计学上无显著性差异(P>0.05)。
3讨论
IL-1 家族有3个主要成员, IL-1α、IL-1β和IL-1受体拮抗剂(IL-1Ra)。IL-1具有介导炎症反应、 促进 T细胞和B 细胞的增殖与分化 ,参与免疫调节、 影响代谢、 刺激造血细胞及引起发热等多种生物学作用[6]。人类皮肤内的IL-1主要形式是IL-1α, IL-1β是次要形式[6-7]。Swope[8]等研究发现IL-1、 IL-6及TNF-α三种细胞因子可抑制培养黑素细胞的酪氨酸酶活性,其中IL-1最为明显,此外它们还能抑制黑素细胞的生长,但无细胞毒性作用,故认为它们可能是阻碍黑素细胞黑素生成的重要因素。本研究建立正常人表皮黑素细胞体外培养体系后 , 用不同浓度的IL-1α和IL-1β作用于黑素细胞后也发现IL-1α、IL-1β对黑素细胞活力有抑制作用 ,能使细胞增殖力降低,两者存在明显的剂量和时间效应。浓度越高,抑制率越强,与 Swope等[8]的研究一致。本研究还发现IL-1α、IL-1β还可导致黑素合成减少,增加黑素细胞的凋亡率。顾劲松等[9]采用放射免疫分析法测定白癜风患者血清细胞因子水平,泛发性患者血清IL-1β水平均显著高于对照组。Lu Y等[10]学者用角质形成细胞分泌的IL-1处理黑素细胞发现可以刺激括细胞间黏附分子-1的显著表达。LePoole等[11]观察到, 白癜风患者皮损处黑素细胞周围基质中, 细胞间黏附分子表达明显增高,高表达的细胞间黏附分子可以显著抑制黑素细胞与纤维粘连蛋白的黏附, 导致黑素细胞缺失。IL-1作为多功能的促炎症细胞因子,是否为参与引起炎症后色素脱失的主要因素,在白癜风的发病过程中起着怎样的作用, IL-1α、IL-1β究竟是通过什么通路和机制达到这些作用还有待进一步的深入研究。
[参考文献]
[1]李红,朱文元.细胞因子对黑素细胞生物学特性的影响[J].国外医学皮肤性病学分册,1996,22(4):219-221.
[2]Tsuji T, Karasek M. A procedure for the isolation of primary culture of melanocyte from new born and adult human skin[J].J Invest dermal,1983,81(2),179-181.
[3]项蕾红,郑志忠,祝绿川,等.黑素细胞体外纯培养及生物学特性鉴定[J].临床皮肤科杂志, 2001,30(3):166-167
[4]杨壮群,王正辉,荔 鹏,等. 芦荟苦素对体外培养的黑素细胞影响的实验研究[J].中国美容医学,2003,12(5):464-466.
[5]陈菊萍,冉玉平,魏大鹏,等.人黑素细胞培养最佳条件的选择和生物学鉴定[J].中国麻风皮肤病杂志,2007,23(3):214-216.
[6]Dinarello CA.Biologic basis for interleukin-1 in disease[J].Blood,1996,87(6):2095-2147.
[7]Kupper TS,Groves RW.The interleukin-1 axis and cutaneous inflammation[J].J Invest Dermatol,1995,105(1Suppl):S62-S66.
[8]Swope VB,Abdel- Malek Z,Massem LM,et al. Interleukin 1 alpha and 6 and tumor necrosis factor-alpha are paracrine inhibitors of human melanocyte proliferation and melanogenesis[J].J Invest Dermatol,1991,96(2):180-185.
[9]顾劲松,涂彩霞,谭雪晶,等.白癜风患者血清白介素、肿瘤坏死因子α及粒细胞-巨噬细胞集落刺激因子检测[J].中华皮肤科杂志,2003,36(2):73-75.
[10]Lu Y,Zhu WY,Tan C,et al.Melanocytes are potential immunocompetent cells: evidence from recognition of immunological characteristics of cultured human mel anocytes[J].Pigment Cell Res,2002,15(6):454-460.
[11]LePoole IC,vanden Wijngaard RM, Westerhof W,et al.Tenascin is overexpressedin vitiligo lesional skin and inhibits melanocyte adhesion[J].Br J Dermatol,1997,137(2): 171-178.
[收稿日期]2012-02-21[修回日期]2012-04-03
编辑/张惠娟
