LIN28B在结肠癌中的表达及其临床意义
2012-04-28庞明辉董丹丹梁耀泽胡李国新
庞明辉 王 康 伍 刚 张 伟 董丹丹 帅 平 梁耀泽胡 阳 李 平 李国新*
(1.南方医科大学南方医院普外科,广州 510515;2.四川省人民医院普外科,成都 610072;3.四川省人民医院病理科,成都 610072;4.四川省人民医院体检中心,成都 610072)
LIN28参与形成诱导成体干细胞,它高表达于胚胎干细胞,随细胞分化而逐渐低表达于分化细胞和成体组织。作为lin28的同源基因,lin28b在肝细胞癌中首先得到克隆,能够在肝细胞癌中高表达并和细胞过度增生相关[1]。目前,lin28b被认为是“癌胚基因”,可促进细胞恶性转化并特异高表达于部分进展期肿瘤,如肝细胞癌和结肠癌[2]。国内尚无lin28b表达和结肠癌关系的报道。本研究利用EnVision免疫组织化学技术检测美国Biomax结肠癌组织芯片(208例结肠癌,8例正常组织)和南方医科大学南方医院149例手术切除石蜡切片中lin28b的表达并进行染色评分,行χ2检验研究其表达强度与结肠癌临床病理特征的关系,判断lin28b在结肠癌中的临床价值。
1 材料与方法
1.1 研究对象
1)第一组研究对象:购买西安超英生物公司代理美国Biomax的结肠癌及正常组织组合微阵列芯片(编号CO2161),包含208例肿瘤和8例正常结肠组织的病理信息。该组织芯片样点直径1.0mm,厚度5 μm,采用中性甲醛固定。208例结肠癌中男118例,女90例,年龄24~82岁,平均年龄54.8岁,其高分化腺癌83例,中分化腺癌8例,低分化腺癌4例。Ⅰ期2例,Ⅱ期130例,Ⅲ期46例,Ⅳ期11例。发生淋巴结转移55例,无淋巴结转移153例,伴远处转移11例,无远处转移197例。详见表1。

表1 临床资料Tab.1 Clinical characteristics of patients/tumors at the time of diagnosis
2)第二组研究对象:在临床研究伦理学会委员会批准、病人知情同意的情况下,选择在南方医科大学南方医院普通外科2003年1月至2004年12月行手术切除的149例结肠癌组织标本,10%甲醛固定后石蜡包埋。所有标本均详细记载病人基本信息,记录肿瘤TNM分期、分化程度、淋巴结转移和远处转移情况。其中,男性患者88例,女性61例,年龄19~85岁,平均年龄56.9岁;高分化腺癌70例,中分化腺癌67例,低分化腺癌12例,原位癌1例;TNMⅠ期25例,Ⅱ期65例,Ⅲ期42例,Ⅳ期16例;发生淋巴结转移52例,无淋巴结转移97例,远处转移16例,无远处转移133例。两组研究对象均将高、中分化腺癌归入分化较好组,将低分化腺癌归入分化较差组。
3)入组与排除标准:
(1)入组标准:①首次因结肠癌就诊,未经治疗病例;②结肠单一部位病变;③两位以上病理医师共同确诊;④结肠癌病例有完整的随访资料;⑤术前均未行新辅助放化疗。
(2)排除标准:①非首次就诊病例;②结肠多部位病变病例;③家族性腺瘤性息肉及其他结肠疾病,例如溃疡性结肠炎、结肠结核、克隆病等病例;④患有身体其他部位恶性肿瘤的病例;⑤有身体免疫缺陷疾病,例如人类免疫缺陷病毒(human immunodeficiency virus,HIV)携带者或获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)患者的病例;⑥术前行新辅助放化疗者。
1.2 免疫组织化学检测
采用EnVision免疫组化技术(试剂盒购自丹麦Dako公司)检测组织芯片和石蜡切片中lin28b的表达。lin28b一抗购自英国Abcam公司,货号ab71415,稀释浓度1∶10,以PBS液代替一抗作阴性对照。由两名病理科医师在双盲情况下对每个标本进行染色评分。结果按照如下标准进行判断:阴性为无色,阳性为细胞质染色呈棕黄色。根据阳性染色细胞百分比计分:高倍镜下每张切片选择10个有代表性的视野,每个视野计数100个肿瘤细胞共计数1000个细胞。0分为阳性细胞数小于或等于5%,1分为阳性细胞数10%~25%,2分为阳性细胞数25%~50%,3分为阳性细胞数大于50%,将0~2分计为低表达,3分为高表达[3]。
1.3 统计学方法
采用SPSS17.0统计软件进行统计分析,计数资料的比较采用χ2检验。对单元格的期望频数均大于1,但有小于1/5的单元格期望频数小于5,采用连续性校正χ2检验。采用逐步回归法进行多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
1)美国Biomax结肠癌组织芯片免疫组化结果显示,lin28b在正常结肠黏膜组织中均未染色,但在结肠癌组织中均有染色且随分化程度的降低,lin28b表达强度增加(图1)。
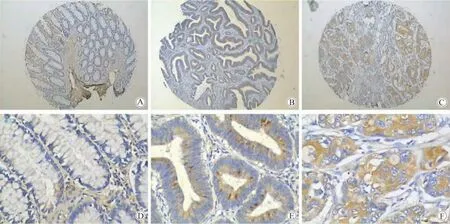
图1 Lin28在美国biomax的组合芯片中的表达(免疫组化染色)Fig.1 Expression Lin28b in colon cancer tissue microarrays detected by immunohistochemistry
2)采用χ2检验分析lin28b表达强弱和结肠癌病理学特征之间的联系,结果证实lin28b表达水平与肿瘤较差分化、较高TNM分期、淋巴结转移及远处转移有关(P<0.001),见表2。

表2 组织芯片lin28b表达与结肠癌临床病理之间的关系Tab.2 Expression of lin28b and its relationship with clinical pathology in colon cancer tissue microarrays n(%)
3)为验证前述美国Biomax结肠癌组织芯片实验的可重复性,本研究组进一步在中国南方医院的结肠癌石蜡标本中重复上述实验并得到一致的结果,显示lin28b的表达在西方和中国人群中均与进展期结肠癌病理学特征(肿瘤较差分化、TNM分期Ⅲ~Ⅳ期、淋巴结转移及远处转移)有关,见表3。
4)由于组织芯片来源于美国Biomax公司,获取的临床信息有限,且无随访资料,所以我们仅对南方医院收集到的149例临床资料及随访信息完整的结肠癌组织切片的资料进行了Logistic多因素回归分析,将lin28b表达作为因变量,年龄、性别、组织分化程度、TNM分期作为自变量纳入回归方程。逐步回归分析结果显示,仅TNM分期是lin28b高表达的独立危险因素(OR=6.583,95%CI:2.97~14.59)。

表3 组织切片lin28b表达与结肠癌临床病理之间的关系Tab.3 Expression of lin28b and its relationship with clinical pathology in paraffin-embedded surgically resected colon cancer tissues n(%)
3 讨论
lin28基因编码一种具有冷休克结构域和反转录病毒型锌指结构的胞浆蛋白,在秀丽隐杆线虫中最先发现,参与维持干细胞“干性”。lin28b是lin28的同源基因,位于6q21,长度为752个碱基,GeneBank编号为NM_001004317。二者编码的蛋白功能相近,在胚胎干细胞和发育组织中高表达,随细胞分化而逐渐低表达,在肿瘤组织中则反常高表达。lin28b实质为一种高度保守的RNA结合蛋白,大小为27 000,主要通过抑制非编码的Let-7 microRNA家族来实现其促癌作用[4-7]。lin28b/Let-7通路与多种细胞生物学功能有关,与多种肿瘤发生和发展相关,其中包括结肠癌[8]。
国内外多项研究认为lin28b多高表达于分化程度低的肿瘤[9-11]。本课题组研究结果显示lin28b在正常结肠组织中未表达,在低分化结肠腺癌组织中表达较强,高分化组织中表达较弱,这说明随肿瘤组织分化程度和lin28b表达存在负相关。Saiki Y等[12]研究发现lin28表达与结直肠癌淋巴结转移及Dukes分期显著相关,本课题组的结果也证实Ⅲ、Ⅳ期结肠癌组织中lin28b蛋白的表达显著高于Ⅰ、Ⅱ期结肠癌。多因素Logistic回归分析显示TNM分期是lin28b高表达的独立危险因素。因此,可认为结肠癌TNM分期越晚,lin28b的表达越强。
转移和复发是结肠癌患者死亡的主要原因,转移发生包括细胞与基底膜黏附、细胞外基质的降解及细胞的迁出进入血管[13]。Wang Y C 等[14]研究认为lin28b高表达可增加肝癌细胞侵袭能力,蔡民等[15]证实lin28b/Let-7通路对胆囊癌细胞在降解细胞外基质及随后的迁移方面有着重要作用。Klemke M等[16]研究指出lin28通过抑制Let-7合成并上调Let-7下游癌基因hmga2的表达而最终促进上皮细胞向间充质细胞转化,对肿瘤转移发生具有重要意义[17]。本课题组研究结果显示lin28b高表达与淋巴结转移及远处转移有关,提示lin28b高表达可能促进结肠癌细胞侵袭及转移,下一步将采用Transwell实验从分子水平研究lin28b对结肠癌细胞迁移及侵袭能力的影响。
综上,本研究采用免疫组织化学法检测干细胞相关因子lin28b在结肠癌中的表达,结果显示lin28b的高表达与结肠癌低分化、TNM分期Ⅲ-Ⅳ期、淋巴结转移及远处转移显著相关,其表达水平可作为判断结肠癌患者病程进展及预后的重要指标,本研究结果有望为结肠癌靶向治疗提供新的治疗靶点。进一步我们将利用完善的随访资料进行lin28b表达水平与结肠癌病人术后生存及复发方面的系列研究。
[1]Guo Y,Chen Y,Ito H,et al.Identification and characterization of lin-28 homolog B(LIN28B)in human hepatocellular carcinoma[J].Gene,2006,384(1):51-61.
[2]Viswanathan S R,Daley G Q.Lin28:A microRNA regulator with a macro role[J].Cell,2010,140(4):445-449.
[3]King C,Cuatrecasas M,Castells A,et al.LIN28B pro-motes colon cancer progression and metastasis[J].Cancer Res,2011,71(12):4260-4268.
[4]King C,Wang L,Winograd R,et al.LIN28B fosters colon cancer migration,invasion and transformation through let-7-dependent and-independent mechanisms[J].Oncogene,2011,30(40):4185-4193.
[5]Viswanathan S R,Daley G Q,Gregory R I.Selective blockade of microRNA processing by Lin28[J].Science,2008,320(5872):97-100.
[6]Rybak A,fuchs H ,Smirnova L,et al.A feedback loop comprising Lin-28 and let-7 conrols pre-let-7 maturation during neural stem-cell commitment[J].Nat Cell Biol,2008,10(8):987-993.
[7]Heo I,Joo C,Cho J,et al.Lin28 mediates the terminal uridylation of let-7 precursor MicroRNA [J].Mol Cell,2008,32(2):276-284.
[8]Viswanathan SR,Powers JT,Einhorn W,et al.Lin28 promotes transformation and is associated with advanced human malignancies[J].Nat Genet,2009,41(7):843-848.
[9]Helland A,Anglesio MS,George J,et al.Deregulation of MYCN,LIN28B and LET7 in a molecular subtype of aggressive high-grade serous ovarian cancers[J].PLoS One,2011,6(4):e18064.
[10]Peng S,Maihle N J,Huang Y.Pluripotency factors Lin28 and Oct4 identify a sub-population of stem cell-like cells in ovarian cance[J].Oncogene,2010,29(14):2153-2159.
[11]罗玄,吴云林,冯立新.Lin28对胃腺癌细胞株增殖周期的影响及机制[J].内科理论与实践,2010,5(1):62-67.
[12]Saiki Y,Ishimaru S,Mimori K,et al.Comprehensive analysis of the clinical significance of inducing pluripotent stemness-related gene expression in colorectal cancer cells[J].Ann Surg Oncol,2009,16(9):2638-2644.
[13]关亚伟,李世拥,安萍,等.结直肠癌患者血清中组织因子含量与临床意义的研究[J].华北国防医药,2009,21(2):1-3.
[14]Wang Y C,Chen Y L,Yuan R H et al.Lin-28B expression promotes transformation and invasion in human hepatocellular carcinoma[J].Carcinogenesis,2010,31(9):1516-1522.
[15]蔡民,李立波.靶向c-myc基因小RNA干扰对胆囊癌细胞侵袭运动的影响[J].第二军医大学学报,2010,31(9):1028-1031.
[16]Klemke M,Meyer A,Hashemi Nezhad M,et al.Loss of let-7 binding sites resulting from truncations of the 3'untranslated region of HMGA2 mRNA in uterine leiomyomas[J].Cancer Genet Cytogenet,2010,196(2):119-123.
[17]Dangi-Garimella S,Yun J,Eves E M ,et al.Raf kinase inhibitory protein suppresses a metastasis signalling cascade involving LIN28 and let-7[J].EMBO J,2009,28(4):347-358.
