白细胞介素28B(IL-28B)基因多态性与丙型肝炎病毒(HCV)感染者自发清除的相关性
2012-04-28佟小非刘三都
丛 瑞 佟小非 刘三都 谢 勇 尤 红
(1.首都医科大学附属北京友谊医院肝病中心,北京 100050;2.贵州省黔南州人民医院感染科,贵州 黔南 558000;3.贵州省平塘镇人民医院感染科,贵州 黔南 558300)
近期多项全基因组关联分析研究(genome-wide association study,GWAS)发现白细胞介素28B(interleukin-28B,IL-28B)的基因多态性(编码Ⅲ型干扰素IFN-λ3)不仅与丙型肝炎病毒(hepatitis C virus,HCV)感染者对治疗的应答有关,还与急性HCV感染者的自发清除高度相关,这些位点包括rs12979860、rs8099917、 rs10853728、 rs12980275、 rs4803219、rs4803223、rs8105790 等[1-5]。然而在目前的研究中,来自中国人的研究所占比例较少,且这些研究均来自中国台湾及美国旧金山。所以本研究探讨IL-28B基因多态性与我国HCV感染者自发清除的关系。
1 对象和方法
1.1 研究对象
本研究共纳入122例HCV抗体阳性的丙型肝炎病毒感染者,其中男性59例,女性63例,平均年龄24.4岁。在122例HCV感染者中有10例无法推断其可能的感染时间。
1.2 诊断标准
根据2004年颁布的《丙型肝炎防治指南》中规定:自发清除者为有输血史、应用血液制品史或明确的HCV暴露史,经检测HCV抗体阳性,而HCV RNA阴性的HCV感染者;慢性丙型肝炎(chronic hepatitis C,CHC)患者为HCV感染超过6个月,或发病日期不明、无肝炎史,但肝脏组织病理学检查符合慢性肝炎,或根据症状、体征、实验室及影像学检查结果综合分析,亦可诊断。这些患者均未经过干扰素联合利巴韦林的抗病毒治疗。
1.3 材料与方法
1.3.1 基因组DNA提取及IL-28B基因分型
取患者外周血凝块0.5 mL,采用离心柱方法(天根DP308提血试剂盒)提取全基因组DNA,按照说明书进行操作。采用紫外分光光度仪(Eppendorf公司,德国)检测DNA浓度。运用PCR的方法对GWAS研究的候选基因:rs12979860、rs8099917、rs10853728、rs12980275、rs4803219、rs4803223、rs8105790 扩增后用3730测序仪测序并分型(由上海英骏生物技术有限公司完成)。PCR反应条件:95℃预变性10 min;95℃变性30 s,55℃复性30 s,72℃延伸40 s,共35个循环;最后72℃延伸10 min。7个位点的引物设计由Pubmed Primer blast设计,由赛百盛公司合成,引物序列见表1。

表1 PCR测序引物Tab.1 Primers for PCR sequencing
1.3.2 HCV病毒定量
HCV定量检测采用匹基试剂检测,购自深圳匹基生物工程有限公司,检测过程严格按照说明书进行,检测下限为1 000拷贝/mL。
1.4 统计学方法
采用SPSS 11.5统计学软件对结果进行处理,采用χ2检验分析不同IL-28B基因型、性别与HCV感染者自发清除病毒的关系。采用非参数秩和检验比较不同基因型患者病毒定量的关系。以P<0.05为差异有统计学意义。
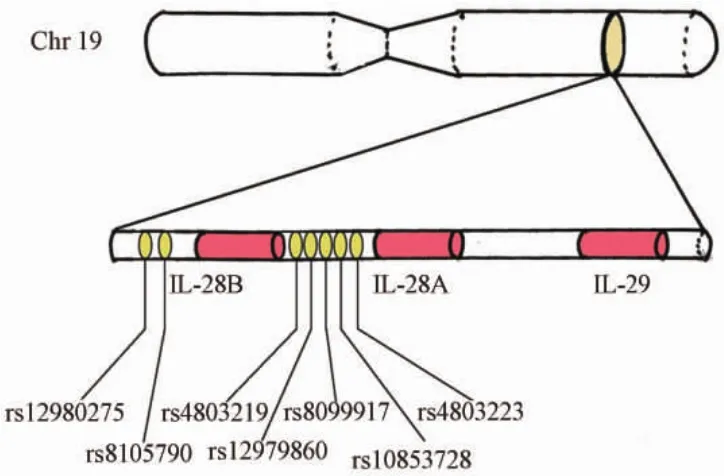
图1 IL-28B基因的7个SNP位点的位置Fig.1 Site of 7 SNPs around IL-28B gene SNP:single nucleotide polymorphism.
2 结果
2.1 入组患者的临床特点
122例患者中24例(19.7%)患者获得了自发清除,98例(80.3%)转为慢性丙型肝炎。自发清除组中,男性13例(54.2%),慢性丙型肝炎组中,男性46例(46.9%),两者间性别差异无统计学意义。在明确感染时间的112例感染者中自发清除组的平均感染年龄为(17.8±14.7)岁,而慢性丙型肝炎组为(28.8±14.6)岁,两者差异有统计学意义(P=0.002),详见表2。
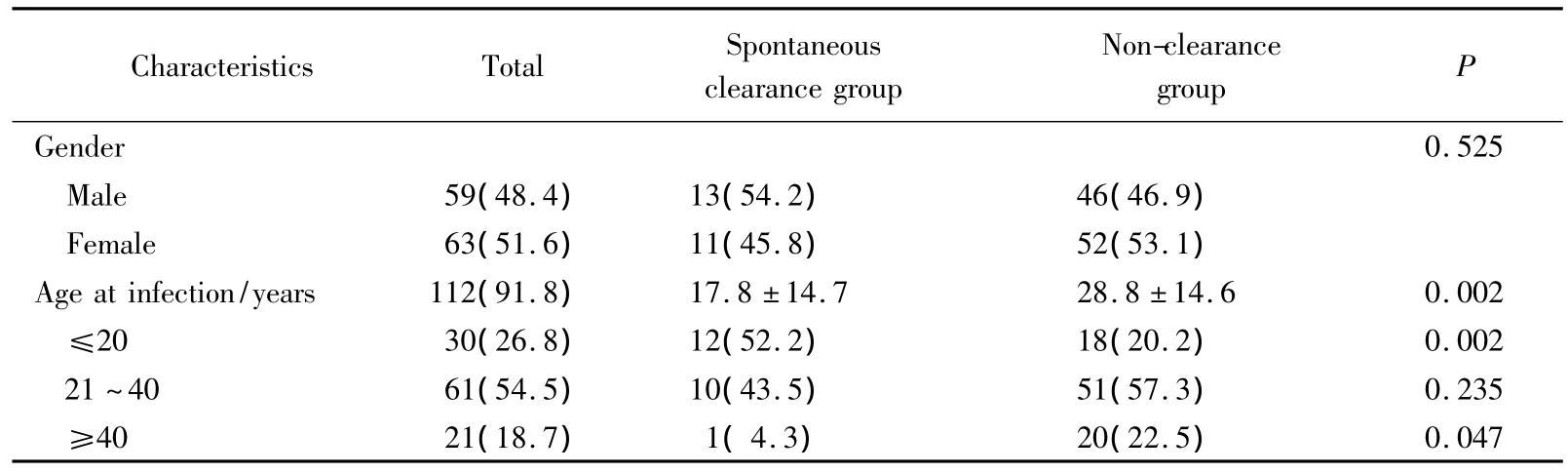
表2 入组患者临床特征Tab.2 General data between spontaneous clearance group and non-clearance group n(%)
2.2 IL-28B基因型HCV自发清除的关系
本研究中7个SNP位点中不同基因型患者间的自发清除率差异均无统计学意义(图2)。
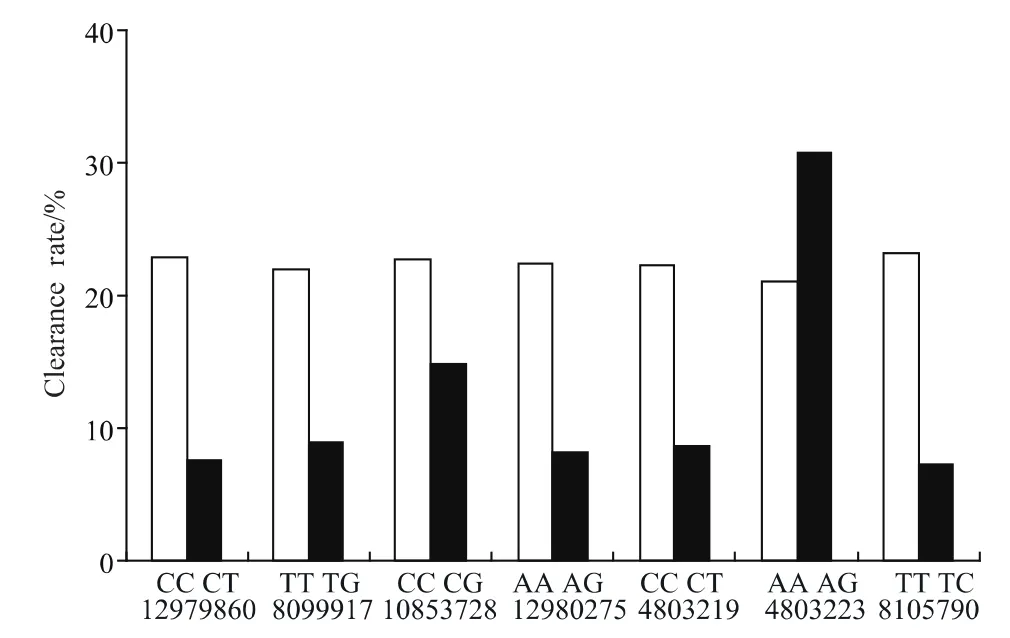
图2 IL-28B基因型与HCV自发清除的关系Fig.2 IL-28B genotype and HCV spontaneous clearance
rs12979860位点在自发清除组中CC型22人,CT型为2人,慢性丙型肝炎组中CC型74人,CT型24人。CC基因型与CT基因型2者自发清除率分别为22.9%(22/96)、7.7%(2/26),P=0.146;rs8099917位点在自发清除组中TT型22人,TG型为2人,慢性丙型肝炎组中TT型78人,TG型20人。2种基因型自发清除率分别为22%(22/100)、9.1%(2/22),P=0.279;rs12853728位点在自发清除组中CC型17人,CG型为7人,慢性丙型肝炎组中CC型58人,CG型40人,2种基因型自发清除率分别为22.7%(17/75),14.9%(7/47),P=0.293;rs12980275 位点在自发清除组中AA型22人,AG型2人,慢性丙型肝炎组中AA型75人,AG型22人。两种基因型自发清除率分别为 22.7%(22/97),8.3%(2/24),P=0.196。rs4803219位点自发清除组中CC型22人,CT型2人,慢性丙型肝炎组CC型77人,CT型21人,两种基因型自发清除率分别为22.2%(22/43),8.7%(2/78),P=0.238;rs4803223位点自发清除组AA型16人,AG型8人,慢性丙型肝炎组AA型80人,AG型18人,2者自发清除率分别为16.7%(16/96),30.8%(8/36),P=0.109;rs8105790位点自发清除组TT型22人,TC组2人,慢性丙型肝炎组TT型73人,TC组25人。2种基因型自发清除率分别为23.2%(22/95),7.4%(2/27),P=0.123,详见表3。

表3 IL-28B基因7个SNP位点与HCV自发清除Tab.3 7 SNP of IL-28B genotype and HCV spontaneous clearance n(%)
2.3 慢性丙型肝炎组患者的临床特征
本研究入组的122例患者中,经检测HCV RNA,其中98例患者病毒定量为阳性,成为慢性丙型肝炎患者,病毒水平中位数为5.58 log IU/mL,具体检测结果见表4。在98例慢性丙型肝炎患者中,29例(29.6%)患者转氨酶升高。
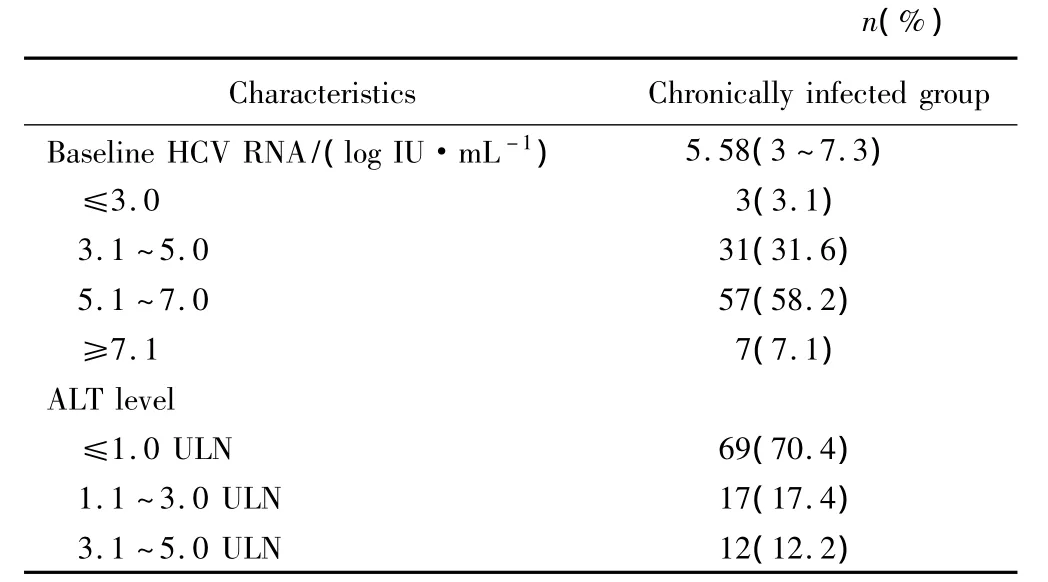
表4 慢性丙型肝炎患者临床特征Tab.4 General data in chronically infected group
2.4 慢性丙型肝炎患者基线HCV RNA水平与IL-28B基因型的关系
检测慢性丙型肝炎患者未经干扰素联合利巴韦林治疗前的基线病毒水平,采用非参数秩和检验比较rs12979860位点CC及CT型二者病毒载量水平(Z=-2.07,P=0.83);rs8099917位点TT型与TG型比较(Z=-0.366,P=0.715);rs10853728位点CC型与CG型比较(Z=-1.034,P=0.301);rs12980275位点AA型与AG型比较(Z=-1.034,P=0.301);rs4803219位点CC型与CT型比较(Z=-0.697,P=0.486);rs4803223位点AA型与AG型比较(Z=-0.005,P=0.996);rs8105790位点TT型与TC型比较(Z=-1.011,P=0.312),结果差异均无统计学意义。
3 讨论
本研究通过对IL-28B周围7个SNP位点与HCV感染者自发清除之间关系的探讨,发现IL-28B基因与我国HCV感染者自发清除无显著关联性,但患者感染时的年龄却与HCV感染者能否自发清除病毒高度相关。来自美国的横断面研究[5]显示:年龄大于20岁的HCV感染者感染后慢性化率为30%,然而小于20岁的HCV感染者为76%。另一个来自意大利的研究[6]也表明:12-25岁的HCV感染者慢性化率为56%,而年龄大于25岁的患者慢性化率则为87%。由此可见,感染时年龄越小,则自发清除率越高。本研究中自发清除组患者平均年龄较慢性化组平均年龄低,并且年龄小于20岁较大于20岁感染者自发清除率高,这些结果进一步证实年龄与HCV清除及疾病进展有关。
此外,对已经发展为慢性丙型肝炎的患者,我们也未发现IL-28B基因型与病毒载量的高低有关。王东生[7]等研究了我国394例HCV感染者rs12979860位点与HCV自发清除的关系,其中自发清除者60例,慢性丙型肝炎患者339例,结果与本研究结果类似,也未发现差异有统计学意义。究其原因,可能是由于rs12979860在我国人群中T等位基因频率(本研究中为10%,王东生等[7]研究中为 6%)较欧洲人群(32.6%)[2]低。并且由于IL-28B基因周围的SNP位点为基因多态性位点,不如突变位点对疾病的影响显著。
总之,宿主因素在急性丙型肝炎病毒感染的自发清除过程中起着十分重要的作用,IL-28B基因多态性可能预测HCV自发清除率,然而仍有其他的影响因素需要进一步深入研究,尤其在我国HCV感染人群中尤为重要。
[1]Ge D,Fellay J,Thompson A J,et al.Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance[J].Nature,2009,461(7262):399-401.
[2]Suppiah V,Moldovan M,Ahlenstiel G,et al.IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy[J].Nat Genet,2009,41(10):1100-1104.
[3]Tanaka Y,Nishida N,Sugiyama M,et al.Genome-wide association of IL28B with response to pegylated interferonalpha and ribavirin therapy for chronic hepatitis C[J].Nat Genet,2009,41(10):1105-1109.
[4]Rauch A,Kutalik Z,Descombes P,et al.Genetic variation in IL28B is associated with chronic hepatitis C and treatment failure:a genome-wide association study[J].Gastroenterology,2010,138(4):1338-1345.
[5]Alter M J,Kruszon-Moran D,Nainan O V,et al.The prevalence of hepatitis C virus infection in the United States,1988 through 1994[J].N Engl J Med,1999,341(8):556-562.
[6]Bellentani S,Tiribelli C.The spectrum of liver disease in the general population:lesson from the Dionysos study[J].J Hepatol,2001,35(4):531-537.
[7]王东生,潘煜,牛俊奇,等.IL-28B基因变异与丙型肝炎的易感性及其自然清除的关系[J].临床肝胆病杂志,2010,26(5):496-499.
