HCN1在胃肠道的分布及特点
2012-04-26王旭霞王景杰第四军医大学唐都医院消化内科西安710038通讯作者mailjingjiefmmueducn
徐 纯, 张 超, 秦 明, 王旭霞, 王景杰 (第四军医大学唐都医院消化内科, 西安 710038;通讯作者,E-mail:jingjie@fmmu.edu.cn)
超极化激活的环化核苷酸门控通道(hyperpolarization-activated cyclic nucleotide-gated cation channel,HCN)原是广泛分布于心脏窦房结、房室结、浦氏纤维、延髓呼吸中枢和脑内海马部位的节律性电活动细胞或神经元上的一类节律起始通道[1],是目前研究较为清楚的与自发节律电活动产生有关的离子通道,它受去甲肾上腺素、乙酰胆碱等神经递质和影响细胞内cAMP浓度的脑肠肽调节,它开放产生的内向电流被称为If,是自律细胞始发内向电流的主要成分之一。由于胃肠道的起搏具备典型的慢波起搏特点,既往本实验室证实在胃、食管胃肠道起搏细胞Cajal间质细胞上存在自律性节律产生离子通道—HCN亚型1(HCN1),但HCN1的存在分布有何特点尚不清楚,因此,我们通过免疫组化实验对此进行了相关的实验观察,研究HCN分布特点。

图1 HCN1在大鼠食管下段的分布情况 (Bar=50 μm)Fig 1 Expression of HCN1 in the lower esophagus of rats(Bar=50 μm)
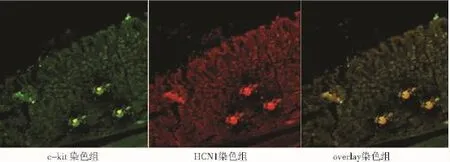
图2 HCN1在大鼠胃底体交界的分布情况(Bar=50 μm)Fig 2 Expression of HCN1 in the fundus-body junction of rats(Bar=50 μm)

图3 HCN1在大鼠十二指肠的分布情况 (Bar=50 μm)Fig 3 Expression of HCN1 in the duodenum of rats(Bar=50 μm)

图4 HCN1在大鼠空肠的分布情况 (Bar=50 μm)Fig 4 Expression of HCN1 in the jejunum of rats(Bar=50 μm)

图5 HCN1在大鼠回肠的分布情况 (Bar=50 μm)Fig 5 Expression of HCN1 in the ileum of rats(Bar=50 μm)

图6 HCN1在大鼠回盲部的分布情况 (Bar=50 μm)Fig 6 Expression of HCN1 in the ileocecal of rats(Bar=50 μm)

图8 HCN1在胃底体交界处—胃电起搏区存在 (Bar=100 μm)Fig 8 Expression of HCN1 in gastric pacing region of rats(Bar=100 μm)
1 材料和方法
1.1 实验材料
1.1.1 实验动物及处理方法 取成年SD鼠10只,雌雄各半,由第四军医大学动物中心提供,体重(250±20)g(动物合格证号:SCXK(军)2002-005)。随机均分成两组,将大鼠置于安静、温暖(20℃)、避光环境中饲养。
1.1.2 主要实验仪器、抗体及试剂 超低温冰箱(-80℃)(美国NUAIR公司);振荡切片机(日本Dosaka公司);Confocal激光共聚焦显微镜(日本O-lympus公司);兔抗C-KIT多克隆抗体1∶1 000稀释液(Sigma公司);鼠抗HCN1单克隆抗体1∶500稀释液(Sigma公司);1∶500羊抗兔FITC c-kit(Sigma公司);1∶500驴抗鼠 Texas red HCN1(Molecular Probes公司);1∶2 000鼠抗c-kit抗体(Chemicom公司)和1∶2 000兔抗HCN1抗体(Chemicom公司);1∶500驴抗兔IgG(Sigma公司)等。
1.2 实验标本的处理、检测
1.2.1 取材和固定 将10只SD鼠在40 mg/kg戊巴比妥钠麻醉下,开胸经左心室至升主动脉插管,先以100 ml生理盐水冲洗血液,随后用冷的(4℃)含40 g/L多聚甲醛的0.1 mol/L磷酸盐缓冲液(PB,pH7.4)先快后慢灌流固定2h。取食管下段、胃底体交界1/3处、空肠、回肠及回盲部,置于300 g/L蔗糖中(4℃)直至组织沉底,恒冷箱切片机切制连续冠状切片,片厚30 μm,切片分套,置于0.01 mol/L PBS中存放。
1.2.2 免疫荧光化学标记 切片在0.1 mol/L PBS中漂洗后,放入含0.3%Triton X-100的0.1 mol/L PBS中浸泡30 min(室温)。然后进行免疫组织化学荧光染色:①分别入兔抗c-kit多克隆抗体稀释液(1∶1 000)、鼠抗 HCN1 单克隆抗体稀释液(1∶500,Sigma),孵育24 h(室温);②加入结合了荧光素的二抗:羊抗兔 FITC(1∶500)c-kit;驴抗鼠 Texas red(1∶500)HCN1,避光孵育 2 h(室温)。0.01 mol/L PBS洗3次后,80%甘油封片后,将实验组和对照组的切片各取10张,在Confocal激光共聚焦显微镜下观察采图。
2 结果
2.1 HCN1在大鼠胃肠道的分布状况 实验结果显示,Cajal间质细胞呈网格样,染色呈黄褐色荧光,HCN1染色呈橘红色荧光。HCN1在大鼠胃肠道中分布,食管下段可见其有较高密度的分布(见图1),其荧光光度值为(98±5);胃底体交界处(荧光光度值为108±5)较十二指肠分布密度(荧光光度值为81±5)高,且存在统计学差异(P<0.05);胃底体交界处HCN1的分布密度较空肠(荧光光度值为54±5)、回肠(荧光光度值为 51 ±5)为高(P <0.05),但HCN1在空肠和回肠的分布密度未见有统计学差异(P>0.05);HCN1在大鼠回盲部(荧光光度值为78±5)的分布与十二指肠的分布情况相接近,二者相比未见统计学差异(P>0.05),见图1-7(见第634,635 页)。
2.2 HCN1在胃底体交接处—胃电起搏区分布特点放大分析 实验结果显示,HCN在c-kit表达阳性细胞上成点状分布于胃底体交界处ICC-MY的细胞膜上(其荧光光度值为81±5),在胃底体交接处ICC-MY,ICCs以8-10个细胞成群紧密排列分布于肌层间(图8,见第636页)。
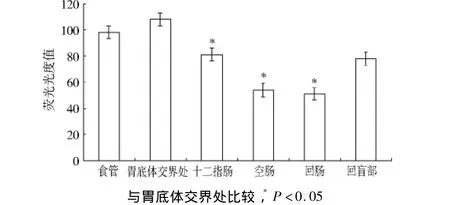
图7 HCN1在大鼠胃肠道分布情况的荧光光度值对比分析Fig 7 OD value of HCN1 in the gastrointestinal tract of rats
3 讨论
胃肠道慢波,即基本电节律(basic electric rhythm),它决定着平滑肌收缩节律,调控胃肠运动。目前,位于肠道环行肌黏膜下边缘以及肠肌丛的ICCs(ICC-MY)目前被认为是胃肠慢波活动的起搏与扩布者[2]。ICCs不仅发起胃肠节律性电活动,同时通过参与胃肠递质的转导而调节胃肠运动[2]。但其调节的具体机制还未被阐明,可能跟产生自发节律电活动关键的离子通道息息相关[3]。
HCN通道是Di Francesco于20世纪80年代初研究兔窦房结起搏活动时发现并称之为特种离子流(funny current,If或 queer current,Iq)[4-7],原因在于它与已知的电压依赖性通道在膜电位去极化时开放不同,在膜超极化时被激活[8-10],尽管不同异构型HCN动力学特征各异,但它们所产生的电流都具有超极化激活,钠、钾离子混合通透,受胞内cAMP的直接调节以及微弱的单通道电导的特征。如果HCN在胃肠道中也存在,而且也具有其在心脏以及呼吸中枢中的相似起搏作用特点[11,12],那么,胃肠道动力起搏的作用机制则将得到进一步的完善。
从本实验研究中我们可以看到,在大鼠胃电起搏区和回盲部的Cajal细胞上,已经明确看到有HCN1的存在,虽然在胃电起搏区分布较回盲部略显密集,但是二者荧光光度值未见有统计学差异。从本研究HCN1的分布情况中我们发现,在胃电起搏区即胃底体交界1/3处,HCN1的分布较十二指肠为高,而且我们知道,在胃肠蠕动频率上十二指肠的蠕动频率较胃快,是否与HCN1存在的数量以及激活情况存在着密切关系,值得我们进一步研究。从本实验中我们还看到十二指肠HCN1的分布与回盲部的分布情况接近,从这一点给我们予以提示,目前临床上很多胃肠动力药物对于结肠动力的改善效果均不明显,是否是有关键的促胃肠动力的通道未被明确,从而使很多目前结肠动力障碍性疾病的治疗不能取得满意效果。
综上所述,HCN1存在于胃肠道ICC细胞上,但是不同的部位具有不同的分布状况,这为我们了解胃肠运动调节机制以及治疗胃肠运动障碍疾病提供了新的思路。
[1] Harzheim D,Pfeiffer KH,Fabritz L,et al.Cardiac pacemaker function of HCN4 channels in mice is confined to embryonic development and requires cyclic AMP[J].EMBO J,2008,27(4):692-703.
[2] Huizinga JD,Thuneberg L,Kluppel M,et al.W/kit gene required for interstitial cells of Cajal and for intestinal pacemaker activity[J].Nature,1995,373:347 -349.
[3] Sanders KM,Koh SD,Ward SM,et al.Interstitial cells of Cajal as pacemakers in the gastrointestinal tract[J].Annu Rev Physiol,2006,68:307-343.
[4] Robinson RB,Brink PR,Cohen IS,et al.Ifand the biological pacemaker[J].Pharmacol Res,2006,53:407 - 415.
[5] Zagotta WN,Oliveer NB,Black KD,et al.Structural basis for modulation and agonist specificity of HCN pacemaker channels[J].Nature,2003,425:200 -205.
[6] Milanesi R,Baruscotti M,Gnecchi-Ruscone T,et al.Familial sinus bradycardia associated with a mutation in the cardic pacemaker channel[J].N Engl J Med,2006,354:151 -157.
[7] Li D,Song LS.Deciphering the pecking order of HCN4 expression in the developing heart:lessons from chicken[J].Heart Rhythm,2011,8(8):1264 -1265.
[8] Robinson RB,Siegelbaum SA.Hyperpolarization activated cation currents:from molecules to physiological function[J].Annu Rev Physiol,2003,65:45:480 -488.
[9] Tu HY,Deng LB,Sun Q,et al.Hyperpolarization activated,cyclic nucleotide gated cation channels:Roles in the differential electrophysiologica properties of rat primary afferent neurons[J].J Neurosci Res,2004,76:13 -722.
[10] Chaplan SR,Bach FW,PogrelJW,et al.Quantitative assessmentof tactile allodynia in the ratpaw[J].J Neurosci Methods,1994,53:55-63.
[11] Bridges D,Thompson SWN,Rice ASC.Mechanism in neuropathic pain[J].Br J Anaesth,2001,87:12 -26.
[12] Yagi J,Sumino R.Inhibition of a hyperpolarization activated current by clonidine in rat dorsal root ganglion neurons[J].J Neurophysiol,1998,80:1099 -1104.
