转化生长因子-β1、Smad3、结缔组织生长因子在慢性萎缩性胃炎中的表达及意义
2012-04-26张晓敏西安交通大学医学院第二附属医院消化内科西安710004
刘 欣, 张晓敏, 董 蕾 (西安交通大学医学院第二附属医院消化内科, 西安 710004)
慢性萎缩性胃炎是消化系统的常见病及多发病,合并肠化及不典型增生被称为癌前疾病,目前尚无有效的治疗手段,因此对其病因及发病机制的研究可为其防治提供新思路。萎缩性胃炎的病理改变为固有腺体减少并被纤维组织、纤维肌性或肠上皮化生、假幽门腺替代。幽门螺杆菌(Helicopter pylori,Hp)感染可以引起炎性细胞浸润,破坏黏膜腺体引起萎缩[1]。而转化生长因子-β1(transforming growth factor-β1,TGF-β1)、结缔组织生长因子(connective tissue growth factor,CTGF)是近年来发现的具有促纤维化作用的重要因子,CTGF主要通过Smads通路进行信号转导,其中 Smad3 蛋白是必需的[2,3]。本实验主要研究在萎缩性胃炎中 TGF-β1、Smad3、CTGF的表达变化,同时探讨Hp感染对萎缩性胃炎的发生及上述因子的影响。
1 资料与方法
1.1 病例资料 收集2010-12~2011-07经我院胃镜检查诊断为慢性胃炎患者128例,其中男性67例,女性61例,年龄17-74岁,平均年龄(55.1±12.3)岁。所有患者除外其他器质性病变,检查前1周内未服用抗生素、质子泵抑制剂及黏膜保护剂。
1.2 组织处理 分别在胃窦及胃体大小弯侧各取2块组织,固定于10%福尔马林溶液,包埋于石蜡中,切片后行HE染色及免疫组化检测。
1.3 胃炎分型 根据2006年《慢性胃炎共识意见》[4]对HE标本进行病理分型。
1.4 幽门螺杆菌测定 幽门螺杆菌(Hp)经13C呼气试验及快速尿素酶法检测,其中任一项阳性为Hp阳性,两项均阴性为Hp阴性[5]。
1.5 免疫组化法检测TGF-β1、CTGF、Smad3 采用免疫组化 SP法。一抗转化生长因子-β1(bs-0103R)、Smad3(bs-3484R)、结缔组织生长因子(bs-0743R)购于北京博奥森公司,采用1∶100浓度稀释。SP检测试剂盒(SP-9001),DAB(ZLI-9032)购于北京中杉金桥生物技术有限公司。步骤如下:石蜡切片经二甲苯脱蜡,梯度乙醇水化后,置于枸橼酸钠修复液(0.01 mol/L,pH 6.0)中,经高压锅加热进行抗原修复。加入3%过氧化氢溶液15 min,以消除内源性过氧化物酶活性,切片滴加一抗后4℃冰箱过夜。次日切片37℃复温30 min,PBS冲洗后按说明书滴加SP试剂,DAB显色,苏木素复染,中性树脂封片。以PBS代替一抗作为阴性对照。
1.6 免疫组化结果判定 采用综合评分法[6],根据阳性细胞数及细胞着色深度分别记分。每片随机观察5个具有代表性的高倍视野,计数500个细胞中染色阳性数,按切片中阳性数量百分比评分:<5%为0分;6%-25%为1分;26%-50%为2分;51%-75%为3分;76%-100%为4分。以细胞质或细胞膜被染成棕黄色为阳性细胞,按切片中细胞着色深浅评分:细胞无着色为0分;浅黄色1分;棕黄色2分;棕褐色3分。两者分数相乘为最后积分:0分为阴性(-),1-4分为弱阳性(+),5-8分为阳性(++),9-12分为强阳性(+++)。
1.7 统计学分析 应用SPSS12.0统计学软件进行统计学分析,组间采用Wilcoxon秩和检验、χ2检验进行差异性分析,Spearman秩相关进行相关性分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 胃炎分型 128例慢性胃炎患者中,其中萎缩性胃炎75例,非萎缩性胃炎53例。萎缩性胃炎中,其中胃窦萎缩66例,胃窦合并胃体萎缩9例。胃窦轻度萎缩36例,中-重度39例。胃窦萎缩并肠化15例,并不典型增生6例。
2.2 Hp感染率 75例萎缩性胃炎中Hp阳性者51例,感染率为68.1%;53例非萎缩性胃炎Hp阳性者26例,感染率为49.1%,两者Hp感染率之间差异有统计学意义(P <0.05)。
2.3 胃窦黏膜中 TGF-β1、CTGF、Smad3 的表达TGF-β1主要表达于胃窦部黏膜浅层的单核细胞中,CTGF主要表达于单核细胞、成纤维细胞、肌成纤维细胞及平滑肌细胞中,Smad3主要表达于单核细胞及固有腺细胞中。
TGF-β1在萎缩组中的表达强度与非萎缩组相比差异有统计学意义(P<0.05);在萎缩组中Hp阳性及阴性组间表达强度有统计学差异(P<0.05)。在非萎缩、轻度萎缩及中-重度萎缩组间表达强度比较均有统计学意义(见表1)。
CTGF在萎缩组中的表达强度与非萎缩组相比差异有统计学意义(P<0.05);在萎缩组中Hp阳性及阴性组间表达强度有统计学差异(P<0.05)。在非萎缩、轻度萎缩及中-重度萎缩组间表达强度比较结果见表2。
Smad3在萎缩组中的表达强度与非萎缩组相比差异有统计学意义(P<0.05);Smad3在萎缩组中Hp阳性及阴性组间表达强度无统计性差异(P>0.05)。非萎缩、轻度萎缩及中-重度萎缩组间表达强度比较均无统计学差异(见表3)。
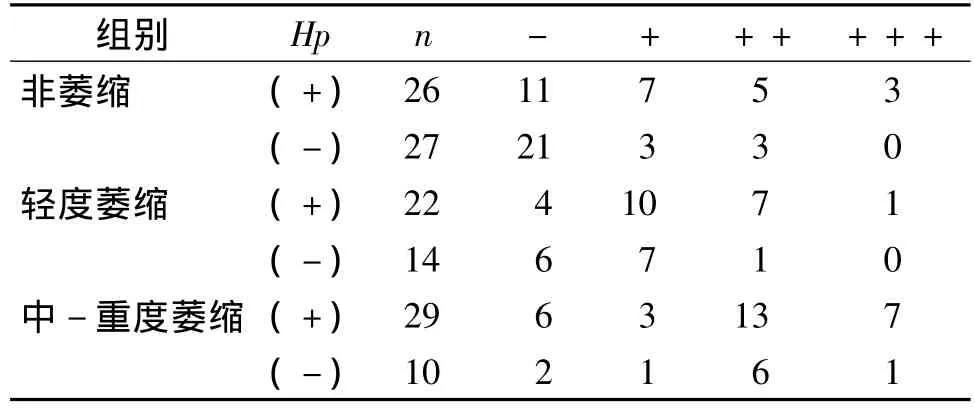
表1 各组胃窦黏膜TGF-β1表达强度的比较 (例)Tab 1 Expression of TGF-β1 in gastric antral mucosa in different groups (cases)
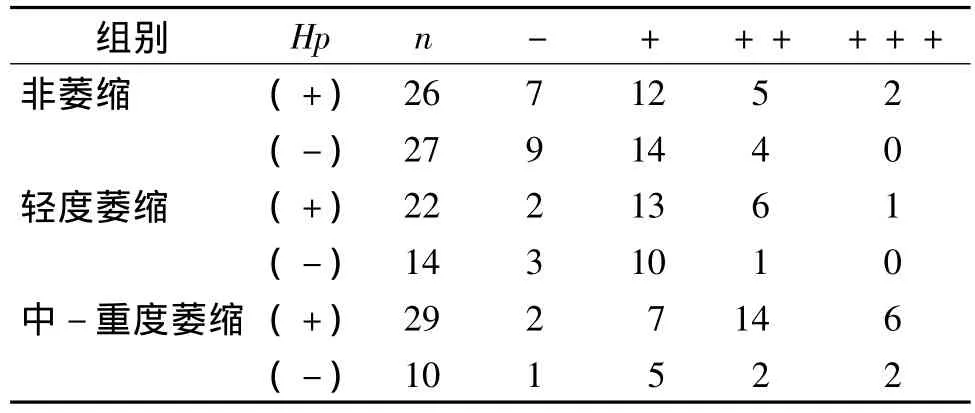
表2 各组胃窦黏膜CTGF表达强度的比较 (例)Tab 2 Expression of CTGF in gastric antral mucosa in different groups (cases)

表3 各组胃窦黏膜Smad3表达强度的比较 (例)Tab 3 Expression of Smad3 in gastric antral mucosa in different groups (cases)
胃窦萎缩合并肠化15例,TGF-β1表达阳性(++)及强阳性(+++)者为11例,CTGF表达阳性(++)及强阳性(+++)者为13例,表达强度均有增高趋势,但因例数较少,未能进行统计学分析。
胃窦萎缩合并不典型增生6例,TGF-β1表达阳性(++)及强阳性(+++)者为5例,CTGF表达阳性(++)及强阳性(+++)者为4例,表达强度均有增高趋势,但因例数过少,未能进行统计学分析。
2.4 胃体黏膜中 TGF-β1、CTGF、Smad3 的表达TGF-β1、Smad3、CTGF 主要表达于固有腺细胞中,胃体萎缩中可见间质TGF-β1、Smad3、CTGF表达增多。
2.5 萎缩性胃炎中 CTGF与 TGF-β1及 Smad3的相关性分析 萎缩性胃炎中CTGF与TGF-β1表达呈正相关(r=0.532,P <0.05),TGF-β1 与 Smad3 表达呈正相关(r=0.296,P <0.05),CTGF 与 Smad3 表达呈正相关(r=0.331,P <0.05)。
3 讨论
炎症可以使结缔组织通过间质细胞增生、迁移、积聚及细胞外基质沉积而发生纤维化反应。尽管不同器官的慢性炎症由不同原因引起,但是都可以使巨噬细胞、粒细胞、T细胞等炎性细胞浸润及促炎因子释放,最终导致局部成纤维细胞增生,同时协同上皮细胞互相作用进而分化成肌成纤维细胞,这种细胞是细胞外基质重要来源[7]。
TGF-β1是致组织纤维化的重要因子,在结缔组织纤维化、病理性瘢痕形成、以及肝、肾、心、肺等多种组织器官纤维化疾病中表达增加[7]。TGF-β1、CTGF是成纤维细胞的促有丝分裂原及趋化因子,可以刺激成纤维细胞转化为激活的肌成纤维细胞,进而转化为平滑肌细胞。萎缩性胃炎同样存在炎性细胞浸润,间质纤维组织及纤维肌性组织增生。有研究发现TGF-β1可能促进萎缩性胃炎的发生,并且在Hp相关性胃炎中表达增高[8,9]。CTGF是近年来发现的介导TGF-β1促纤维化作用的一个重要的下游因子,临床和实验研究均已证实CTGF的表达与纤维化程度积分呈显著正相关[10]。CTGF主要通过Smads通路进行信号转导,其中受体调节性Smad3 蛋白必不可少[2,3]。我们的研究发现 CTGF及TGF-β1随着萎缩程度的加重,阳性细胞数增多,并且在Hp阳性组间更为显著,说明TGF-β1及CTGF可能参与胃黏膜萎缩的进程。由于TGF-β1具有多种生理学效应,如参与自身免疫及炎症反应,调控肿瘤生长等,因此,针对纤维化疾病,TGF-β1阻滞剂的应用很难避免对机体的这些生理效应产生影响。许多研究发现CTGF可以介导TGF-β1诱导的纤维化反应,但是CTGF是否参与TGF-β1介导的免疫调控及炎症反应,Kunzmann等[11]对此做了回答,他们发现CTGF对TGF-β1诱导的CD4 T淋巴细胞增殖毫无影响,但是关于自身免疫的研究还有大量的工作需要完成。Mori等[12]在小鼠的皮肤纤维化模型中发现,连续皮下注射7d TGF-β1,仅仅可以引起短期的纤维化组织增生,而同时注射CTGF则可以引起持续稳固的纤维组织增生。因此,胃黏膜中TGF-β1及CTGF的表达上调,可能会诱发持久的纤维组织增生,特异性的抗纤维化治疗(CTGF的拮抗剂等)可能会阻止萎缩性胃炎的进展,尚需进一步建立动物模型进行观察。
本研究发现Smad3蛋白在非萎缩及萎缩组间有统计学差异,并且Smad3与TGF-β1及CTGF表达呈正相关,说明Smads通路参与胃内TGF-β1介导的免疫抑制及纤维化反应。但是Smad3蛋白在萎缩组间无统计学差异,考虑为Smad3蛋白对TGF-β1起到负反馈调节作用,同时CTGF在中-重度萎缩性胃炎中明显增加,提示CTGF的生物学效应除经Smads通路产生,尚存在其他的信号通路,如Ras/MEK/Erk、蛋白激酶C和酪氨酸激酶等,从而促进胃内间质纤维化发生[7,13],其作用机制如何,Smads通路与其他通路的交叉等等尚需进一步研究。
Hp感染可以引起炎性细胞浸润,破坏胃黏膜腺体,Hp感染的黏膜层内发生组织损伤-修复-再损伤-再修复的炎症过程,损伤黏膜由纤维化或肠化组织修复重建,同时胃黏膜的萎缩也开始发生,根除Hp后纤维化及肠化的可逆性证据很少[14]。流行病学发现有Hp感染者较无Hp感染者萎缩性胃炎的发病率升高,我们的研究资料也发现萎缩性胃炎较非萎缩性胃炎Hp的感染率高,差异有统计学意义,说明Hp是萎缩性胃炎的重要致病因素,另外,胆汁反流、宿主遗传性,获得感染时的年龄,宿主酸分泌状态以及高盐、低维生素饮食等因素也可能导致萎缩性胃炎的发生[15]。Hp感染后上皮细胞主要通过上调Th1细胞参与免疫反应,表现为黏膜组织内活化的CD4+细胞浸润,Th1型细胞因子IL-1、TNF-α、TGF-β 及 IFN-γ 增加[16]。TGF-β1 对黏膜炎症具有负性调节作用,我们的研究结果也发现在萎缩性胃炎中TGF-β1、CTGF表达的细胞在 Hp阳性组中明显增多,因此早期根除Hp可能预防萎缩性胃炎的发生及进展。
本研究中萎缩性胃炎胃体萎缩只占有12%,说明我国萎缩性胃炎以胃窦萎缩为主。Fujisawa等[17]研究发现胃黏膜的主细胞及壁细胞表达TGF-β1。胃体部 TGF-β1、Smad3、CTGF 在固有腺细胞中有弱阳性表达,说明上述因子少量表达即可确保结缔组织的生理性更新。动物实验发现胃壁细胞表达CTGF参与局部创伤的修复及肉芽形成的调节,抑酸治疗后可增强这一代偿机制[18]。这与我们在胃体萎缩标本中发现除间质细胞外,胃固有腺细胞较多表达CTGF一致,但尚需增加病例数在胃体萎缩中进一步研究。
值得注意的是TGF-β1/Smad3/CTGF在胃癌细胞及癌前病变中也有表达[19,20],在肿瘤早期具有抑制肿瘤增殖的作用,但晚期开始与肿瘤细胞的增殖、分化、迁移、临床预后密切相关,其具体的机制目前尚不清楚,我们的研究发现TGF-β1、CTGF在非化生性萎缩性胃炎、化生性萎缩性胃炎及不典型增生组中表达强度有增高的趋势,但例数较少,还有待于进一步在癌前病变及胃癌中进行相关研究。
[1] Malfertheiner P,Megraud F,O’Morain C,et al.Current concepts in the management of Helicobacter pylori infection:the Maastricht III Consensus Report[J].Gut,2007,56(6):772-781.
[2] Bonniaud P,Margetts PJ,Ask K,et al.TGF-β and Smad3 signaling link inflammation to chronic fibrogenesis[J].J Immunol,2005,175(8):5390-5395.
[3] Vetuschi A,Sferra R,Latella G,et al.Smad3-null mice lack interstitial cells of Cajal in the colonic wall[J].Eur J Clin Invest,2006,36(1):41-48.
[4] 中华医学会消化病学分会.中国慢性胃炎共识意见[J].中华消化杂志,2006,11(11):675-684.
[5] 中华医学会消化病学分会幽门螺杆菌学组.第三次全国幽门螺杆菌感染若干问题共识报告[J].中华内镜杂志,2008,4(4):346-349.
[6] 钟秋娌.隆起糜烂性胃炎脾胃湿热证与IL-8、TNF-α、IL-10的相关性研究[D].福州:福州中医药大学,2010.
[7] Pohlers D,Brenmoehl J,Löffler I,et al.TGF-β and fibrosis in different organs-molecular pathway imprints[J].Biochimica et Biophysica Acta,2009,1792(8):746-756.
[8] 孙宇,刘毅强,冯国双,等.转化生长因子-β1在萎缩性胃炎发生中的作用[J].北京大学学报:医学版,2009,41(6):635-639.
[9] Li Zhongwu,Li Jiyou.Local expressions of TGF-β1,TGF-β1RI,CTGF,and Smad-7 in Helicobacter pylori-associated gastritis[J].Scand J Gastroenterol,2006,41(9):1007-1012.
[10] Ihn H.Pathogenesis of fibrosis:role of TGF-beta and CTGF[J].Curr Opin Rheumatol,2002,14(6):681-685.
[11] Kunzmann S,Seher A,Kramer BW,et al.Speer CP:Connective tissue growth factor does not affect transforming growth factor-beta 1-induced Smad3 phosphorylation and T lymphocyte proliferation inhibition[J].Int Arch Allergy Immunol,2008,147(2):152-160.
[12] Mori T,Kawara S,Shinozaki M,et al.Role and interaction of connective tissue growth factor with transforming growth factor-beta in persistent fibrosis:a mouse fibrosis model[J].Cell Physiol,1999,181(1):153-159.
[13] Massague J.Integration of Smad and MAPK pathways:a link and a linker revisited[J].Genes Dev,2003,17(24):2993 – 2997.
[14] Wang Jin,Xu Lijuan,Shi Ruihua,et al.Gastric atrophy and intestinal metaplasia before and after Helicobacter pylori eradication:A meta-analysis[J].Digestion,2011,83(4):253-260.
[15] Rugge M,Genta RM.Staging and grading of chronic gastritis[J].Human Pathol,2005,36(3):228-233.
[16] Shi Yun,Liu Xiaofei,Zhuang Yuan,et al.Helicobacter pylori-induced Th17 responses modulate Th1 cell responses,benefit bacterial growth,and contribute to pathology in mice[J].J Immunol,2010,184(9):5121-5129.
[17] Fujisawa T,Kamimura H,Hosaka M,et al.Functional localization of proprotein-convertase furin and its substrate TGFbeta in EGF receptor-expressing gastric chief cells[J].Growth Factors,2004,22(1):51-59.
[18] 王健,谭庆华,曾青.抑酸对胃黏膜损伤修复时CTGF、EGFR水平的影响[J].世界华人消化杂志,2010,18(27):2852-2857.
[19] Petrocca F,Visone R,Onelli MR,et al.E2F1-regulated MicroRNAs impair TGF[beta]-dependent cell-cycle arrest and apoptosis in gastric cancer[J].Cancer cell,2008,13(3):272-286.
[20] Liu Luying,Li Zhongwu,Feng Guoshuang,et al.Expression of connective tissue growth factor is in agreement with the expression of VEGF,VEGF-C,-D and associated with shorter survival in gastric cancer[J].Pathol Int 2007,57(11):712-718.
