地特胰岛素对乳腺癌MCF-7和MDA-MB-231细胞生长的影响研究
2012-04-26张晓娟王守俊
汤 喻,张晓娟,王守俊
糖尿病治疗药物人胰岛素通过激活胰岛素受体 (insulin receptor,IR)、胰岛素样生长因子 -1受体 (insulin-like growth factor-1 receptor,IGF-1R)及下游信号通路,发挥促有丝分裂作用,引发了人们对于胰岛素及其类似物与肿瘤风险的关注[1]。体外细胞实验证实人胰岛素、长效胰岛素类似物甘精胰岛素 (insulin glargine,Glargine)能够促进乳腺癌细胞增殖[2]。地特胰岛素 (insulin detemir,Detemir)是近年来临床上常用的一种长效胰岛素类似物,去除了人胰岛素B30位的氨基酸,并在B29位的赖氨酸上增加了一个肉豆蔻酸侧链。这种分子结构的变化,使它对IR、IGF-1R的亲和力较人胰岛素明显下降[3],因此促有丝分裂能力可能弱于其他胰岛素。不同类型的乳腺癌细胞中IR、IGF-1R表达高低不同,胰岛素及类似物对其生长的影响也不同。本实验通过研究地特胰岛素对雌激素受体 (estrogen receptor,ER) (+)MCF-7细胞和ER(-)MDA-MB-231细胞体外作用,比较地特胰岛素对不同类型乳腺癌细胞生长的作用及可能涉及的信号通路。
1 材料与方法
1.1 材料 人乳腺癌MCF-7和MDA-MB-231细胞株购于中科院上海生科院细胞库。MTT试剂盒、碘化丙啶 (PI)、蛋白激酶B(protein kinase B,Akt)、p-Akt(ser473)、细胞外信号调节蛋白激酶1/2(Erk1/2)、p-Erk1/2抗体均购自上海碧云天生物技术有限公司,辣根过氧化物酶 (HRP)标记山羊抗小鼠IgG购自北京鼎国公司。
1.2 方法
1.2.1 细胞培养 人乳腺癌MCF-7和MDA-MB-231细胞培养于含10%胎牛血清的1640培养基 (含双抗),37℃、5%二氧化碳 (CO2)环境中生长。取进入对数生长期细胞进行实验。
1.2.2 MTT法检测细胞增殖 细胞以3×103个/孔接种于96孔板,贴壁24 h,行以下处理:(1)1、10、100、1 000 U/L地特胰岛素作用48 h; (2)1 U/L地特胰岛素作用24、48、72、96 h,以上均设正常对照组。每孔加入10μl MTT液,培养4 h。吸弃孔内液体,每孔加入二甲基亚砜 (DMSO)100 μl,震荡摇匀10 min后,酶标仪在490 nm处测量各孔吸光度值。
1.2.3 流式细胞仪检测细胞周期 细胞以8×104个/孔接种于6孔板,贴壁48 h,10 U/L地特胰岛素作用24 h,设立正常对照组。收集细胞,磷酸盐缓冲液 (PBS)洗2次,300μl PBS重悬离心后的细胞沉淀,700μl无水乙醇逐滴加入,4℃避光过夜。PBS洗2次,PI染液染色,4℃避光30 min,流式细胞仪检测细胞周期。
1.2.4 Western blot检测 Erk1/2、Akt磷酸化程度 细胞以8×104个/孔接种于6孔板,贴壁48 h,10 U/L地特胰岛素作用24 h,设立正常对照组。提取蛋白,BCA蛋白浓度测定试剂盒测定浓度,将蛋白浓度调至4 g/L,与5×上样缓冲液混合,沸水煮10 min,冷却后25μl上样,10%SDS-PAGE电泳分离,电转至PVDF膜,封闭2 h,一抗4℃摇床孵育过夜,洗膜3次后加二抗孵育1 h。洗膜3次后DAB显色。Vision-WorkLS软件分析。
1.3 统计学方法 采用SPSS 17.0统计学软件进行统计分析,计量资料采用表示,重复测量数据采用重复测量数据的方差分析,两组数据比较采用两独立样本t检验或Mann-Whitney检验,检验水准α=0.05。
2 结果
2.1 不同浓度地特胰岛素对MCF-7和MDA-MB-231细胞生长影响 培养48 h后,地特胰岛素1、10、100、1 000 U/L均引起MCF-7和MDA-MB-231细胞数目较正常对照组有所增多,但不同浓度的增多值比较差异无统计学意义 (F值分别为1.418 和 2.568,P 值分别为 0.246 和 0.125,见图 1、2)。
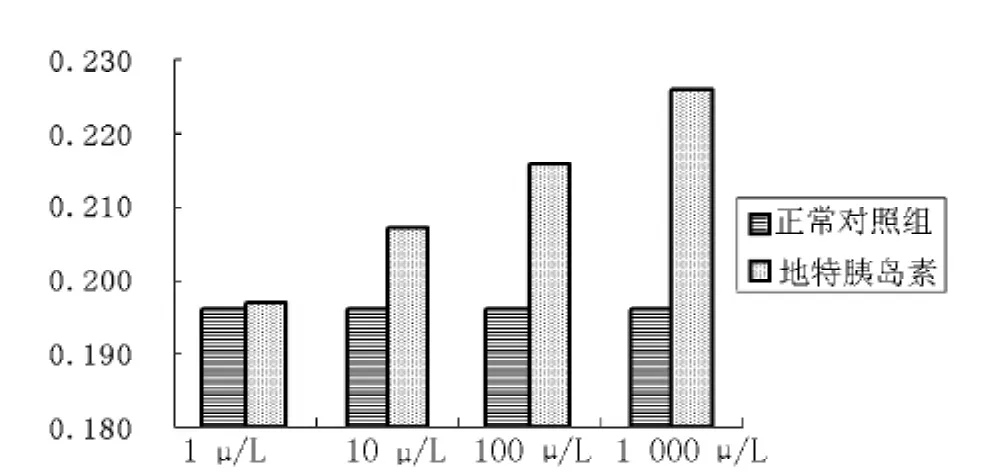
图1 不同浓度地特胰岛素对MCF-7细胞生长影响 (n=12)Figure 1 Effect of Detemir on proliferation of MCF-7 cells with different concentration
表1 地特胰岛素作用MCF-7细胞后的细胞周期结果 (,%)Table 1 Cell cycle of MCF-7 cells after treated with Detemir

表1 地特胰岛素作用MCF-7细胞后的细胞周期结果 (,%)Table 1 Cell cycle of MCF-7 cells after treated with Detemir
/M正常对照组 3 72.68 ±5.59 2.89 ±3.06 24.43 ±8.04 27.32 ±5.60组别 例数 G0/G1 G2/M S S+G2地特胰岛素组 3 65.94 ±6.67 2.27 ±2.29 31.80 ±5.07 34.07 ±6.68
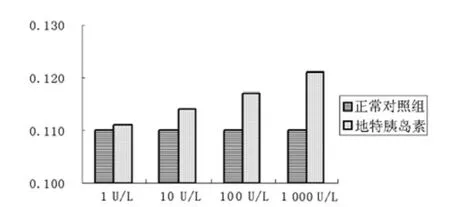
图2 不同浓度地特胰岛素对MDA-MB-231细胞生长影响 (n=12)Figure 2 Effect of Detemir on proliferation of MDA-MB-231 cells with different concentration
2.2 不同作用时间的地特胰岛素对MCF-7和MDA-MB-231细胞生长影响 1 U/L地特胰岛素作用24 h,MCF-7和MDA-MB-231细胞数目较正常对照组有所减少,1 U/L地特胰岛素作用48、72、96 h引起细胞数目较正常对照组有所增多,但不同作用时间减少或增多的差值间差异均无统计学意义(F 值分别为 0.488 和 4.585,P 值分别为 0.501 和 0.058,见图3、4)。
表2 地特胰岛素作用MDA-MB-231细胞后的细胞周期结果(,%)Table2 Cell cycle of MDA-MB-231 cells after treated with Detemir

表2 地特胰岛素作用MDA-MB-231细胞后的细胞周期结果(,%)Table2 Cell cycle of MDA-MB-231 cells after treated with Detemir
组别 例数 G0/G1 G2/M S S+G2 3 52.14 ±1.54 8.16 ±3.34 4.24 ±1.90 47.86 ±1.54地特胰岛素组 3 43.16 ±5.59 4.24 ±1.90 52.60 ±7.47 56.84 ±5.59/M正常对照组
表3 地特胰岛素作用MCF-7细胞后Erk1/2和Akt磷酸化程度比较(,%)Table 3 Phosphorylation of Erk1/2 and Akt of MCF-7 cells after treated with Detemir
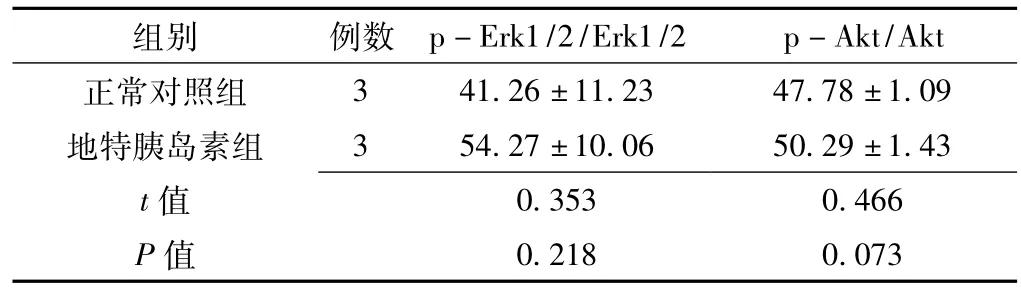
表3 地特胰岛素作用MCF-7细胞后Erk1/2和Akt磷酸化程度比较(,%)Table 3 Phosphorylation of Erk1/2 and Akt of MCF-7 cells after treated with Detemir
组别 例数3 41.26 ±11.23 47.78 ±1.09地特胰岛素组 3 54.27 ±10.06 50.29 ±1.43 t p-Erk1/2/Erk1/2 p-Akt/Akt正常对照组0.353 0.466 P值值0.218 0.073
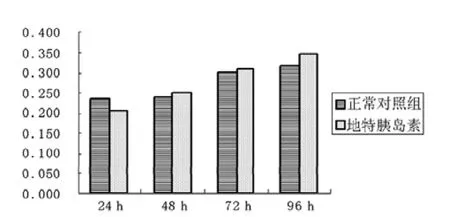
图3 不同作用时间的地特胰岛素对MCF-7细胞生长影响 (n=12)Figure 3 Effect of Detemir on proliferation of MCF-7 cells at different time
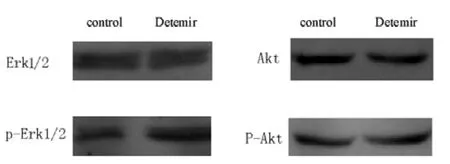
图5 地特胰岛素作用后MCF-7细胞中Erk1/2、p-Erk1/2、Akt、p-Akt的表达Figure 5 The expression of Erk1/2,p-Erk1/2,Akt,p-Akt in MCF-7 cells after treated with Detemir
图4 不同作用时间的地特胰岛素对MDA-MB-231细胞生长影响(n=12)Figure4 Effect of Detemir on proliferation of MDA -MB -231 cells at different time
2.3 细胞周期变化 10 U/L地特胰岛素作用MCF-7和MDA-MB-231细胞24 h,细胞周期变化较正常对照组差异均无统计学意义 (P值分别为0.400和0.100,见表1、2)。
2.4 Erk1/2和Akt磷酸化程度 10 U/L地特胰岛素作用MCF-7和MDA-MB-231细胞24 h,Erk1/2和Akt磷酸化程度与正常对照组比较,差异均无统计学意义 (P>0.05,见图5、6,表3、4)。
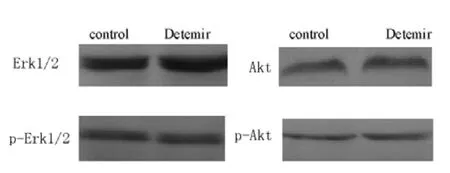
图6 地特胰岛素作用后MDA-MB-231细胞中Erk1/2、p-Erk1/2、Akt、p-Akt的表达Figure 6 Expression of Erk1/2,p-Erk1/2,Akt and p-Akt of MDAMB-231 cells after treated with Detemir
3 讨论
2型糖尿病、糖尿病治疗药物与肿瘤的关系是当今内分泌领域的热点。2型糖尿病患者肿瘤发病率增加,主要与胰岛素抵抗和高胰岛素血症有关,同时有雌激素等的参与[4]。高胰岛素使体内游离的有生物活性的 IGF-1增多[5],胰岛素、IGF-1激活IR、IGF-1R及下游信号通路,共同在肿瘤发生中发挥作用。同时一些研究显示人胰岛素[6]、甘精胰岛素[7]、二甲双胍[8]、吡格列酮[9]等糖尿病治疗药物通过调节IR、IGF-1R下游丝裂原活化蛋白激酶 (MAPK)和 (或)磷脂酞酰肌醇-3-激酶 (PI3K)/Akt信号通路影响肿瘤细胞的生长。
表4 地特胰岛素作用MDA-MB-231细胞后Erk1/2和Akt磷酸化程度比较 (,%)Table 4 Phosphorylation of Erk1/2 and Akt of MDA-MB-231 cells after treated with Detemir

表4 地特胰岛素作用MDA-MB-231细胞后Erk1/2和Akt磷酸化程度比较 (,%)Table 4 Phosphorylation of Erk1/2 and Akt of MDA-MB-231 cells after treated with Detemir
组别 例数3 53.54 ±1.60 55.65 ±1.67地特胰岛素组 3 60.77 ±6.70 58.49 ±0.88 t p-Erk1/2/Erk1/2 p-Akt/Akt正常对照组0.114 0.384 P值值0.156 0.060
人工合成的胰岛素及类似物是2型糖尿病治疗的重要方法。根据人体生理胰岛素分泌方式,将治疗糖尿病的胰岛素及类似物分为餐时胰岛素和基础胰岛素,后者又包括中效和长效两类。目前临床上使用的长效胰岛素类似物有甘精胰岛素和地特胰岛素,它们成功模拟了人体基础胰岛素的分泌,有效控制空腹血糖的同时降低了餐前和夜间低血糖的发生。地特胰岛素在分子结构上去除了人胰岛素B30位的氨基酸,并在B29位的赖氨酸上增加了一个肉豆蔻酸侧链,使得它对IR、IGF-1R的亲和力较人胰岛素、甘精胰岛素明显降低。因此推测地特胰岛素促有丝分裂的能力可能弱于其他胰岛素及类似物。最近的流行病学调查显示使用地特胰岛素者2型糖尿病肿瘤风险比使用甘精胰岛素者降低或相当[10]。
不同类型的乳腺癌细胞中IR、IGF-1R表达高低不同。IGF-1R在ER(+)的乳腺癌MCF-7细胞中表达较高,而在ER(-)的乳腺癌MDA-MB-231细胞中表达很低[11]。乳腺癌细胞中IGF-1R表达的不同,使得胰岛素对其生长的影响也不同。Mayer等[12]对不同类型乳腺癌细胞株用结晶紫方法研究细胞增殖,发现只有在IR/IGF-1R高表达的MCF7及其衍生细胞株MELN对胰岛素和IGF-1有增殖反应。
本实验中使用了乳腺癌MCF-7和MDA-MB-231细胞两种雌激素受体不同的细胞。地特胰岛素以不同浓度和作用时间作用两种细胞。地特胰岛素分别以1、10、100、1 000 U/L作用48 h,促进两种细胞增殖,但差异不明显;地特胰岛素1 U/L作用24 h,两种细胞数目减少,作用时间延长至48、72、96 h时,两种细胞数目增多,但差异不明显,无法说明地特胰岛素对两种细胞是否具有促进或抑制增殖的作用。地特胰岛素10 U/L作用24 h,流式细胞仪检测发现细胞周期变化较正常对照组无明显差异。接着对Erk1/2、Akt磷酸化程度检测,发现两种细胞中地特胰岛素组Erk1/2、Akt磷酸化程度较正常对照亦无明显差异,说明IR、IGF-1R下游的MAPK、PI3K/Akt信号通路未见表达上调。
研究证实人胰岛素、甘精胰岛素通过上调IR、IGF-1R及其下游MAPK、PI3K/Akt信号通路的表达促进肿瘤细胞增殖,地特胰岛素与IR、IGF-1R的亲和力较低,因此推测地特胰岛素促进细胞增殖的作用较弱。本实验中,通过体外实验证实地特胰岛素对MCF-7和MDA-MB-231细胞均无明显的促增殖作用,同时Erk1/2和Akt的磷酸化程度无明显升高,地特胰岛素并未引起MAPK、PI3K/Akt信号通路的高表达。本实验在一定程度上论证了地特胰岛素临床使用的安全性。但由于本实验为体外细胞实验,肿瘤细胞系长期培养在低氧条件下,其对胰岛素的依赖性与体内存在着差别。因此,需要体内实验即动物模型进行进一步的验证,今后有必要建立动物模型,进行后续动物实验。
1 Pollak M,Russell-Jones D.Insulin analogues and cancer risk:cause for concern or cause celebre? [J].Int Clin Pract,2010,64(5):628-636.
2 刘珊英,李焱,潘秋辉,等.甘精胰岛素和人胰岛素对人乳腺癌MDA-MB-231细胞的增殖作用 [J].中国药理学通报,2010,26(6):719 -722.
3 Varewijck AJ,Goudzwaard JA,Bruqts MP,et al.Insulin glargine is more potent in activating the human IGF-I receptor than human insulin and insulin detemir[J].Growth Horm IGF Res,2010,20(6):427-431.
4 Vigneri P,Frasca F,Sciacca L,et al.Diabetes and cancer [J].Endocr Relat Cancer,2009,16(4):1103 -1123.
5 Kaaks R,Lukanova A.Energy balance and cancer:the role of insulin and insulin-like growth factor-1 [J].Proc Nutr Soc,2001,60(1):91 -106.
6 Shukla A,Grisouard J,Ehemann V,et al.Analysis of signaling pathways related to cell proliferation stimulated by insulin analogs in human mammary epithelial cell lines [J].Endocr Relat Cancer,2009,16(2):429 -441.
7 Liefvendahl E,Arnqvist HJ.Mitogenic effect of the insulin analogue glargine in malignant cells in comparison with insulin and IGF-I[J].Horm Metab Res,2008,40(6):369 -374.
8 王祎波,王瑜,王烈.降糖药二甲双胍抗肿瘤的作用机制[J].医学综述,2010,16(4):610-612.
9 Blanquicett C,Roman J,Hart CM.Thiazolidinediones as anti-cancer agents[J].Cancer Ther,2008,6:25 -34.
10 Dejgaard A,Lynggaard H,Råstam J,et al.No evidence of increased risk of malignancies in patients with diabetes treated with insulin detemir:a meta-analysis[J].Diabetologia,2009,52(12):2507-2512.
11 Bartucci M,Morelli C,Mauro L,et al.Differential insuline- like growth factorⅠreceptor signaling and function in estrogen receptor(ER) -positive MCF-7 and ER -negative MDA-MB-231 breast cancer cells[J].Cancer Res,2001,61(18):6747 -6754.
12 Mayer D,Shukla A,Enzmann H.Proliferative effect of insulin analogs on mammary epithelial cells[J].Arch Physiol Biochem,2008,114(1):38 -44.
