沙柳木蠹蛾性行为的生物学特性
2012-04-25荆小院刘金龙张金桐
荆小院,刘金龙,张金桐
(山西农业大学 化学生态研究所,山西 太谷030801)
沙柳木蠹蛾(Holcocerus arenicolastaudinger)是为害沙柳(Salix psammophila)根部的一种钻蛀性害虫。该虫4年一代,以幼虫在树干木质部或根内越冬。每年5月份老熟幼虫钻出蛀道开始化蛹;6月初有部分成虫羽化,中旬达到羽化盛期。初孵幼虫于7月上旬出现,幼虫阶段是为害的主要时期,孵化后的幼虫随即钻入寄主的树干皮层内并向下蛀食,至第二年即可蛀入心材。沙柳木蠹蛾对多年生沙柳的为害尤为严重[1],可将根部完全蛀空,导致大片沙柳死亡。
本文拟对沙柳木蠹蛾的羽化、性比、寿命进行研究,并对其求偶行为和交配行为进行观察和记录,以发现该虫求偶和交配的活动规律,为进一步对沙柳木蠹蛾性信息素的提取分离、鉴定和人工合成奠定基础。在林间诱蛾试验中,测试了处女雌蛾和性腺体粗提取物对雄蛾的诱捕效果,以证实性信息素在沙柳木蠹蛾生殖过程中所起的关键媒介作用。
1 材料和方法
1.1 供试昆虫
2010年6月中旬,在陕西省榆林市巴拉素镇林场采集沙柳木蠹蛾虫茧,采集时选取受害严重的沙柳,挖取其根部附近的沙土,过筛后捡取沙柳木蠹蛾虫茧。在纸箱内装入潮湿的沙土,将沙柳木蠹蛾虫茧埋于其中,茧体距沙土表面为15cm,每箱放蛹约50头,用铁丝网覆盖纸箱上口。保持自然温度,每天用喷雾器向沙土表面喷水,以沙土表面湿透1cm为宜。试验地点在山西农业大学文理学院自建的养虫室,养虫室四壁为玻璃和窗纱,以保证良好的通风采光。试验时间为2010年6月20日~7月15日。
1.2 沙柳木蠹蛾羽化行为观察和性比调查
1.2.1 羽化行为观察
在沙柳木蠹蛾开始羽化后时,对其羽化行为进行全天候观察,记录成虫羽化的全过程;统计每小时内新羽化的成虫数目,转换成该时段的羽化百分率。

采集的虫茧在10天内分3批带回试验地点,实验分批进行。第一批羽化成虫281头,第二批羽化成虫182头,第三批羽化成虫61头。
1.2.2 性比调查
在对第1批成虫的羽化行为调查时,将羽化后的成虫按性别分开放于不同的纱笼内,统计5天内新羽化的雌虫和雄虫数量,以计算成虫的性比。
1.3 沙柳木蠹蛾寿命调查
取羽化时间相近的雌、雄成虫各20头,分别放于2个小纱笼(40cm×40cm×30cm)中,用标签注明该笼成虫的羽化时间。在纱笼底部放置一培养皿,皿底铺0.5cm厚的脱脂棉,注入5%的蔗糖溶液供成虫取食。每天观察其生命活动迹象,记录成虫从羽化到死亡的存活时间。每天清理笼中已死亡的成虫,共调查雌、雄成虫各40头。
1.4 沙柳木蠹蛾求偶行为的观察
沙柳木蠹蛾自然羽化后,立即将成虫按性别分开,避免交配。雌蛾和雄蛾分开放于两个的纱笼内(80cm×80cm×80cm),每笼放置50头成虫,观察时将放有雌蛾和雄蛾的两纱笼间相距20cm。羽化后0~24h的成虫称作1日龄(1-d-old)。在预试验中发现沙柳木蠹蛾成虫的性行为仅发生在进入暗周期后6h内,所以求偶行为的观察设在该段时间内,按照木蠹蛾科昆虫的求偶行为特征[2]每30min观察并记录该段时间的求偶雌蛾数量。每小时的两个记录值取平均值后计算该小时内成虫的求偶百分率。

试验共设3个重复,共观察雌蛾150头。观察室内安装一红色灯泡用于照明,通过调压器控制其照度为3~5lux。
1.5 沙柳木蠹蛾交配行为的观察
沙柳木蠹蛾的交配行为按以下方法研究:成虫羽化后,分别取1~4日龄的未交配成虫各20对放入纱笼内,在进入暗周期后6h内,每30min观察并记录该段时间的交配成虫数量,每小时的两个记录值取平均值后计为该小时内的交配成虫数量。对各日龄的成虫分别按下式计算其在6个时段内的交配百分率。同时,对已开始交配的成虫记录其交配持续时间,观察持续6d。

1.6 数据分析
数据分析采用PASW Statistics 18(SPSS Inc.,Chicago IL)统计软件包。实验数据经单因素方差分析,F检验,平均值用Tukey's检验法比较。
2 结果与分析
2.1 沙柳木蠹蛾羽化行为、性别比例和寿命
沙柳木蠹蛾开始羽化时,蛹体在沙土中不断蠕动,逐渐成直立状,头部向上钻出沙土表面约1~1.5cm,蛹壳下部及茧壳仍埋于沙土中。5~10 min后,蛹体顶部的蛹皮开裂,成虫缓慢爬出,爬行一段距离后停留在蛹壳附近。刚羽化的成虫,双翅柔软呈折叠装状,表面布满皱褶,前翅面积仅为正常成虫的1/3左右。静止几分钟后成虫开始抖动双翅并使双翅向上直立,约30~50min后,前后翅逐渐由皱褶状伸展,翅面积恢复正常。随后成虫有间歇飞行行为。雌蛾个体较大,腹部饱满,腹末呈钝圆形,经解剖发现雌蛾腹内含有数百枚未受精卵。由于腹部较重,雌蛾一般不进行远距离飞翔,静止时双翅呈屋脊状,覆盖于腹部,腹部末端第8~9节套缩于第7腹节内,从外部无法观察到产卵器和性腺体。
沙柳木蠹蛾羽化时间的统计见图1。从图1可以看出,沙柳木蠹蛾每日从14:00~23:00均有成虫羽化,特别是进入暗期后羽化率明显增高,其中以19:00~21:00时羽化最为集中,占羽化总数的70%~75%。
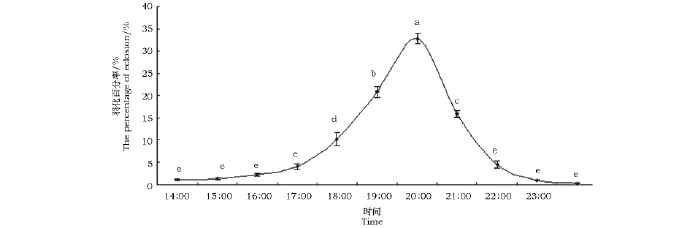
图1 沙柳木蠹蛾在自然光周期下的羽化动态节律Fig.1 The dynamic rhythm of eclosion of H.areniscolaat the natural light-dark cycle注:不同的字母表示它们之间的差异性达显著水平(n=3,p=0.05)。图3同。Note:Bars with same letter are not significantly different(n=3,p=0.05).The same as in Fig.3.
根据羽化后性别比例的统计(表1),雌雄比例为0.58~0.76∶1(雌∶雄),平均值为0.66∶1,从统计结果看雄蛾的数量高于雌蛾的数量。实验中观察到雌、雄蛾羽化不是同步进行的,羽化初期1~2天内以雄蛾羽化较多,第3天后雌蛾才大量羽化。成虫的平均寿命为4.8±2.2d,最短为1d,最长为8d。其中雌蛾寿命为5.5±2.3d,雄蛾寿命为4.1±1.9d。此外,由于沙柳木蠹蛾成虫的口器退化,在实验中未观察到成虫有取食现象。
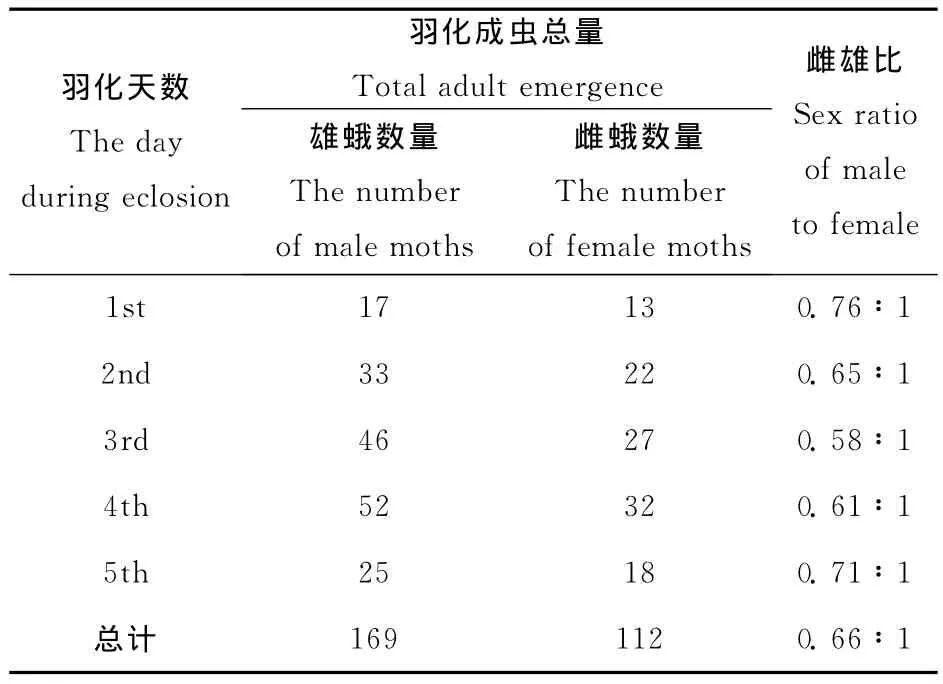
表1 沙柳木蠹蛾性比统计Table 1 Sex ratio of H.arenicola
2.2 沙柳木蠹蛾的求偶行为节律
沙柳木蠹蛾求偶时将腹部末端外伸,使其腹部8~10节突出,8~9节节间膜外露。不同蛾龄的雌虫在光周期内的求偶模式见图2。求偶行为开始于暗周期的0.5~1h,结束于暗周期的4~5h。大多数在20:00以前羽化的雌蛾当晚即可开始求偶行为,部分羽化较晚的雌蛾在第二个暗期才有召唤行为。1日龄雌虫在进入暗期后的1h内求偶百分率较低,求偶行为大都发生在此后的2~3h之间;而2~5日龄雌蛾在进入暗期后的1h内就具有较高的求偶百分率,远远超过该时段内1日龄雌虫的求偶百分率,这可能是因为蛾龄越大,达到性成熟的雌虫越多。求偶后如未获得交配,雌蛾能在此后的第2~5个暗周期内连续求偶。最大求偶百分率出现在羽化后的第二、三个暗周期,随着蛾龄的增大求偶百分率呈下降趋势,4~5日龄雌虫的求偶百分率明显低于2~3日龄(图3)。此外,在雌蛾求偶期间,位于附近的雄蛾异常兴奋,表现为频繁地飞行、极速爬行等行为。
2.3 沙柳木蠹蛾的交配行为节律
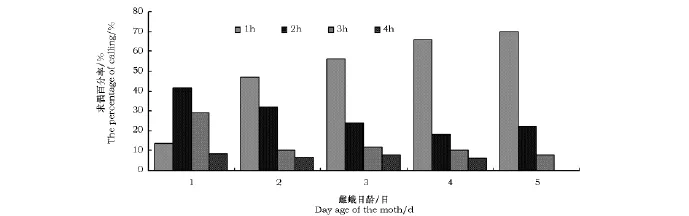
图2 不同日龄雌蛾在暗期各时间内的求偶百分率Fig.2 The calling percentage of Holcocerus arenicolafemales at different ages and times

图3 沙柳木蠹蛾雌虫在不同蛾龄下的求偶百分率Fig.3 The percentage(mean±SE)of Holcocerus areniscola calling females at different ages
沙柳木蠹蛾交配时,雄虫利用第9节腹末内的抱握器握住雌虫生殖器后,将身体反转,使雌、雄虫呈头部方向相反仅尾部相连的“一”字形。交配行为一般发生在纱笼四壁的上半部分或顶盖下方,1日龄成虫在进入暗周期后交配百分率逐渐提高,在两小时达到交配高峰,交配百分率为13.75±2.39%,随着时间延续交配百分率呈下降趋势;而2~4日龄成虫的交配高峰出现在进入暗期后的1小时内,其交配百分率分别为23.75±2.39%,11.25±2.39%,6.25±1.25%,明显高于暗期其它时段(图4)。统计结果表明,不同日龄的雌虫,其交配百分率明显不同。最大交配百分率出现在羽化后的第二个暗周期,此后成虫的交配能力随着蛾龄的增大而迅速降低,甚至5~6日龄雌蛾的交配行为几乎观察不到。这一结论与求偶行为随蛾龄的变化趋势相一致。此外,由于人为将正在交配的成虫移至单独的纱笼用于观察,干扰了成虫的正常交配,导致交配持续的时间差别较大,平均值为38.41±11.42min,最短为25min,最长为84min。
3 讨论
沙柳木蠹蛾羽化当晚即达性成熟,可进行求偶、交配等性行为。影响沙柳木蠹蛾性行为的因素很多,其中蛾龄和暗期时间为两个主要因素,直接决定了性信息素的生物合成量和释放时段。随着蛾龄的增大,雌虫在各暗周期中求偶和交配行为发生的时间明显提前。相似的结论也出现在其它鳞翅目昆虫的性行为模式中[3~6],这种行为可以用一种假说[7,8]解释,即鳞翅目昆虫随着日龄增大性行为时间前移是一种适应机制,目的是让日龄较大的雌蛾有更多的机会吸引配偶,从时间上避免与新羽化的雌蛾竞争交配对象。
通过在防治区设置适当数量的性信息素诱捕器,对性成熟的雄虫尽可能及时诱杀,使雌虫失去交配的机会,不能有效地繁殖后代[9],从而降低子代虫口密度,减轻该虫对寄主的为害。从求偶和交配的调查结果看,沙柳木蠹蛾的性活动主要集中在羽化后连续3个暗周期的前半段(20:00~24:00)。在这一特定的时段内,用性信息素集中对成虫的交配进行化学干扰或者直接诱杀雄虫,对于提高防治效果可起到事半功倍的作用,同时亦可减少性信息素的用量,降低防治成本。

图4 沙柳木蠹蛾在各日龄和各时段的交配百分率(n=3,p=0.05)Fig.4 The percentage(mean± SE)of mating behavior of Holcocerus areniscolain different ages and times(n=3,p=0.05)
在对沙柳木蠹蛾求偶行为的研究过程中发现,在遇到阴雨天或大风降温时,几乎未观察到雌蛾的求偶行为。Appel和Rust[10]曾报道过相似的情况,即低温影响美洲大蠊(Periplaneta americana)性信息素的产生、释放和接收。另外还发现,进入暗期后在无风的情况下,雌蛾求偶百分率较低,交尾率也随之降低,人工提供风力后,雌蛾求偶率趋向提高,而在风力为2~3级(风速0.3~3.3m·s-1)时,求偶行为百分率显著提高,这可能是由于雌蛾要借助风力更好地传播性信息素,以顺利实现交尾,完成繁殖。风力大于5级(8.0~10.7m·s-1)时,成虫飞行困难,未见交尾现象。除了温度和风力外,许多生物或非生物因素,如寄主植物、光周期、光密度以及相对湿度等均会对昆虫的性信息素通讯造成影响[11]。
[1]胡忠朗,陈孝达,杨鹏辉,等.沙柳木蠹蛾的研究[J].昆虫学报,1987,30(3):259-264.
[2]张金桐,孟宪佐.小木蠢蛾性行为和性信息素产生与释放的时辰节律[J].昆虫学报,2001,44(4):428-432.
[3]Howlader M A,Gerber G H.Effects of age,egg development,and mating on calling behavior of the bertha armyworm,Mamestra configurata Walker(Lepidoptera:Noctuidae)[J].Can Entomol,1986,118:1221-1230.
[4]Kou R C,Chow Y S.Calling behavior of the cotton bollworm,Heliothis armigera(Lepidoptera:Noctuidae)[J].Ann Entomol Soc Am,1987,80:490-493.
[5]Delisle J,Royer L.Changes in pheromone titer of oblique-banded leafroller,Choristoneura rosaceana,virgin females as a function of time of day,age,and temperature[J].J Chem Ecol,1994,20:45-69.
[6]Edmonds R P,Borden J H,Angerelli N P D,et al.A comparison of the developmental and reproductive biology of two soybean pod borers,Etiella spp.in Indonesia[J].Entomol Exp Appl,2000,97:137-147.
[7]Delisle J.Effect of male and female age on the mating success of the obliquebanded leafroller Choristoneura rosaceana(Lepidoptera:Tortricidae)under different ecological conditions[J].J Insect Behav,1995,8:781-799.
[8]Mazor M,Dunkelblum E.Circadian rhythms of sexual behavior and pheromone titers of two closely related moth species Autographa gamma and Cornutiplusia circumflexa[J].J Chem Ecol,2005,31(9)::2153-168.
[9]苏茂文,张钟宁.昆虫信息化学物质的应用进展[J].昆虫知识,2007,44(4):477-485.
[10]Appel A G,Rust M K.Temperature-mediated sex pheromone production and response of the American cockroach[J].J Insect Physiol,1983,29:301-305.
[11]McNeil J N.Behavioral ecology of pheromone-mediated communication in moths and its importance in the use of pheromone traps[J].
Annu Rev Entomol,1991,36:407-430.
