大麦(Hordeum vulgare)昼夜节律钟基因CCA1的克隆及表达分析
2012-04-25邢国芳宋萌姚涵韩渊怀
邢国芳,宋萌,姚涵,韩渊怀
(1.山西农业大学 农学院,山西 太谷030801;2.山西农业大学 生物工程研究所,山西 太谷030801;3.山西运城农业职业技术学院,山西 运城044000)
在高等植物的生物周期中,开花是一个重要环节,植物从营养生长转向生殖生长的必然结果就是开花,而某些植物必须经过一定的光周期才能形成花芽。光周期是指昼夜周期中光照期和暗期长短的交替变化,是生物对昼夜光暗循环格局的反应,对昼夜以及四季的变化的判断,是一种植物內源的调节机制。昼夜节律钟是植物体内的昼夜生理节奏变化,以近似一天(24h)为一个单位[1],在拟南芥中CCA1基因编码一个MYB类结合蛋白,是光周期振荡器的核心组分,CCA1突变体昼夜节律钟的振幅变短[2]。邢国芳等[3]在禾本科植物玉米中发现CCA1基因对光周期变化敏感并有可能参与植物对光周期的反应调控。大麦是一种禾本科植物,且当前对其的光周期敏感性研究相对较少。因此,本研究拟利用BLAST手段通过同源克隆的手段电子克隆得到大麦CCA1的序列信息,结合RTPCR手段,克隆大麦CCA1基因,并与玉米、水稻、拟南芥的同源基因进行遗传进化分析,另外对其在两个大麦品种(华大麦1号和华大麦2号)叶片中的24h昼夜节律(16h光照/8h黑暗)过程中不同时间点的表达规律进行了研究,初步探明该基因对大麦光周期的响应规律,旨在为阐明大麦光周期敏感现象的分子机制提供科学依据。
1 材料与方法
1.1 供试材料及处理
大麦品种华大麦1号和华大麦2号,具体操作参考前期在玉米中的研究方法[3]:种子浸泡发芽后盆栽,于光照培养箱中培养8天后(25℃光照16h/22℃黑暗8h)取地上部叶片,从ZT0(光照0小时)开始至ZT24(一个光暗循环),期间每隔3h取样,共计9个时间点的样品,每个样品取5株材料,于液氮中速冻后置于-80℃超低温冰箱中保存备用。
1.2 总RNA的提取和反转录
按照Trizol Reagent(Invitrogen公司)试剂盒的说明书进行。提取总RNA后用DNaseI酶纯化RNA以消除DNA污染。采用NANODROP微量核酸定量分析仪测定RNA的浓度以及吸光度比值(A260/280),并采用1%的琼脂糖凝胶电泳,检测样品质量,最后加入适量的ddH2O使其溶解到终浓度1g·L-1。采用Invitrogen公司的反转录酶(M-MLV)进行逆转录,获得cDNA。逆转录体系以及程序按照其说明书进行:反应总体积20μL,其中,包含总RNA 2μg,Random Primer 1μg,5×反转录缓冲液5μL,10mM dNTP混合物5μL,M-MLV反转录酶200U,RNA酶抑制子0.5μL。
利用内标基因Actin检测cDNA质量,Actin引物S1:5'-CAC TGC AAT GGT CAA GGC TG-3',S2:5'-CTC CAT GTC ATC CAG TTG AT-3'。PCR循环数30个。
1.3 生物信息分析
利用文献中报道的CCA1基因同源序列作为靶序列。利用电子克隆手段获得大麦的CCA1基因序列,(http://blast.ncbi.nlm.nih.gov/Blast.cgi)结合RT-PCR手段克隆测序得到大麦CCA1基因序列,并与其同源序列进行遗传进化分析,另外对其编码蛋白的氨基酸序列进行结构域分析。利用MEGA4.1软件构建进化树。蛋白结构域分析通过在 线 进 行 (http://plantsp.genomics.purdue.edu/html/feature_scan.html)。
1.4 大麦CCA1基因的克隆
根据电子克隆到的大麦CCA1基因序列,设计包含全长ORF序列的基因特异引物F1:5'-CCT GGA ATT GGA GAT GGA GA-3',F2:5'-AAG GAA CCG TTT GTG CTC TG-3',以ZT6的cDNA为模板PCR扩增30个循环,电泳并通过琼脂糖凝胶回收试剂盒回收产物,采用T4连接酶与PGEM-T载体16℃连接过夜,热激转入大肠杆菌DH5а,蓝白斑筛选并结合PCR获得阳性克隆,送往华大基因公司测序,得到大麦CCA1基因的全长cDNA序列。分析其编码蛋白的氨基酸序列,在线(http://isoelectric.ovh.org/files/calculate.php)预测其分子量和等电点,采用DNAMAN软件与其他物种的同源序列进行比对。
1.5 荧光实时定量PCR分析
1.5.1 引物设计和标准曲线的建立[4]
BLASTn分析,获得大麦CCA1基因的3'非翻译区,并在此区间设计特异的表达检测引物,Q1:5'-ACT TAG ACG CAT CGA ATC AT-3',Q2:5'-TAT GCA TCC TGC GAT AGC AC-3',覆盖序列135bp。以其扩增产物转化大肠杆菌的质粒作为CCA1和Actin基因的标准品。按照10倍的浓度梯度进行稀释,设计5个浓度梯度,分别作为荧光定量PCR的模板,对CCA1基因和Actin的相对表达丰度进行定量检测,每个浓度梯度进行2次重复实验。根据扩增的CT值及浓度梯度建立标准的定量曲线。
1.5.2 荧光定量PCR及数据分析
实时荧光定量PCR选用Bio-Rad C1000cycler Real Time PCR system进行分析,反应体系10μL,包含1μL的反转录反应液,0.2μM的引物和5μL的SYBR Premix Ex Taq(DRR041D)每个反应设3次重复,PCR程序如下:94℃变性5 min;35个循环的反应为94℃变性10s,60℃ 退火20s,72℃延伸30s;最后72℃延伸7min;65~98℃绘制溶解曲线。然后采用比较阈值法对实时定量结果进行定量分析,手工设置荧光域值,确定在该荧光域值下特定的循环数Ct值,根据Ct值,计算各样品的C值,C=2-ΔCT,ΔCt=Ct目标基因-Ct内标基因。采用双尾等方差t测验的方法进行显著性检验(p<0.05)。
2 结果与分析
2.1 cDNA样品制备
电泳检测发现所有样品RNA的28S与18S条带清晰,吸光度比值 A260/280均在1.8~2.1之间,表明RNA质量完好,纯度很高。采用S1和S2引物在所有样品中扩增均得到135bp的产物,说明cDNA第一链反转录成功。
2.2 CCA1基因的克隆和分析
以ZT6的cDNA材料为模板,利用引物F1和F2进行扩增、克隆并回收测序,采用ORF Finder软件分析,发现其序列中2157bp的开放阅读框编码蛋白质含有718个氨基酸残基(图1),在线预测到其编码蛋白分子量为77 769.4Da,等电点为6.55。经BLAST分析,发现该基因片段与水稻序列(AY452478)相似性可达72%,与玉米CCA1序列(EU955544.1)相似性达69%(图2)。

图1 BaCCA1编码蛋白分析Fig.1 The amino acids sequences of BaCCA1

图2 不同物种CCA1基因氨基酸序列分析Fig.2 Multiple alignment of the CCA1conserved domain of Hordeum vulgare(barley)with those of Oryza sativa(rice),Zea mays(maize)and Arabidopsis thalianain amino acids sequences
分析发现,该基因的SANT蛋白结合域相似性很高,其与单子叶植物水稻(AAR20887)和玉米(BAJ92173.1)以 及 双 子 叶 植 物 拟 南 芥 (NP_850460.1)的序列高度保守,相似度分别达到94.33%、95.26%和78.44%(图2)。因此根据氨基酸序列上的相似性,利用 MEGA4.0软件绘制了CCA1蛋白的遗传进化树。发现单子叶植物玉米、水稻和大麦聚在同一个类群(图3),说明在该基因在进化上应始于单双子叶植物分化之后。
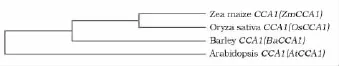
图3 大麦、水稻、玉米以及拟南芥CCA1蛋白进化分析Fig.3 The Phylogenetic tree of the CCA1protein
2.3 BaCCA1基因表达分析
为了检测PCR引物扩增目的基因的特异性,我们对Actin基因的标准质粒进行测序发现其与目的基因没有出现SNP的差异。用引物S1与S2对标准品质粒进行PCR扩增,均得到了大小相同的片段。对标准品进行定量得到BaCCA1基因的标准 曲 线 Y= -0.283X+9.045,相 关 系 数0.9939。Actin基因的标准曲线为Y=-0.284X+8.988,相关系数为0.9982。两条标准曲线的斜率相差非常小,相关系数均接近1,荧光定量的溶解曲线为单峰,表明扩增产物的特异性很好,目的产物的扩增可以用荧光曲线来准确地反眏。
对不同的时间点的表达数据采用方差分析发现,不同时间点及处理情况下的表达量差异均达到显著水平。表1及图4显示,在16h光照/8h黑暗条件下,CCA1基因从开始光照时表达量达到最高峰,之后逐渐下降到最低水平,然后迅速上升到ZT24时恢复到与ZT0相同的水平,完成一个循环周期;在华大麦1号和2号品种间表达曲线是相似的,但华大麦2号的曲线要比华大麦1号的曲线缓,其下调及上调的比例均小于华大麦1号。

表1 BaCCA1在两种大麦品种间的相对表达量Table 1 The relative expression of BaCCA1between two different varieties
3 讨论
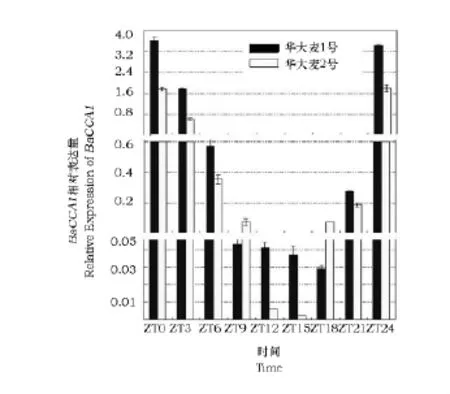
图4 BaCCA1基因在华大麦1号和华大麦2号中的表达Fig.4 The relative expression of BaCCA1between two different varieties
植物体内存在一种以24h为周期的内源调节机制,能够影响植物体内的一系列生理进程包括基因的表达、代谢调控以及生殖过程等[5]。植物通过感知光周期的变化,来判断昼夜以及四季的变化。最近在拟南芥中发现这一过程的实现是通过一些基因的在白天与黑夜间的震荡性的表达来实现的[6,7],其中主要是通过形成一个转录-翻译水平的反馈抑制环[6],包含一个清晨表达的MYB转录因子-CCA1以及其负调控的下游基因TOC1。
大麦CCA1基因,具有2157bp的完整读码框,编码一条718个氨基酸残基的肽链,含有一个保守的MYB蛋白结合域,该结构域在拟南芥、水稻、玉米、大麦中都存在,并且相似性高达93.22%,说明该基因在单子叶植物和双子叶植物之间及其保守。
CCA1基因在光照刚开始时mRNA转录产物开始积累,到光照3小时达到峰值,之后又慢慢开始下调表达这与拟南芥、和玉米中的研究结果相似[3,8]。说明我们克隆的大麦CCA1基因与拟南芥中的CCA1基因在光周期途径中发挥的功能是相似的。
植物的生命活动是一个复杂而有序的过程,植物本身能够识别外界季节和昼夜节律的变化,进而做出相应的利于植物开花和发育等的反应,如从营养生长转变为适于开花的节奏程序,秋季日照逐渐缩短时,从旺盛的生长转向休眠等。昼夜节律的改变将会影响光周期相关基因的表达,从而有效的维持植物体的生命活动。植物体对温度具有敏感性,通过实验证明,内源节奏的周期长度对温度相对不敏感,暗示它不是以化学变化为基础的,但内源节奏的振幅可能与温度的变化有关。这主要是因为植物多种生化反应受到温度影响,这对植物的正常生长是有利的。当植物体处于最适温度时,正常生长,代谢旺盛,而当温度变化异常时,进行内部调节,避免伤害。当然,植物体内的生物钟系统对环境温度波动过于敏感的话,也会对植物体产生不利的影响,植物体会因对温度过度敏感受到严重的干扰而造成生命活动的紊乱[9]。
到目前为止,虽然大麦光周期敏感性的遗传特点及分子机制研究方面已经取得了一些进展,但与拟南芥和水稻相比仍然相距甚远,尤其在光周期敏感性的分子机理方面的研究知之甚少,主要是因为目前克隆到的与大麦开花有关的基因相对较少,目前对大麦光受体的功能报道也很少,生物节律钟基因的功能鉴定几乎是空白。但是,高等植物开花的光周期途径关键基因的保守性和单子叶作物的共线性关系能够帮助我们为大麦光周期敏感基因的克隆提供一定的依据[10,11],特别是高通量测序技术的发展,以及相关物种基因组序列的公布,为解析大麦光周期遗传机理提供了便利。解析大麦光周期敏感机制将对大麦的生产起到一定的指导意义。
[1]Covingtone MF,Maloof JN,Straume M,et al.Global transcriptome analysis reveals circadian regulation of key pathways in plant growth and development[J].Genome Biol,2008,9:R13.
[2]Alabadi D,Yanovsky M,Mas P,et al.Critical role for CCA1and LHY in maintaining circadian rhythmicity in Arabidopsis[J].Curr Biol,2002,12(9):757-761.
[3]邢国芳,杜伟健,张雁明,等.玉米昼夜节律钟基因CCA1的克隆及表达分析[J].山西农业大学学报:自然科学版,2011,31(4):332-337.
[4]李思远,陈晓,王新涛,等.玉米光周期敏感类 Hd6基因的克隆和实时定量表达分析[J].作物学报,2008,34(4):713-717.
[5]Wang Z,Tobing E.Constitutive expression of the CIRCADIAN CLOCK ASSOCIATED1(CCA1)gene disrupts circadian rhythms and suppresses its own expression[J].Cell,1998,93:1207-1217.
[6]Alabadi D,Oyama T,Yanovsky M,et al.Reciprocal regulation between TOC1and LHY/CCA1within the Arabidopsis circadian clock[J].Science,2001,293(5531):880-883.
[7]Ito S,Nakamichi N,Nakamura Y,et al.Genetic linkages between circadian clock-associated components and phytochrome-dependent red light signal transduction in Arabidopsis thaliana[J].Plant Cell Physiol,2007,48(7):971-983.
[8]Ni ZF,Kim ED,Ha M,et al.Altered circadian rhythms regulate growth vigor in hybrids and allopolyploids[J].Nature,2009,457:327-331.
[9]Dixon LE,Knox K,Kozma-Bognar L,et al.Temporal repression of core circadian genes is mediated through EARLY FLOWERING 3in Arabidopsis[J].Curr Biol,2011,21(2):120-125.
[10]Izawa T,Oikawa T,Sugiyama N,et al.Phytochrome mediates the extemal light signal to repress FT orthologs in photoperiodic flowering of rice[J].Genes Dev,2002,16:2006-2020.
[11]Izawa T,Tokutomi S,Yano M.Comparative biology comes into bloom:genomic comparison of flowering pathway in rice and Arabidopsis[J].Curr Opin Plant Biol,2003,6:113-120.
