椎旁肌力量失衡与双足鼠脊柱侧凸模型的建立
2012-04-16沈晓龙周许辉
沈晓龙,周许辉,刘 洋,田 野,东 人,袁 文
建立理想的脊柱侧凸动物模型是探索其发病机制、治疗方法的重要步骤,同时为特发性脊柱侧凸的深入研究提供参考。A型肉毒毒素(botulinum toxin A,BTX-A)能阻碍突触前膜乙酰胆碱的释放,使神经肌肉接头传导受阻,从而导致肌肉松弛,甚至瘫痪[1]。本研究组前期研究发现BTX-A注射至双足鼠一侧椎旁肌,致椎旁肌力量失衡,可成功建立脊柱侧凸模型。然而,BTX-A肌肉注射作用维持时间有限,一般注射后2~5 d起效,4周后肌肉可发生短暂颤动,13周后神经肌肉接头功能基本恢复,肌肉可正常收缩[2]。随着BTX-A的作用消失,双足鼠脊柱侧凸角度该如何变化,追加注射侧凸状态是否能够复现,本研究将就这些问题做进一步探讨。
1 材料和方法
1.1 双足鼠模型制备
30只4周龄雌性 SD大鼠(SPF级),体重(94.8±5.4)g,由第二军医大学动物中心提供。采用10%水合氯醛,按照3 mL/kg的剂量对大鼠行腹腔注射麻醉。取双侧上肢环形切口,分离肌肉筋膜,结扎大血管,肩关节处截除上肢,止血后缝扎切口。所有大鼠术后即刻行高笼喂养,将饲料槽及饮水瓶悬高,根据大鼠身长情况,动态调整悬吊高度(见图1)。双足鼠模型建立1周后注射BTX-A。
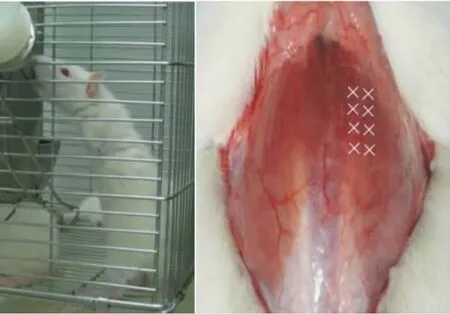
图1 双足鼠站立取水 图2 右侧椎旁肌注射BTX-A,“×”为注射点Fig.1 Rats were able to stand immediately after the amputations of forelimbs Fig.2 BTX-A was injected at the 8 sites pointed by“ × ”within paraspinal muscle(5 mm apart)
1.2 模型分组
大鼠随机分为3组,每组10只。BTX-A(兰州生物制品研究所生产),白色干粉,每支100U,注射前临时配制。腹腔注射麻醉下,于胸腰段后凸顶点向下切开皮肤1 cm,向上切开皮肤2 cm,分离筋膜,充分显露右侧椎旁肌,于大鼠胸椎后凸顶点上下各1 cm处多点注射(见图2),A、B组双足鼠胸椎右侧肌肉多点注射 6.25 U/100 g的 BTX-A,0.5 mL;C组双足鼠右侧椎旁肌多点注射0.9%的生理盐0.5 mL。注射完毕缝扎切口,普通笼喂养,3 d后转入高笼喂养。B组双足鼠于首次注射6周后追加注射6.25 U/100 g的BTX-A 1次A组及C组注射等量生理盐水。注射完毕缝扎切口,普通笼喂养,3 d后转入高笼喂养。
1.3 X 线检查
首次BTX-A注射2周、4周、6周、8周、12周后分别行X线检查。腹腔麻醉下将大鼠放置特制盒内,保持大鼠正中直立状态,避免骨盆及双肩倾斜,拍摄正侧位X线片。
1.4 统计分析
相关数据输入 SPSS 16.0软件(SPSS Inc.,美国),计量资料用(±s)表示,采用一般线性模型实现重复测量资料的方差分析,用Multivariate实现组间两两比较,P<0.05表示差异有统计学意义。
2 结 果
2.1 双足鼠模型
大鼠双侧上肢截除手术时间为(12.3±1.6)min。大鼠麻醉完全苏醒后可双足行走、站立。双足鼠模型建立1周后体重为(97.8±6.6)g。
2.2 X线检查结果
注射BTX-A 2周、4周、6周、8周、12周后分别行X线检查,X线片提示双足鼠出现脊柱侧凸,且凸向注射侧(见图3),C组未发现明显脊柱侧凸,各组侧凸Cobb角测量结果见表1。

图3 注射BTX-A后X线检查结果(右侧为注射侧)Fig.3 X-ray results of spine curveafter injection of BTX-A(The right were injection sites)

表1 双足鼠脊柱侧凸角度变化Tab.1 Mean Cobb’s angles at different times
重复测量数据满足 Huynh-Feldt条件(P=0.556),接受“球形假设”。方差分析提示A、B组与C组测量结果差异有统计学意义(F=473.996,P<0.05),且不同时间的侧凸角度差异有统计学意义(multivariate tests,F=51.968,P<0.05),组间与组内因素存在交互作用(F=38.453,P<0.05)。
各时间点两两比较用多元方差分析,P<0.05为差异有统计学意义。A、B组在注射后2周、4周、6周侧凸角度差异无统计学意义(P>0.05);8周及12周时A组侧凸角度与B组差异有统计学意义(P<0.05);A组12周后侧凸角度与C组相比差异无统计学意义(P>0.05,见表2)。

表2 各时间点X线检查结果组间比较的P值Tab.2 Comparison(P value)of mean Cobb’s angles among groups
B组大鼠的侧凸角度趋势分析提示首次注射后随时间的推移,侧凸角度逐渐下降;追加注射,侧凸角度可增大;随后角度再次逐渐减小(见图4)。

图4 不同时间点各组大鼠侧凸角度的趋势分析Fig.4 Trend analysis of mean Cobb’s angles at different time points among groups
3 讨 论
3.1 大鼠侧凸模型的建立
大鼠脊柱侧凸模型的研究一直是学者们关注的热点。Sarwark等[3]报道利用丝线栓系大鼠肩胛骨下角及同侧骨盆制造侧凸模型,研究发现至少栓系6周才能出现结构性脊柱侧凸。Joe[4]最先通过电刺激大鼠一侧椎旁肌的方法建立脊柱侧凸模型,研究发现凸侧位于非刺激侧,侧凸角度随着时间的累积而不断加大,3周时侧凸角度平均为18.6°,停止电刺激后侧凸角度没有明显丢失。日本学者Machida等[5-6]通过截除双上肢建立直立的双足鼠模型,发现松果体切除(阻断褪黑素分泌)的双足鼠出现脊柱侧凸,而松果体切除的四足鼠和保留松果体的双足鼠并未发生脊柱侧凸。这与Oyama等[7]的实验结果类似,其认为褪黑素缺乏及直立姿势是鼠类模型脊柱侧凸发生、发展的重要条件。Smith等[8]报道通过栓系兔T4~10的一侧椎板,制造出缓慢进展的结构性侧凸动物模型。此后,通过栓系等纯机械外力的造模方式不断被研究者采用。Newton等[9]报道了经右侧胸腔入路钢丝栓系小牛的T6,7或T7,8椎体前外侧,12周后发现小牛出现12°的胸椎侧凸。Braun等[10-11]通过对山羊 T5~L1脊柱左后方栓系联合左侧肋骨捆绑及右侧肋骨切除建立动物模型,由于此模型有椎体及椎间盘楔形变、椎体旋转及侧凸进展等表现,能很好的模拟特发性脊柱侧凸的特点,此方法建模为今后研究特发性脊柱侧凸提供了实验基础。国内不少学者通过栓系双足鼠肋骨或肩胛骨与髂骨建立脊柱侧凸模型[12-14]。
目前文献报道的造模方法存在明显不足,如模型动物与人类种属差异太大、不能模拟人类直立姿势、模型椎体无明显旋转、通过栓系等外力牵拉作用限制了脊柱的活动范围、模型侧凸范围过大等[15]。
本研究组通过对双足鼠一侧椎旁肌注射BTX-A建立脊柱侧凸模型,该模型具有以下优点:①双足鼠模拟人类直立姿势;②大鼠局部脊柱椎旁肌注射不累及整个脊柱;③大鼠脊柱活动性完好,脊柱各方向活动不受外力影响;④侧凸伴有椎体旋转;⑤相对于栓系等方法创伤更小。
3.2 BTX-A 特性
BTX-A通过阻断胆碱能神经末端的钙离子通道,进而阻止突触前膜乙酰胆碱的释放,阻断神经冲动的传递,起到了化学去神经作用,最终造成肌肉无法收缩,出现局部肌肉麻痹无力[16]。目前已上市的医用 BTX-A有 Botox(Allergan,美国)、Dysport(Ipsen、Medicis,法国、美国)及衡力(兰州生物制品研究,中国)。Botox注射后一般2~5 d起效,2周左右注射区域出现轴突出芽现象,4周后可传递神经冲动,肌肉仅可发生短暂颤动,9周后轴突停止出芽,13周后神经肌肉接头功能基本恢复,肌肉可正常收缩[2]。
本实验组发现BTX-A椎旁肌注射2周时侧凸最严重,随后侧凸角度逐渐减轻,至注射后12周侧凸基本完全消失,侧凸角度随时间推移呈线性关系减小。追加注射BTX-A侧凸可加重,提示BTX-A注射导致大鼠椎旁肌力量失衡进而导致的脊柱侧凸是非结构性的,当BTX-A作用消失,双足鼠两侧椎旁肌力量逐渐平衡,侧凸将逐渐减小直至消失,追加注射BTX-A后椎旁肌力量再次失衡,脊柱侧凸明显加重。该实验有力地证明了椎旁肌力量失衡可导致脊柱侧凸的发生。
研究椎旁肌力量与脊柱侧凸的关系,可能为脊柱侧凸患者,特别是特发性脊柱侧凸患者的病因学研究及治疗提供参考。本实验尚存在一些不足之处,如观察时间间隔较大,未能明确BTX-A注射后侧凸角度精确的变化趋势;如反复追加注射BTX-A,大鼠侧凸能否继续维持,是否能转变为结构性侧凸。本实验仅是课题研究的一部分,上述问题与注射BTX-A后椎旁肌的显微结构变化、相关蛋白表达分析将在今后的实验做进一步研究。
双足鼠椎旁肌力量失衡可导致脊柱侧凸的发生。一侧椎旁肌注射BTX-A,双足鼠可出现脊柱侧凸,随时间推移侧凸逐渐减轻,追加注射BTX-A侧凸可加重。
[1] Jankovic J.Botulinum toxin in clinical practice[J].J Neurol Neurosurg Psychiatry,2004,75(7):951-957.
[2] Dolly JO,Aoki KR.The structure and mode of action of different botulinum toxins[J].Eur J Neurol,2006,13(Suppl 4):1-9.
[3] Sarwark JF,Dabney KW,Salzman SK,et al.Experimental scoliosis in the rat.I.Methodology,anatomic features and neurologic characterization[J].Spine(Phila Pa 1976),1988,13(5):466-471.
[4] Joe T.Studies of experimental scoliosis produced by electrical stimulation.With special reference to the histochemical properties of the muscle[J].Nihon Ika Daigaku Zasshi,1990,57(5):416-426.
[5] Machida M,Murai I,Miyashita Y,et al.Pathogenesis of idiopathic scoliosis.Experimental study in rats[J].Spine(Phila Pa 1976),1999,24(19):1985-1989.
[6] Machida M,Saito M,Dubousset J,et al.Pathological mechanism of idiopathic scoliosis:experimental scoliosis in pinealectomized rats[J].Eur Spine J,2005,14(9):843-848.
[7] Oyama J,Murai I,Kanazawa K,et al.Bipedal ambulation induces experimental scoliosis in C57BL/6J mice with reduced plasma and pineal melatonin levels[J].J Pineal Res,2006,40(3):219-224.
[8] Smith RM,Dickson RA.Experimental structural scoliosis[J].J Bone Joint Surg Br,1987,69(4):576-581.
[9] Newton PO,Fricka KB,Lee SS,et al.Asymmetrical flexible tethering of spine growth in an immature bovine model[J].Spine(Phila Pa 1976),2002,27(7):689-693.
[10] Braun JT,Ogilvie JW,Akyuz E,et al.Experimental scoliosis in an immature goat model:a method that creates idiopathic-type deformity with minimal violation of the spinal elements along the curve[J].Spine(Phila Pa 1976),2003,28(19):2198-2203.
[11] Braun JT,Hines JL,Akyuz E,et al.Relative versus absolute modulation of growth in the fusionless treatment of experimental scoliosis[J].Spine(Phila Pa 1976),2006,31(16):1776-1782.
[12] 刘立峰,朱悦,韩秀鑫,等.双足鼠对侧拴系脊柱侧凸模型的建立[J].中华骨科杂志,2010,30(10):985-990.
[13] Liu L,Zhu Y,Han X,et al.The creation of scoliosis by scapula-to-contralateral ilium tethering procedure in bipedal rats:a kyphoscoliosis model[J].Spine(Phila Pa 1976),2011,36(17):1340-1349.
[14] 王储,郝东升,段圆慧,等.双足鼠脊柱侧凸模型手术方法改良[J].中华实验外科杂志,2009,26(12):1732-1733.
[15] Janssen MM,de Wilde RF,Kouwenhoven JW,et al.Experimental animal models in scoliosis research:a review of the literature[J].Spine J,2011,11(4):347-358.
[16] Brin MF.Botulinum toxin:chemistry,pharmacology,toxicity,and immunology[J].Muscle Nerve Suppl,1997,6:S146-168.