反相高效液相色谱法测定黄酒中的草酸
2012-04-13谭新勇孙军勇谢广发
谭新勇,孙军勇,谢广发,陆 健*
(1.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 生物工程学院,江苏 无锡 214122;4.中国绍兴黄酒集团有限公司 国家黄酒工程技术研究中心,浙江 绍兴 312000)
黄酒是我国的国粹,酒香浓郁,营养丰富,具有很高的营养价值和保健功效,深受人们喜爱[1]。目前我国黄酒行业呈现快速发展的趋势,消费量逐渐增大,年出口量也日益增多,但黄酒的非生物浑浊一直是困扰企业的难题,黄酒储存过程中的沉淀问题还有待彻底解决,在实际生产过程中,发现黄酒沉淀中还存在着草酸盐沉淀组分[2],在草酸含量高的成品酒瓶底会出现草酸盐沉淀。草酸在食品中是一种抗营养因子,在日常饮食中如果草酸含量过高,会导致草酸和钙离子结合形成草酸钙沉淀甚至导致结石症,对人的身体健康造成重要影响,人的尿液中草酸含量的高低是诊断结石病的一个重要指标[3]。黄酒的草酸盐沉淀一直困扰着黄酒企业,一旦出现沉淀,企业就要召回产品,这对企业造成了很大的经济损失。为解决黄酒出现的草酸钙沉淀问题,就需要建立合适的检测黄酒原料和生产工艺过程中草酸含量的方法。
目前黄酒行业并没有较好的方法来测定黄酒中的草酸含量[4],虽然检测食品中有机酸的方法很多[5-11],但各有优缺点。分光光度法分辨率低,灵敏度差,易受其他物质干扰,检测误差较大[5-6],而且黄酒颜色较深,比色效果不明显;用色谱法分析酿造酒中有机酸的报道很多[7-9],气相色谱要求酸有较高的挥发性,但草酸沸点较高、挥发性弱,不适合用气相色谱检测;反相高效液相色谱是应用最广泛的液相色谱法[8-9],在食品、生物分析、医药等领域均有重要作用,但在检测过程中,草酸与酒石酸的分离度较低,导致两峰检测结果不准确[12]。
本研究以邻苯二胺为衍生剂,与草酸进行衍生化反应。邻苯二胺与草酸的2个羧基在高温作用下发生特定反应,生成化合物——2,3-二羟基喹喔啉[13],其是强紫外吸收化合物,在波长314nm处有最大吸收峰,可以被检测器灵敏检测到[14-15]。在国外,将邻苯二胺与草酸衍生后测定其含量的方法已经应用于啤酒和蔬菜中草酸含量的测定,结果满足检测要求[13]。2,3-二羟基喹喔啉的吸收峰能够与杂峰很好分离,而且解决了草酸与酒石酸分离度较低的问题。在此基础上研究了最佳的色谱分离条件,优化了流动相配比和流速,测定了衍生物的稳定性,进行了精密度实验和回收率实验,取得较满意结果,证明本方法可应用于黄酒中草酸含量的测定。
1 材料与方法
1.1 主要仪器设备
戴安Ultimate3000液相系统、色谱柱(Dionex Acclaim 120 C184.6×250mm 5μm):美国戴安公司;Aglient Zorbax SB-Aq 4.6×150mm 5μm,Aglient extent-C184.6×250mm 5μm,美国安捷伦公司;Sunfire 4.6×250mm 5μm,美国Waters公司;AP-01P型无油隔膜真空泵,天津奥特赛恩斯仪器有限公司;PE20精密pH计,梅特勒-托利多仪器(上海)有限公司;QT-1涡旋混合仪,海门市其林贝尔仪器制造有限公司;Heraeus Fresco 17离心机,德国Thermo scientific公司;KQ3200DB型数控超声波清洗器,昆山市超声仪器有限公司。
1.2 主要试剂及实验材料
草酸(含2个结晶水)、邻苯二胺、氢氧化钠、盐酸、乙酸铵为分析纯,甲醇为色谱纯,均购于国药集团药业股份有限公司;黄酒为无锡本地市售产品,某黄酒企业提供不同批次的酒样。
1.3 实验方法
1.3.1 草酸标准样品的配置
准确称取0.07g草酸置于500mL容量瓶中,用超纯水溶解并定容,配置成100mg/L的标准溶液,置于4℃冰箱中备用。
1.3.2 流动相的配置
准确称取7.71g乙酸铵置于1000mL容量瓶中,定容后以甲醇:乙酸铵溶液=15:85的比例加入甲醇,混匀后经0.45μm混合纤维滤膜抽真空过滤,超声波脱气30min后使用。
1.3.3 衍生
按照参考文献[13]的方法,将草酸标样或黄酒样品用10mol/L盐酸酸化至pH=1.0后,取5mL样品置于20mL螺口玻璃离心管中,加入10μL盐酸(10mol/L)和2mL邻苯二胺溶液(10g/L),混匀后称重,在110℃烘箱中保温6h,室温冷却后添加双蒸水恢复至原来重量,用10mol/L NaOH溶液调节pH值至5.0~6.0,并2000r/min离心10min,最后样品用0.45μm混合纤维滤膜过滤,转移到液相样品瓶中即可进行色谱分析,柱温为25℃,进样量为50μL。
1.3.4 草酸定性定量方法
通过测定标样的保留时间、样品加标定性。将草酸标准溶液衍生后进行处理,在优化的色谱条件下进样,以峰面积外标法定量。
2 实验结果
2.1 不同色谱柱分离效果的比较
本实验利用4根不同的反相高效液相色谱柱,在不同条件下对衍生物进行分离,由于黄酒样品色谱峰较多,对分离要求高,最终选择了分离效果好、目的峰明确的Dionex Acclaim 120 C18色谱柱。
2.2 流动相中甲醇比例对分离效果的影响
流动相中选择甲醇含量为10%vol、15%vol、20%vol,考察其对分离效果的影响,见图1。当甲醇含量为10%vol时,目的峰保留时间为20.25min,分离时间长。随着甲醇含量的增加,出峰时间逐渐靠前,当甲醇含量为20%vol时,目的峰保留时间为8.25min,此时出峰时间集中,分离度较低。当甲醇含量为15%vol时,目的峰保留时间为10.68min,黄酒样品中目的峰能与其他峰分开,出峰时间较适宜,因此最终选择甲醇比例为15%vol。
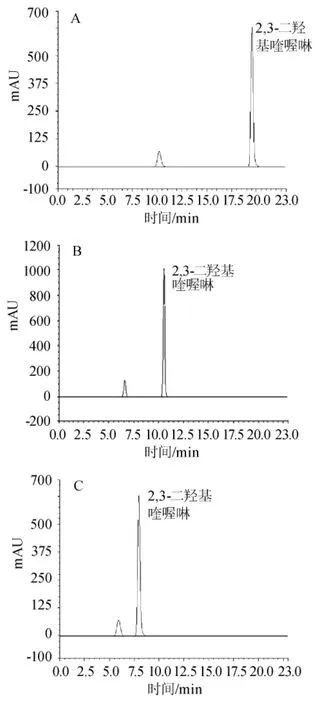
图1 流动相中不同比例甲醇对标样分离效果的影响Fig.1 The effects of different proportion of methanol in mobile phase on standard separation
2.3 流动相流速对分离效果的影响
分别选择流动相流速为0.8mL/min、1.0mL/min、1.2mL/min进行实验,检测对分离效果的影响。结果表明,流速对分离效果的影响较小,但流速低会导致分离时间长,峰型欠佳,分离效果差,应当选择高流速,但由于色谱柱自身柱压的限制,流速只能达到1.2mL/min,最终确定流速为1.2mL/min,在此流速条件下,分离度能达到理想效果,目的峰能与其他峰分离,峰形较好,响应值也较高。
2.4 衍生物稳定性的测定
由于一般衍生物的化学性质不稳定,2,3-二羟基喹喔啉是首次应用于黄酒中,因此需要对2,3-二羟基喹喔啉的稳定性进行检测。取衍生好的样品,每隔1h测定样品中2,3-二羟基喹喔啉的含量,与第一次测定结果的比值表示测定的相对含量,连续测定7h,获得的结果见图2。由图可知,在前3h内衍生物的相对含量值均在0.95以上,因此可以确定衍生结束后3h内为测定的最佳时间。
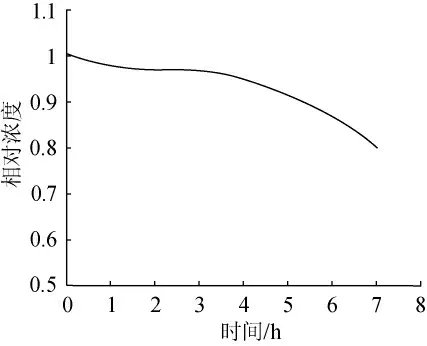
图2 衍生物相对含量随时间变化图Fig.2 The change of relative content of derivatives with time
2.5 草酸标样和黄酒样品的色谱分离图
综上所述,黄酒中草酸检测的最优条件为色谱柱:Dionex Acclaim 120 C18柱;流动相甲醇:0.1mol/L乙酸铵=15:85(v/v);流速1.2mL/min;柱温25℃;检测波长314nm;进样量50μL;在3h以内进行测定。应用优化后的条件,对草酸标样和黄酒样品进行衍生测定,结果见图3。由图3可知,黄酒中草酸衍生物分离效果好,能够达到基线分离,无明显杂峰干扰。
2.6 标准工作曲线及线性范围的确定
分别取1mL、2mL、3mL、4mL、5mL草酸标准溶液,加双蒸水到5mL,然后按照样品处理方法,经衍生后进行色谱分析,以峰面积定量,得到草酸的标准曲线见图4,标准曲线为y=1.9772x-3.503,R2=0.9986。结果表明草酸浓度在20mg/L~100mg/L范围内呈现良好的线性关系。
2.7 精密度和回收率实验
按照检测方法,对样品进行重复性实验(n=5),进行统计学处理。结果见表1,在多次测定的样品中,测定重现性均较好。选择3种酒样,分别取5mL黄酒为酒基,各添加2.0g/L的标准溶液50μL、100μL、200μL,配置成加标量分别为20mg/L、40mg/L、80mg/L的样品,经过衍生后进行检测,计算得平均回收率见表2。
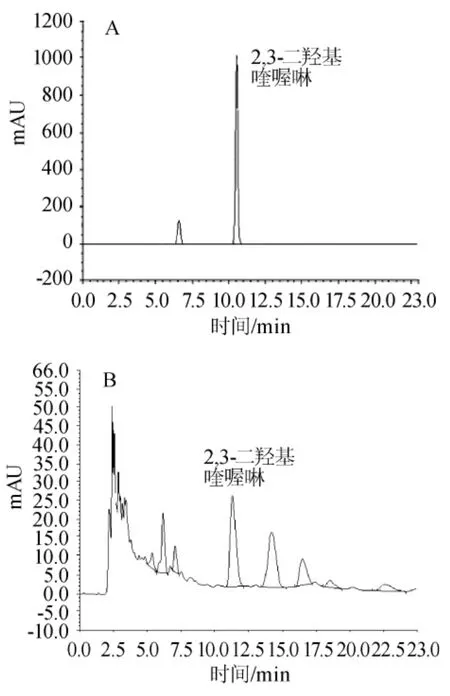
图3 标样(A)和黄酒(B)中草酸衍生物的检测Fig.3 The detection of oxalic acid derivative on standard(A) and rice wine(B)
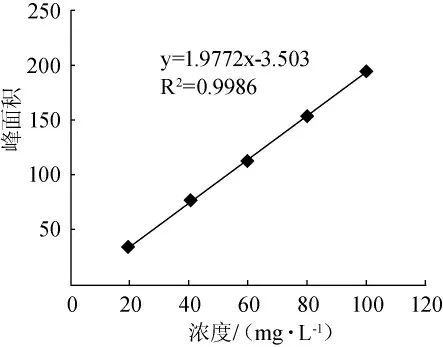
图4 草酸标准工作曲线Fig.4 Standard working curve of oxalic acid
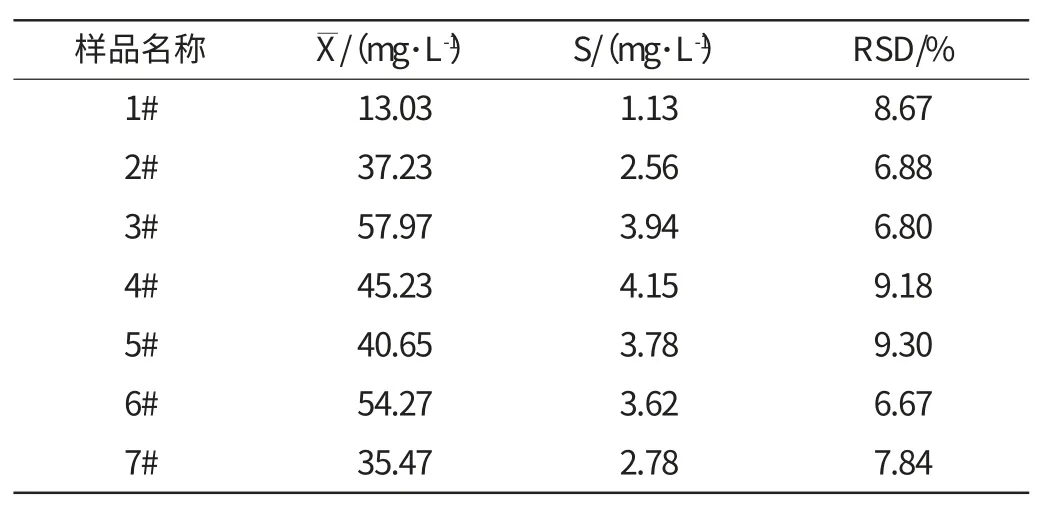
表1 草酸含量的精密度实验(n=5)Table 1 The precision experiments of oxalic acid content (n=5)
从表1可以看出,对于草酸含量不同的样品,其相对标准偏差在6.67%~9.30%,精密度较好,说明本方法的重现性较好,适合测定黄酒中的草酸含量。从表2可以看出,在样品中添加不同量的草酸标样,其回收率在91.40%~103.70%,说明该方法准确性好,可以保证测定结果的可靠性。
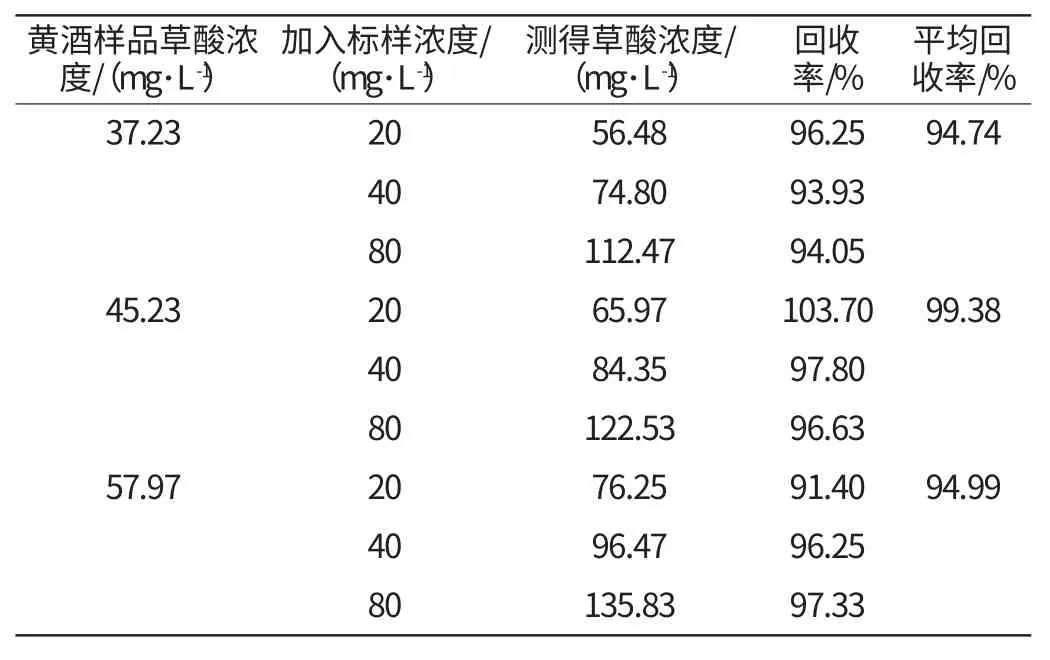
表2 草酸含量的回收率实验(n=3)Table 2 The recovery experiments of oxalic acid content (n=3)
2.8 市售黄酒中草酸含量的测定
对市售黄酒中草酸含量进行测定,得到黄酒中草酸含量最低为13.03mg/L,最高为57.97mg/L,平均草酸含量为40.55mg/L,不同品牌的黄酒中草酸含量差异很大。对于同一黄酒企业中的不同酒样进行检测发现机制加饭酒中草酸含量高于手工加饭酒,可能与黄酒酿造使用的原料、生产工艺及储存环境有关。
3 结论
建立了一种先衍生,然后利用反相高效液相色谱法检测黄酒中草酸含量的方法,最优检测条件为色谱柱:Dionex Acclaim 120 C18柱(4.6×250 mm,5μm);流动相为甲醇和0.1mol/L乙酸铵(15:85 v/v);流速1.2mL/min;柱温25℃;检测波长314nm。该方法检测简便,线性关系良好,重现性好,相对标准偏差<9.30%,回收率高,平均回收率为91.40%~103.70%。测得不同品牌黄酒中草酸含量有一定差异,最低值为13.03mg/L,最高值为57.97mg/L。而且机制加饭酒中草酸含量要高于手工加饭酒。差异可能与使用原料、生产工艺及储存时间、环境有关。研究结果对于研究黄酒发酵过程中草酸含量变化、控制黄酒中草酸含量、减少草酸钙沉淀的产生有一定的指导意义。
[1]谢广发,戴 军,赵光鳌,等.科学认识黄酒的保健养生功能[J].中国酿造,2004,23(1):30-31.
[2]谢广发,沈 斌,胡志明,等.黄酒中的另一种沉淀-草酸钙沉淀[J].酿酒,2011(3):26-28.
[3]俞 乐,彭新湘,杨 崇,等.反相高效液相色谱法测定植物组织及根分泌物中草酸[J].分析化学,2002,30(9):1119-1122.
[4]徐岳正,周建弟,丁关海.浅谈绍兴酒中的有机酸[J].酿酒科技,2004(6):77-78.
[5]何春艳,黄敏华.比色法测定啤酒中的草酸含量[J].啤酒科技,2006(11):13-15.
[6]刘立梅.反相高效液相法和荧光光度法测定啤酒中的草酸含量的应用和比较[J].酿酒科技,2009,179(5):117-120.
[7]银 燕,沈尧绅.高效液相色谱法测定果酒中的有机酸[J].食品与发酵工业,1990,16(5):44-48.
[8]杨 毅,李 崎,陈 蕴,等.反相高效液相色谱法(RP-HPLC)测定啤酒中的有机酸[J].食品与发酵工业,2003,29(8):6-11.
[9]冯德明,张 洋,赵惠明,等.反相高效液相色谱法测定黄酒中的有机酸[J].中国酿造,2009,28(3):157-161.
[10]黄桂颖,白卫东,杨幼慧,等.反相高效液相色谱法测定荔枝肉中10种有机酸[J].现代食品科技,2009,25(5):568-570.
[11]冯爱军,赵文红,白卫东,等.不同黄酒中有机酸的测定[J].中国酿造,2010,29(8):144-146.
[12]刘 景,李 崎,顾国贤.反相高效液相色谱法测定麦汁中的草酸[J].中国酿造,2005,24(10):44-46.
[13]RODRIGUES J A,BARROS A A.Development of a method for oxalate determination by differential-pulse polarography after derivatization with o-phenylenediamine[J].Anal Chim Acta,1993,273(2):531-537.
[14]张惠静,张世德.高效液相色谱法测定血和尿中的草酸[J].第三军医大学学报,1997(2):87-88.
[15]MARTZ FA,WEISS MF,BELYEA RL.Determination of oxalate in forage by reverse-phase high pressure liquid chromatography[J].J Dairy Sci,1990,73(2):474-479.
