树突状细胞为基础的胰腺癌与黑素瘤疫苗
2012-04-11河北医科大学第四医院生物治疗科汪治宇
河北医科大学第四医院生物治疗科 汪治宇
1.前言
免疫细胞治疗实体肿瘤的临床应用包括抗肿瘤的反应性T细胞过继转移和使用“治疗性的”疫苗,并正在许多领域迅速发展[1-10]。当前以在动物肿瘤模型中得到验证的新型树突状细胞(DC)为基础的疫苗已进入临床,有望为肿瘤的免疫治疗提供一条新的有效途径。临床前研究表明,化疗或放疗所诱导的淋巴细胞减少可提高几种不同的、以细胞为基础的免疫治疗方法的抗肿瘤效果。例如,从清髓剂量的全身照射(TBI)和整体(即含驻地T细胞)骨髓移植(BMT)所致的淋巴细胞减少症中逐渐恢复的小鼠体内,以DC为基础的疫苗可加速T细胞的重建及活化。在小鼠的同源及同种异源模型中,清髓性TBI和整体BMT之后的DC瘤苗接种是一种诱导已形成的肿瘤衰退或生长延迟的有效手段。当疫苗接种与重建同时进行时可诱发最有效的抗肿瘤免疫反应,而延迟的疫苗接种可能降低T细胞的抗肿瘤效力(可能为调节性T细胞和/或髓源性抑制细胞的重建所致)。
尽管这一领域的临床试验表明,不论临床研究终点还是免疫学研究终点都获得了一些肯定的结果,但以DC为基础的多种疫苗在接种后,抗肿瘤免疫反应并未获得令人满意的持久性。人们通过对以细胞为基础的免疫疗法抑制肿瘤的机制的研究,寻找改进的机会。这些改进包括通过选择性抑制调节细胞,促进T细胞共刺激,以及联合重组细胞因子和其他被定义为存在“免疫增强”活动的分子,进而打破对肿瘤“自身”抗原的耐受。在T细胞的抗肿瘤功能的“质量”受损的情况下,可应用IL-15、抗-CD40或者程序性死亡1(PD-1)等进行援救,潜在地为以DC为基础的疫苗提供了更宽泛的使用空间。
2.应用CCL-21以增强黑素瘤DC疫苗的效力
在过去的几年里,人们对于趋化因子的关注日益增长,这是一种在免疫及炎症反应中起关键作用的小分子蛋白质,它可以指导白细胞趋向受损部位及免疫反应初次启动的部位(次级淋巴组织,如淋巴结、脾脏、Peyer's 斑和扁桃体)。有四类趋化因子(C,CC,CXC和CX3C),笔者依据蛋白质氨基末端的半胱氨酸残基数目及位置对它们进行命名。这些分子通过PTX敏感的G蛋白偶联受体与其靶细胞进行相互作用。不同的趋化因子作用于不同种类的白细胞,从而根据特定情况下的需求,调控免疫效应细胞向病变组织的趋化。在早期的工作中,人们对应用趋化因子诱导抗肿瘤免疫反应进行了研究,其中包括应用趋化因子基因转染肿瘤细胞。凭借这种方法,当应用可产生RANTES(一种CC趋化因子)的基因来逆转肿瘤细胞时,将会产生抗肿瘤免疫反应[11]。这一免疫反应可归功于,至少可部分归功于向肿瘤部位聚集的单核细胞及效应T细胞。相似的,由于淋巴细胞效应器增多所致的效应也可见于其他应用,例如:Mig(CXCL9)和淋巴细胞趋化因子(XCL1)。这种方法的缺点之一是它依赖于效应细胞向肿瘤部位的迁移,以启动抗肿瘤反应,但其前提是负载肿瘤的宿主体内须贮存有大量循环的效应细胞。
笔者首先对次级淋巴组织趋化因子SLC/CCL-21进行了研究,它是一种发现于淋巴结高内皮微静脉内的CC趋化因子。据报道,这是一种特异性吸引幼稚T细胞和DCs的趋化因子。通过重组腺病毒载体(将SLC/CCL-21基因与病毒载体重组)感染负载转基因小鼠肿瘤抗原的DCs(TL-DC)产生SLC/CCL-21(见图1),从而笔者能够通过创造新的有功能的“淋巴结样”结构来特异性地召集幼稚T细胞至皮肤注射TL-DC的部位(TL-DC相当于抗原呈递细胞,通过在局部产生SLC/CCL-21来诱导大量幼稚T细胞到达相应部位)[12,13]。当幼稚T细胞在接种部位遇到TL-DC,二者可通过共刺激及主要组织相容性抗原(MHC)分子Ⅰ和Ⅱ相互作用,如此便启动了初级免疫反应,随之产生一种强大的系统性抗肿瘤免疫反应(由于激活的T 细胞从局部游出并通过外周血系统性地播散),这导致了皮肤部位局部肿瘤及末梢血管部位的转移性疾病的削弱。因此,SLC/CCL-21在体内即可诱发抗肿瘤反应,又可增强TL-DC引起的抗肿瘤反应。同样,直接在肿瘤组织注入转基因DCs,肿瘤细胞自身就会表达SLC/CCL-21,进而导致T细胞大量、持久地流入肿块内部,而引流淋巴结(DLN)内T细胞数量仅有短暂升高。TL-DC被限制在肿瘤部位,仅有很小的百分比迁移至DLN。浸润肿瘤肿块的T细胞在24h之内即表达出CD25,并在7天之内分泌出特异性针对肿瘤的IFN-α,而使肿瘤生长受到限制(图2)。重要的是,相似的数据可在淋巴毒素-α基因已敲除、缺乏外周淋巴结的小鼠体内获得。后者首次证实了效应T细胞可于淋巴结以外激活,进而通过在体内产生新的、有功能的、“淋巴结样”的结构显著增强抗肿瘤效应。

图1:经重组腺病毒转染小鼠树突状细胞(DC)后SLC/CCL-21表达情况比较。以Ad-GFP为对照,并设立空白对照组,实验组分为DC以每个细胞5,000(Ad-SLC 5K)或25,000(Ad-SLC 25K)个病毒颗粒的数量被转染两个亚组。采用标准ELISA法检测转基因DC的上清。结果示SLC/CCL-21的表达量在实验组显著高于对照组,且Ad-SLC 5K亚组高于Ad-SLC 25K亚组。
基于此项工作,本课题组对人类TL-DC同样进行了基因修饰以分泌SLC/CCL-21,它与上述的小鼠研究相似,可以强有力地聚集人类幼稚CD4+及CD8+T细胞(此例在体外)[14]。重要的是,笔者首次证实了分泌SLC/CCL-21的TL-DC也可以显著提高针对特异性黑色素瘤肽MART-1(图3A)和gp100(图3B)的肿瘤抗原特异性T细胞的数量。因此,表达SLC/CCL-21的TL-DC相当于一个媒介,它既可以聚集幼稚T细胞,又能提高肿瘤特异性T细胞的数量。这些体外实验数据成为了一项正在Moffitt癌症中心进行的针对黑色素瘤患者的临床试验的依据,该试验名为“关于CCL-21腺病毒感染的MART-1/gp100肽激发的树突状细胞成熟地应用细胞因子治疗化疗抵抗的转移性黑色素瘤患者的剂量范围的研究”。
3.一种针对胰腺癌的新策略:经皮途径安全地接种以DC为基础的疫苗
在美国,胰腺癌的死亡率在所有癌症中位列第四。手术完整切除局部肿瘤是治愈的唯一机会,但在确诊时大部分(超过80%)病例已因肿瘤局部浸润或远处转移而失去手术机会[15,16]。剩余20%胰腺癌患者接受手术后能够长期生存者不足25%,而大部分仍将死于局部复发或远处转移。失去手术机会的胰腺癌患者一经诊断,总体上平均生存期在6个月之内[16]。传统的放化疗在延长生存期方面也收效甚微,仅能延长几周而非几个月。局部治疗,如近距离放射疗法或外部柱状放射,旨在使肿瘤缩小以延缓导致衰竭或威胁生命的症状,如黄疸或幽门梗阻的发生,但很少能使肿瘤缩小到允许手术切除。全身疗法主要用于减轻症状而非延长生存期。值得强调的是,当前的化疗标准用药,吉西他滨,已被美国食品药品管理局批准,但其在减轻疼痛,改善体重下降及提高生存质量方面有效,亦不能延长生存时间[16,17]。所以,我们需要研发新的疗法来治疗可手术的或不可手术的胰腺癌。

图2:重组SLC/CCL-21或DC-SLC/CCL-21治疗后肿瘤内产INF-γ的T细胞计数。对肿瘤标本的CD4和CD8进行IFN-γ细胞因子染色。细胞数以肿瘤体积进行标准化,并表示为细胞数/mm3。***,DC-SLC相对于所有其他各组(P<0.001)。
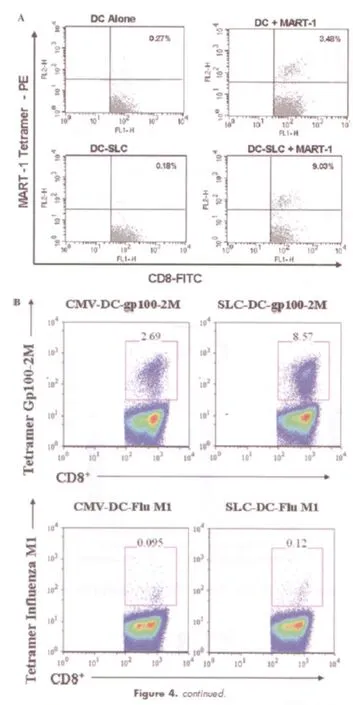
图3:Ad-SLC转染的DC在体外激活黑色素瘤肽(MART-1和gp100)特异性T淋巴细胞的情况。 (A)未经转染的和经Ad-SLC转染的人类白细胞抗原(HLA)-A201阳性DC被MART-1激发后,肿瘤特异性T淋巴细胞被不同程度的激活。刺激两到三次以后,对MART-1四聚体进行染色,采用流式细胞术计数细胞数量。经Ad-SLC和MART-1激发的DC可获得数量最多的T淋巴细胞。(B)以巨细胞病毒转染DC为对照,经Ad-SLC转染的DC能更大程度的激活T淋巴细胞对黑色素瘤肽gp100的反应活性。
以免疫为基础的疗法已作为一种新的治疗晚期胰腺癌的方法被提出[18]。这种疗法的原理在于聚集并激活识别肿瘤特异性抗原的T细胞,由此提高局部及系统性的抗肿瘤效果[18]。DC为基础的疫苗作为一种策略已在其他临床前及临床实体性肿瘤试验中得到肯定[19-21]。笔者前期已在同源小鼠模型上证实了肿瘤内直接注射DC可介导小鼠体内已形成的肿瘤结节的逆转并为抵抗后续的肿瘤威胁提供有效的免疫。这种抗肿瘤效应可被重组的肿瘤坏死因子-α(TNF-α)[22]或通过高度异源免疫原性的载体蛋白钥孔戚血蓝素预激发的DCs加强。
TNF-α是一种具有强大抗癌特性的多功能细胞因子,这已在许多临床前及临床试验中得到证实[25,26]。TNF-α是已知的最强有力的凋亡诱导剂之一,但因其剂量限制性毒性使其不能全身给药,研究人员正在找寻提高肿瘤内TNF-α(及由之诱导的凋亡)水平的替代性方法。向肿瘤内直接注射重组TNF-α蛋白理论上有效,但在胰腺肿瘤中实践起来是不可行的,原因为其半衰期短,频繁经皮向胰腺肿瘤穿刺所造成的后续问题,以及潜在的系统性吸收。
最近一种应用腺病毒表达TNF-α的基因疗法以其低毒性而被应用于实体肿瘤的临床试验[27]。TNFeradeTM是一种二代的、复制缺乏的腺病毒载体,它以一种可被放射诱导的、迅速的反应表达人类TNF-αcDNA,Egr-1基因启动子连接于人类TNF-αcDNA的起始位点。载体通过聚焦电离辐射确保TNF-α的分泌量得到控制,因此排除了相关的外周系统性吸收及附近的、正常的、未经注射的组织的毒性。TNF-α可通过在肿瘤血管形成血凝块及通过在局部产生损伤DNA的羟自由基对肿瘤细胞产生直接的细胞毒性而引起凋亡和坏死,进而发挥抗肿瘤作用。在注射了包含TNF-αcDNA的腺病毒的肿瘤团块中,缺氧及细胞毒性均可提升凋亡指数[28]。Ⅰ期试验运用载体已获得了肯定的治疗胰腺癌的疗效,这就需要后续针对TNFeradeTM的随机的、胰腺癌特异性的Ⅱ期试验[29]。
电离辐射也可在正常及癌症组织中诱导显著的凋亡。诱导凋亡是放疗对肿瘤产生杀伤性的主要机制之一。一些研究已经提出放疗联合DC为基础的免疫疗法效果显著。剂量仅为1Gy的辐射后也会发生辐射诱导的凋亡[30]。
任何胰腺癌的局部治疗方法的固有局限性在于远处转移所致的死亡。尽管TNFeradeTM或放疗仅是局部给予且并未显示出对远距离转移的疗效,而笔者假定一种辅助的治疗策略(如DCs)为了更佳的临床疗效而必须具有可诱导系统性免疫的功能。此外,通过增加肿瘤抗原的暴露以增强DC的功能从而同时增强DC的局部效果。
基于这些理念及笔者的临床前期动物实验研究,笔者开展了一项关于局部晚期或小范围转移的胰腺癌治疗的临床试验,它将TNFeradeTM、放疗和KLH-激发的患者自身的DCs结合起来,名为“KLH-激发的患者自身的DCs联合肿瘤内直接注射TNFeradeTM治疗局部晚期或小范围转移的胰腺癌的Ⅱ期实验”。局部晚期或小范围转移的胰腺癌(PCA)患者要进行3个周期的治疗,总共超过3周。每个周期包括数字体层摄影术(CT)引导的肿瘤内注射,放射诱发的(2Gy/天×3)TNF-α腺病毒(表示为TNFeradeTM;GenVec,Inc.,Gaithersburg,美国)激活以诱导凋亡以及KLH激发的DCs。研究终点包括:生产疫苗及低死亡率的前提下完成治疗的能力,治疗前后安全地对肿瘤进行取样以检验其生物学反应,肿瘤反应以及总体及各进程中的无瘤生存率。对一般表达的PCA抗原(即MUC-1和CEA)的免疫反应也运用酶联免疫斑点法(ELISPOT)进行了测定。
到目前为止已有16名患者入组,观察到的毒性包括恶心、体质上的症状以及注射部位的疼痛。依据实体瘤疗效评价标准(RECIST),笔者在3名患者身上观察到了部分临床反应,其中一名患者的转移性肝损害消失(图4)。2名患者的肿瘤降阶到可进行手术治疗,其肿瘤标记物CA-199已恢复正常(图5所示为其中一人),而且在诊断后的6.5到7个月未发现患病的证据(NED)。到目前为止,已证实在对治疗有反应的患者体内存在对KLH的免疫反应,浸润肿瘤的T细胞显著升高及肿瘤肿块的部分坏死。对新的针对PCA的瘤苗策略的评价分析证实其均有可行性和安全性,同时存在可接受的风险。笔者已观察到抗肿瘤反应,其他有关的生物学数据和即将入组的患者将进行进一步的研究。

图4:治疗13周后的胰腺癌患者的CT扫描,胰腺癌患者的治疗13周后,可见肝转移已消失。

图5:经TNFeradeTM、放疗和KLH-激发的患者自身的DCs治疗6周后(post-treatment 1)及9周后(post treatment 2),其中1名胰腺癌患者癌症抗原(CA)199水平降低。
[1] Fields, R.C., K.Shimizu &J.J.Mul'e.1998.Murine dendritic cells pulsed with whole tumor lysates mediate potent antitumor immune responses in vitro and in vivo[J].Proc.Natl.Acad.Sci.USA 95:9482 -9487.
[2] Shimizu, K., R.Fields, M.Giedlin, et al.1999.Systemic administration of interleukin-2 enhances the 40 Annals of the New York Academy of Sciences therapeutic efficacy of dendritic cellbased tumor vaccines[J].Proc.Natl.Acad.Sci.USA 96:2268-2273.
[3] Asavaroengchai,W., Y.Kotera &J.J.Mul´e.2002.Tumor lysatepulsed dendritic cells can elicit an effective antitumor immune response during early lymphoid recovery[J].Proc.Natl.Acad.Sci.USA 99:931-936.
[4] J.J.Mul'e, 2000.Dendritic cells:At the clinical crossroads(InvitedCommentary) [J].J.Clin.Invest.105:707-708.
[5] Weber, J.S.&J.J.Mul´e.2001.How much help does a vaccineinduced T cell response need? (Invited Commentary)[J].J.Clin.Invest.107:553-554.
[6] Maine, G.N.&J.J.Mul´e.2002.Making room for T cells.(Invited Commentary)[J].J.Clin.Invest.110:161-164.
[7] J.J.Mul´e.&J.S.Weber.2004.Translation of cancer immunotherapies[J].Nat.Med.10:1153.
[8] Sondak, V.K., M.S.Sabel &J.J.Mul´e.2006.Melanoma vaccines:Where have we been and where are we going?[J] Clin.Cancer Res.12:2337-2341.
[9] Anasetti, C.&J.J.Mul´e.2007.To ablate or not to ablate? HSCs in theTcell driver's seat.(Invited Commentary)[J].J.Clin.Invest.117:306-310.
[10] Coppola, D.&J.J.Mul´e.2008.Ectopic “lymphnodes” within human solid tumors (Invited Editorial)[J].J.Clin.Oncol.26:4369-4370.
[11] J.J.Mul´e.M.C.Custer, B.Averbook, et al.1996.Genetic modification of a murine fibrosarcoma to secrete the chemotactic cytokine RANTES:Loss of tumorigenicity in vivo is dependent upon host immune cells[J].Hum.Gene Ther.7:1545-1553.
[12] Kirk, C.J., D.Hartigan-O’Connor, B.J.Nickoloff, et al.2001.T cell dependent immunity mediated by secondary lymphoid tissue chemokine (SLC):Augmentation of dendritic cell based immunotherapy[J].Cancer Res.61:2062-2070.
[13] Kirk, C.J., D.Hartigan-O’Connor &J.J.Mul´e.2001.The dynamics of the T cell antitumor response:chemokine secreting dendritic cells can prime tumor reactive T cells extranodally[J].Cancer Res.61:8794-8802.
[14] Terando, A., B.Roessler &J.J.Mul´e.2004.Chemokine gene modification of human dendritic cell-based tumor vaccines using a recombinant adenoviral vector[J].Cancer Gene Ther.11:165-173.
[15] Sener, S.F., A.Fremgen, H.R.Menck, et al.1999.Pancreatic cancer:a report of treatment and survival trends for 100,313 patients diagnosed from 1985-1995, using the National Cancer Database[J].J.Am.Coll.Surg.189:1-7.
[16] Burris, H.A., M.J.Moore, J.Andersen, et al.1997.Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer:a randomized trial[J].J.Clin.Oncol.15:2403-2413.
[17] Laheru, D.&EM.Jaffee.2005.Immunotherapy for pancreatic cancer - science driving clinical progress[J].Nat.Rev.Cancer 5:459-467.
[18] Chang, A.E., B.G.Redman, J.R.Whitfield, et al.2002.A phase I trial of tumor lysate-pulsed dendritic cells in the treatment of advanced cancer.Clin[J].Cancer Res.8:1021-1032.
[19] Geiger, J.D., R.J.Hutchinson, L.Hohenkirk, et al.2001.Vaccination of pediatric solid tumor patients with tumor lysate-pulsed dendritic cells can expand specific T cells and mediate tumor regression.Cancer Res.61:8513-8519.
[20] Geiger, J., R.Hutchinson, L.Hohenkirk, et al.2000.Treatment of solid tumours in children with tumourlysate-pulsed dendritic cells[J].Lancet 356:1163-1165.
[21] Candido, K.A., K.Shimizu, J.C.McLaughlin, et al.2001.Local administration of dendritic cells inhibits established breast tumor growth:implications for apoptosis-inducing agents[J].Cancer Res.61:228-236.
[22] Shimizu, K., M.Giedlin &J.J.Mul´e.2001.Enhancement of tumor lysate- and peptide-pulsed dendritic cell-based vaccines by the addition of foreign helper protein[J].Cancer Res.61:2618-2624.
[23] Timmerman, J.M.&R.Levy.2000.Linkage of foreign carrier protein to a self-tumor antigen enhances the immunogenicity of a pulsed dendritic cell vaccine[J].J.Immunol.164:4797-4803.
[24] Corti, A.&M.Ponzoni.2004.Tumor vascular targeting with tumor necrosis factor alpha and chemotherapeutic drugs[J].Ann.N.Y.Acad.Sci.1028:104-112.
[25] Mocellin, S., C.R.Rossi, P.Pilati, et al.2005.Tumor necrosis factor, cancer and anticancer therapy.Cytokine Growth Factor Rev[J].16:35-53.
[26] Mundt, A.J., S.Vijayakumar, J.Nemunaitis, et al.2004.A phase I trial of TNFerade biologic in patients with soft tissue sarcoma in the extremities[J].Clin.Cancer Res.10:5747-5753.
[27] Hallahan, D.E.,H.J.Mauceri, L.P.Seung, et al.1995.Spatial and temporal control of gene therapy using ionizing radiation[J].Nat.Med.1:786-791.
[28] Hanna, N., J.R.Hecht, S.Vogel, et al.2004.Safety and efficacy of TNFerade in unresectable, locally advanced pancreatic cancer (LAPC):Results of the first two cohorts of a dose escalating study[J].J.Clin.Oncol.22, No14S, 3038.
[29] Chi, K.H., S.J.Liu, C.P.Li, et al.2005.Combination of conformal radiotherapy and intratumoral injection of adoptive dendritic cell immunotherapy in refractory hepatoma[J].J.Immunother.28:129-135.
