壳聚糖絮凝法精制黄精水提取液
2012-04-09於娜,黄山
於 娜,黄 山
(青岛科技大学化工学院,山东 青岛 266042)
黄精指百合科(Liliaceae)黄精属(Polygonatum)的黄精(P.sibiricum Del.ex Red.)、滇黄精(P. kingianumColl. et Hemsl.)和多花黄精(P.cyrtonem a Hua)等3种植物的干燥根茎[1]。黄精含有黄精皂苷、烟酸、糖类、醌类和氨基酸等元素,具有明显的提高免疫系统功能、抗衰老、降血糖和降血脂等药理作用[2]。黄精多糖已被证明具有良好的保健功能,因此对黄精多糖的研究具有重要的科学价值。采用传统精制工艺醇沉法需要消耗大量乙醇,生产成本高,且有效成分易损失。
壳聚糖为甲壳素的脱乙酰产物,自然资源丰富,生物相容性好[3],可用于粗多糖水提取液的除杂精制,主要是与其吸附性能和絮凝作用有关。壳聚糖通过分子内氢键产生吸附作用[5],能有效地除去粗多糖水提取液中的悬浮杂质颗粒和蛋白质胶体等不稳定成分和物质,有效地保留多糖成分。
为了在纯化过程中尽量保留浸出液的有效成分,采用单因素试验和正交设计法,以黄精多糖保留率和除杂率为指标,对黄精提取液精制工艺进行了研究,优选出壳聚糖絮凝法的最适宜工艺条件,并对壳聚糖絮凝法对粗多糖的除杂精制与普通醇沉法进行了对比。
1 试验仪器与材料
UV1000紫外分光光度计,北京莱博泰科仪器有限公司;电子恒温水浴锅,天津市泰斯特仪器有限公司;FA1104电子天平,上海金科电子天平有限公司;搅拌器,常州国华电器有限公司;离心机,天津市泰斯特仪器有限司;pHS-25型pH计,上海精科雷磁仪器厂;DM型控温电热套,山东鄄成华鲁仪器厂。
黄精,亳州市亳广中药饮片有限公司(批号 20081206);壳聚糖,上海伟康生物制品有限公司;硫酸,质量分数为98%,莱阳市康德化工公司;乙醇,质量分数为95%,烟台三和化学试剂有限公司;氢氧化钠,天津市北方天医化学试剂厂;蒽酮,上海化学试剂采购供应五联化工厂;盐酸,莱阳市康德化工有限公司。
2 试验方法与结果
2.1 黄精水提液中粗多糖的含量测定
2.1.1标准曲线的制备
2.1.1.1葡萄糖对照品溶液的制备
精密称取105 ℃干燥至恒重的葡萄糖0.1 g,置于100 mL容量瓶中,加蒸馏水至刻度(1 g/L),摇匀,备用。
2.1.1.2黄精水提液的制备
称取黄精药材100 g,加水煎煮2次。第1次加入10倍量水煎煮2 h,第2次加入8倍量水,煎煮1 h。2次的滤液合并,减压浓缩至规定浓度备用。
2.1.1.3壳聚糖溶液的配置
量取5 mL冰醋酸溶液,加水至500 mL配成体积分数为1.0%的冰醋酸溶液。称取5 g壳聚糖于上述冰醋酸溶液中,制成质量分数为1.0%的壳聚糖溶液,充分溶胀后作为絮凝剂备用。
2.1.1.4壳聚糖絮凝黄精水提液
量取黄精水提液适量,调pH值至规定值,加入一定量壳聚糖溶液,搅拌10 min,在一定水浴温度中放置一段时间,离心15 min(3 000 r/min),过滤,取滤液备用。
2.1.1.5蒽酮-硫酸试剂的制备
精密称取0.2 g蒽酮,溶于100 mL质量分数为72%硫酸中(须临用新配)。
2.1.1.6标准曲线的制备及线性关系的考察
精密量取对照品溶液(浓度为1.0 g/L)0.2、0.4、0.6、0.8、1.0、1.2和1.4 mL,分别置10 mL具塞刻度试管中,沿试管壁分别加入5 mL的2.1.1.4中制备的蒽酮-硫酸试剂,混匀,盖上玻璃塞在沸水浴中加热10 min,取出,在流水中冷却20 min后取出,以空白试剂调零照紫外-可见分光光度法在625 nm波长处测定的吸收度A。以吸收度为纵坐标,对照品浓度c(g·L-1)为横坐标,经线性回归处理得到标准曲线的回归方程为:A=0.530 2c+0.025 1,R2=0.999 8,结果见图1。
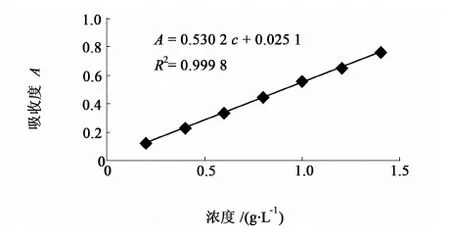
图1 葡萄糖标准曲线图Fig.1 Calibration of glucose concentration
2.1.2评定指标
壳聚糖絮凝方法主要对粗多糖提取液进行除杂精制,所以其评价指标是多糖保留率和除杂率。
2.1.2.1除杂率的计算
精密量取2.1.1.2项下黄精水提液和2.1.1.4项下絮凝后溶液各10 mL,置干燥至恒重的蒸发皿中水浴蒸干,于105 ℃干燥至恒重,称重并计算浸膏得率,从而求出除杂率(%),见式(1)。

(1)
2.1.2.2多糖保留率的计算
精密量取2.1.1.2项下黄精水提液和2.1.1.4项下絮凝后溶液各2 mL,测定吸收度A,求出粗多糖的浓度,计算粗多糖得率,从而求出多糖保留率(%),见式(2)。

(2)
为了综合考察壳聚糖絮凝除杂作用,既要求多糖保留较多又要除杂效果较好。本试验采用综合评定的方法对除杂率和多糖保留率进行评定综合评定,见式(3)。
综合评分(%)=保留率(%)×0.7+除杂率(%)×0.3
(3)
2.2 单因素考察的筛选
2.2.1絮凝剂加入量的考察
分别量取40 mL黄精水提液,加水稀释至m(黄精)∶V(水提液)为2∶10(g∶mL),调节pH值为2.0,加入药液体积5%、10%、15%、20%和25%的质量分数为1.0%的壳聚糖絮凝剂,置于35 ℃恒温水浴中,絮凝2 h,在300 0 r/min的转速下离心10 min,取上清液20 mL,测定除杂率,取原液与上清液各2 mL,求出多糖保留率,计算综合评分。结果见表1。

表1 絮凝剂用量(以药液体积为基准)对综合评分的影响Table 1 Effect of flocculant dosage on the composite score
从絮凝剂加入量的结果中可以看出:随着壳聚糖加入量的增加,综合评分先增加后减少。在絮凝剂的加入量为药液体积15%时,综合评分最高。壳聚糖对多糖的沉降作用主要是靠壳聚糖对多糖的吸附作用,壳聚糖是大分子的物质,它的吸附主要是靠吸附架桥和电中和。当絮凝剂加入量过小时,絮凝剂没有完全和杂质分子进行吸附;当絮凝剂加入量过大时,絮凝剂与杂质分子过于饱和,反而影响了壳聚糖的杂质吸附[6],所以将絮凝剂的加入量作为正交试验的考虑因素。
2.2.2温度因素的考察
按2.2.1中的试验条件和方法,分别于30、35、40、45、50和55 ℃的恒温水浴中,测定除杂率;取原液和上清液各2 mL,测定多糖含量,求出多糖保留率,计算综合评分。结果见表2。
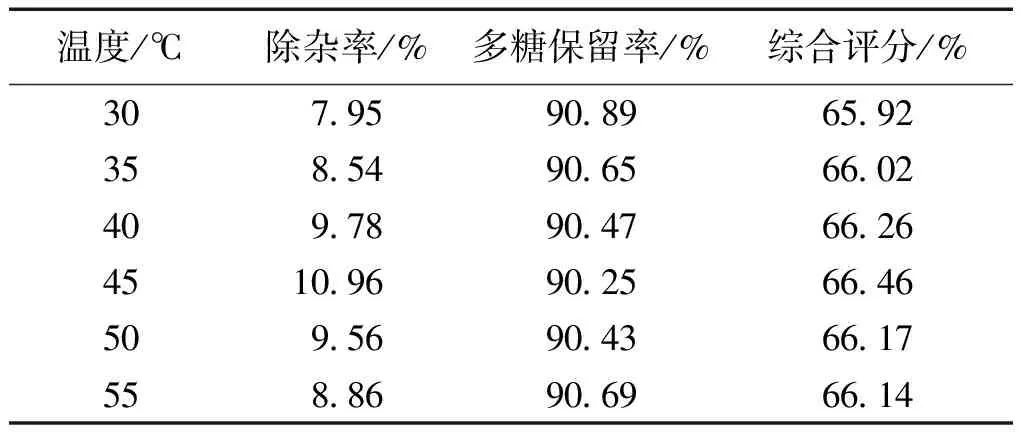
表2 温度对综合评分的影响Table 2 Effect of temperature on the composite score
从表2中可以看出:随着温度升高,除杂率先上升后下降,多糖保留率先下降后上升,综合评分为先上升后下降的趋势,且在45 ℃时综合评分最高。温度过低,絮凝剂的活性受到影响,温度过高,絮凝剂容易老化,在45 ℃絮凝效果最好。
2.2.3药液浓度因素的考察
按2.2.1中的条件,仅改变m(黄精)∶V(水提液)分别为2∶10、3∶10、4∶10、5∶10和6∶10(g∶mL),测定除杂率和测定多糖含量,求出多糖保留率,计算综合评分。结果见表3。

表3 药液浓度对综合评分的影响Table 3 Effect of liquid concentration on thecomposite score
从表3中可以看出:随着药液浓度增大,除杂率现上升后下降,多糖保留率先下降后上升,综合评分为先上升后下降的趋势,且当黄精水提液质量体积比为4∶10(g∶mL)时,综合评分最高。当药液浓度过大时,可能是絮凝剂大分子分散,影响了絮凝剂的絮凝效果。可将黄精水提液质量体积比为4∶10(g∶mL)的药液浓度定为最适宜浓度。
2.2.4pH值因素的考察
按2.2.1中的条件,仅改变pH值分别至2.0、3.0、4.0、5.0和6.0,取上清液20 mL,测定除杂率;取原液和上清液各2 mL,测定多糖含量,求出多糖保留率,计算综合评分。结果见表4。
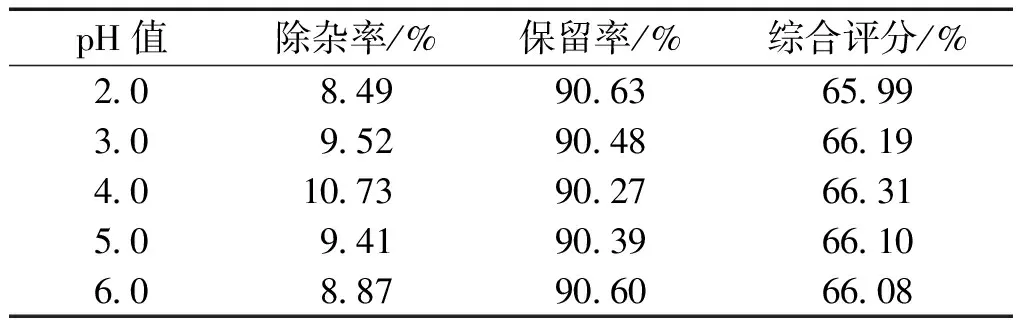
表4 pH值对综合评分的影响Table 4 Effect of pH value on the composite score
从表4中可以看出:随着pH值增大除杂率先增加后减小,多糖保留率呈先下降后上升,综合评分为先上升后下降的趋势,且当pH值为4.0时综合评分最高。在酸性条件下去除率较碱性条件下高,这可能与多糖提取液中杂质在弱酸性条件下呈阴离子型有关[7]。pH值过小或者过大,都影响了壳聚糖的活性,pH值选择4.0为宜。
2.2.5絮凝时间因素的影响
按2.2.1中的条件,仅改变絮凝时间分别为1、2、3、和5 h,在3 000 r/min的转速下离心10 min,取上清液20 mL,测定除杂率;取原液和上清液各2 mL,测定多糖含量,求出多糖保留率,计算综合评分。结果见表5。
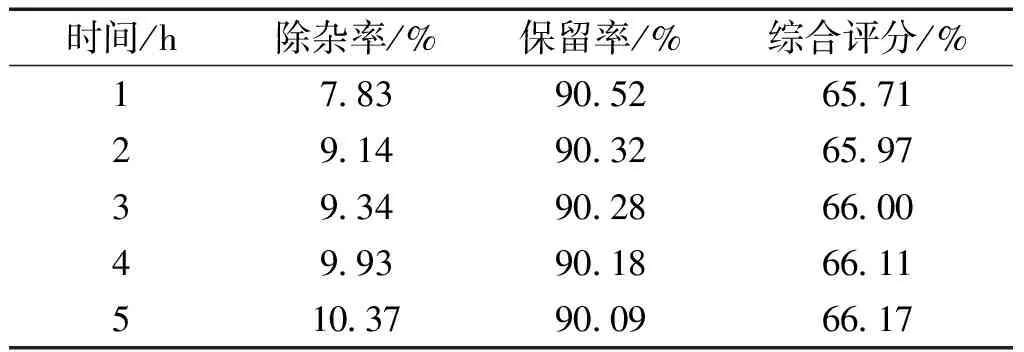
表5 时间对絮凝综合评分的影响Table 5 Effect of the flocculation time on thecomprehensive evaluation
由表5的结果可知:除杂率随着絮凝时间增加而逐渐增加,多糖保留率则呈逐渐下降的趋势。考虑到经济效益,确定絮凝时间选择1~3 h。
2.3 正交试验
2.3.1正交试验及结果
根据单因素试验的筛选结果,壳聚糖絮凝法精制黄精水提液工艺条件可初步优化为:m(黄精)∶V(水提液)为4∶10(g∶mL),絮凝剂用量为药液体积的15%,絮凝的pH值为4.0,絮凝温度45 ℃,絮凝3 h。延长时间会降低生产效率,因此优选絮凝时间为3 h。
综上,确定以药液浓度(A)、絮凝剂用量(B)、pH值(C)和温度(D)4个因素,每个因素选3个水平进行正交试验。因素及水平见表6,按照L9(34)的正交计划表进行,正交试验结果见表7,正交分析结果见表8。

表6 正交试验因素水平表Table 6 Factors and levels of orthogonal test
综合分析及结论:由方差和极差分析结果可知,影响壳聚糖絮凝的因素依次为:RA>RD>RB>RC。因素(A)和因素(D)对壳聚糖絮凝有显著影响,因素(C)对壳聚糖絮凝影响较少;因素中A的KⅡ>KⅢ>KⅠ;B的KⅡ>KⅢ>KⅠ;C的KⅡ>KⅠ>KⅢ;D的KⅠ>KⅡ>KⅢ。所以壳聚糖最适宜絮凝工艺是A2B2C2D1:m(黄精)∶V(水提液)为4∶10(g∶mL),絮凝剂用量为药液体积的15%,絮凝的pH值为4,絮凝温度为40 ℃。
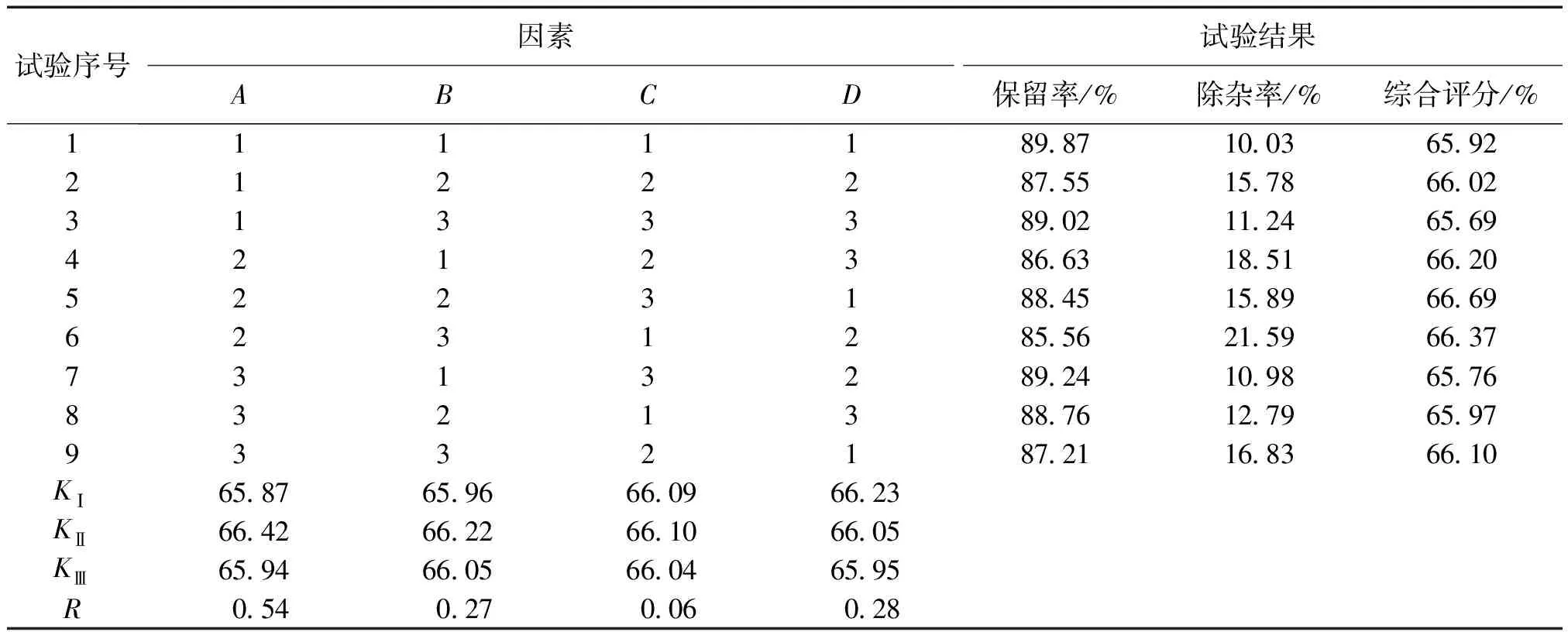
表7 正交试验结果Table 7 Results of orthogonal test
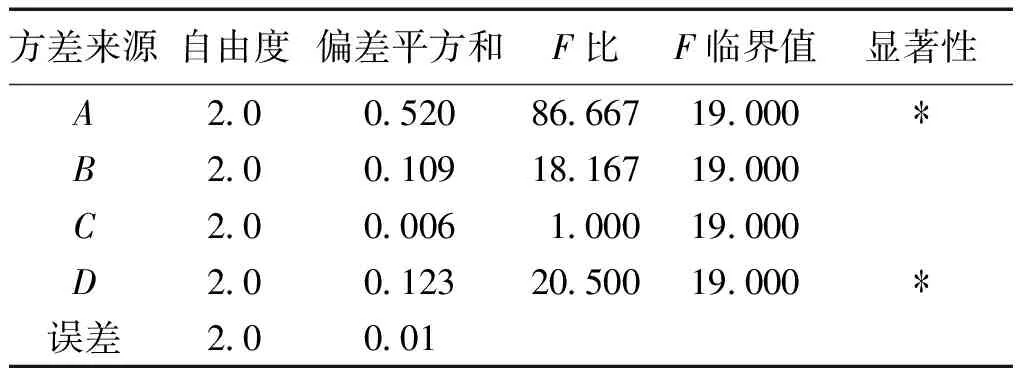
表8 正交方差分析Table 8 Analysis of variance
2.3.2最适宜提取工艺重现性试验
按正交试验所确定的最适宜提取工艺,分别量取40 mL水提液3组,m(黄精)∶V(水提液)为4∶10(g∶mL),调节pH值为4.0,置于40 ℃恒温水浴中,加入15%药液体积的质量分数为1.0%的壳聚糖溶液,絮凝3 h,在3 000 r/min的转速下离心10 min,取上清液20 mL,测定除杂率;取2 mL的上清液,求出多糖保留率,结果见表9。

表9 重现性试验的结果Table 9 Reproducibility of test results
从验证试验可以看出,最适宜壳聚糖絮凝工艺的综合评分都高于正交表里任何一组,说明该最适宜工艺稳定可行。
2.4 普通醇沉法和壳聚糖絮凝法的比较
量取40 mLm(黄精)∶V(水提液)为4∶10(g∶mL)的黄精水提液,在快速搅拌下加入95%的乙醇150 mL,室温静置24 h后,真空抽滤溶解滤渣至40 mL,取20 mL测定除杂率,测定多糖含量,求出保留率计算综合评分。同法量取40 mL的水提液药液,按照壳聚糖絮凝法正交优化最适宜絮凝工艺处理,测定除杂率和多糖保留率,结果见表10。
从表10可以看出,普通醇沉法的除杂率较高,达到49.75%。但多糖保留率较低仅为60.34%,综合评分仅为57.16,综合评分太低不符合粗多糖精制的要求。壳聚糖絮凝法的除杂率为16.08%,多糖保留率为88.42%,综合评分为66.72,符合粗多糖精制的要求。综上所述壳聚糖絮凝法对粗多糖的除杂精制比普通醇沉法的效果明显,不仅除去了杂质,而且尽可能多保留多糖。

表10 不同精制方法的比较Table 10 Comparison of different purification methods
3 结论
壳聚糖絮凝方法的最适宜絮凝条件是:m(黄精)∶V(水提液)为4∶10(g∶mL),,絮凝剂的用量为药液体积的15%,絮凝的pH值为4,絮凝温度40 ℃,絮凝3 h。用壳聚糖絮凝法进行精制的多糖的保留率为88.42%,除杂率为16.08%,综合评分较高,为66.72%,比普通的醇沉法好,符合粗多糖精制的要求,且稳定性较好。壳聚糖絮凝法可以较好的对黄精水提液进行除杂、精制,有利于黄精有效成分在中药制剂中的应用。
参考文献:
[1]陈存武,张莉,王玉领,等.黄精多糖提取液的活性炭脱色研究[J].中国林副特产,2008,(3):1-3
[2]孙秀梅,张兆旺,郭婕.黄精不同炮制品半仿生提取液与水提取液成分的比较[J].中草药,2007,38(11):1 648-1 651
[3]何丽君,陈豪,林雄,等.壳聚糖对三草汤的絮凝工艺研究[J].海峡药学,2010,22(8):54-55
[4]张忠国,康勇,冯颖,等.絮凝技术在中药提纯中的应用[J].化学工业与工程,2003,20(6):377-386
[5]商常发,李庆林,何领.壳聚糖絮凝法在澄清中药水提液中的应用[J].中国中医药科技,2006,13(5):365-366
[6]谢红旗,刘东波,肖深根,等.壳聚糖絮凝纯化香菇多糖的研究[J].天然产物研究与开发,2010,22:78-79
[7]ZHANG T,ZHENG C,TAO J,etal.Study on the technical of preparation radix Puerarin flova by water extraction chitosan clarification and purification with macroporous resin[J].Lishizhen Medicine and Materiamedica Research,2008,19:1 324-1 325
