鼻咽癌细胞株中EGFR的表达及吉非替尼联合放射照射的生物效应评估
2012-04-03朱蕙君王仁生
朱蕙君 王仁生
鼻咽癌(nasopharyngeal carcinoma,NPC)是中国常见的恶性肿瘤之一,局部区域复发和远处转移仍是鼻咽癌治疗失败的两大主因。5年累积复发率和远处转移率分别为18%~30%和15%~25%[1]。表皮生长因子受体(epidermal Growth Factor Receptor,EGFR)在肺癌、乳腺癌、肠癌及头颈部肿瘤中的过度表达及突变而引起下游的MARK和PI3K通路的持续活化是导致肿瘤细胞增殖、凋亡抑制并促进肿瘤浸润转移的关键机制[2]。近年研究证实,80%~90%的鼻咽癌组织中存在EGFR过度表达,其过度表达在临床上与预后差、转移快、对化疗药物抗拒相关[3]。近年来,以EGFR为靶点的低分子抑制剂吉非替尼(gefitinib)的分子靶向治疗方法,已证实在非小细胞肺癌等肿瘤治疗中应用并取得良好的疗效,但在鼻咽癌中的研究尚处起步[4]。本文通过观察吉非替尼结合放射照射对CNE1和HONE1细胞的干预作用,旨在探讨EGFR的表达对鼻咽癌的联合治疗效果的影响及其作用机制。
材料与方法
1.细胞系:人鼻咽癌细胞株CNE1及HONEl为广西医科大学耳鼻喉科实验室保存,用含10%FBS、100U/m l青霉素和100mmol/L链霉素的RPMIl640培养液培养液在常规37℃、5%CO2条件下培养箱内培养至对数生长期。
2.试剂:吉非替尼溶解于二甲基亚砜(DMSO)中,一次抗体EGFR兔多克隆抗体(Santa cruz公司),免疫荧光二次抗体羊抗兔IgG(Invitrogen公司);细胞增殖、细胞毒性检测试剂(Cell Counting Kit-8)CCK-8,结晶紫(crystal violet)。
3.方法:(1)免疫荧光测定EGFR表达:取对数生长的CNE1细胞和HONE1细胞接种于3.5mm盘内,24h后光学显微镜下确定细胞生长状态。采用4%多聚甲醛固定15min后,PBS漂洗3次后,Triton-100进行通透,5%BSA封闭后,分别加入一抗及二抗孵育1h后,PBS漂洗3次后,荧光显微镜下观察。采用Image J系统处理图像。(2)细胞分组及药物处理:取对数生长期鼻咽癌CNE1和HONEl细胞进行随机分组(对照组,吉非替尼组,单纯照射组及药物照射组),吉非替尼组的药物浓度为0、0.1、1、5、10μmol/L。单纯照射组的放射剂量为 0、2、4、6、8Gy。药物照射组,在 30min前先投入0.1μmol/L的吉非替尼。(3)细胞活性测定:取对数生长的CNE1细胞和HONE1细胞接种于96孔,每孔接种2×103个细胞,37℃、5%CO2条件下培养24h后,分别按分组给予不同浓度的吉非替尼及剂量的放射线照射。治疗后持续培养5~7天。加入10μl CCK-8孵育2h后,在分光光度计下测量其分光光度值。根据公式:细胞存活率(%)=[(阳性组吸光度-空白组吸光度)/(阴性组吸光度 -空白组吸光度)]×100%,计算出细胞存活率。(4)克隆形成实验:以1000个细胞的密度接种在6mm内,分单纯照射组和药物照射组,24h后进行照射。在37℃恒温CO2培养箱中培养14天,吸静培养液,PBS漂洗1次,10%甲醛固定20min,0.5%的结晶紫染色后,在显微镜下观测并计数细胞的克隆数(含有≥50个细胞的集落)。根据公式:贴壁率(plating efficiency,PE)=对照组集落数(0Gy集落数)/细胞接种数×100%;存活分数(surviving fraction,SF)=某剂量照射后形成的集落数/(该剂量下接种细胞数×PE)。(5)多靶单击模型计算放射增敏比:按多靶单击数学模型S=1-(1-e-D/D0)N拟合细胞存活曲线。S指存活分数,D为照射剂量,D0是在剂量效应曲线的直线部分S每下降63% 所需的剂量,N代表直线部分外延至Y轴的截距(称外推值),e为自然对数的底。Do反映细胞在相对高剂量区对射线的敏感性,Do值愈大,细胞对放射愈抗拒。Dq值代表存活曲线的“肩宽”,表示从开始到细胞呈指数性死亡所浪费的剂量,Dq值小,表明细胞亚致死性损伤修复能力弱,很小的剂量就能使细胞进入致死性损伤的指数性死亡阶段。增敏比(SER):联合治疗组Do/放射组Do。
4.统计学方法:采用SPSS 16.0软件包进行统计学处理。数据值采用均数±标准差±s),采用t检验比较各组差别,P<0.05提示差异有统计学意义。
结果
1.免疫荧光对EGFR表达的测定:在荧光显微镜放大40倍下观测可见,CNE1细胞和HONE1细胞膜和细胞质内均可见较强的绿色荧光。显示EGFR在两种细胞内均有较强表达(图1)。

图1 免疫荧光检测EGFR的表达(×40)
2.吉非替尼对细胞生长的抑制:单纯使用吉非替尼抑制细胞生长的体外实验表明,随着吉非替尼浓度的增长,细胞存活下降。但只有在较高浓度下,吉非替尼才明显抑制鼻咽癌细胞生长。而在较低浓度时,虽可抑制其生长但作用不明显(图2)。

图2 吉非替尼对细胞生长的抑制
3.单纯照射和药物照射对细胞生长的抑制: CNE1细胞株和HONE1细胞株的体外实验中均可见单纯照射组中,随着照射量的增长,细胞的生长受到明显抑制。而药物照射组表明,联合使用吉非替尼可更进一步抑制细胞生长。在低照射剂量下与单纯照射组相比细胞生存率有显著差异(表1、图3、图4)。
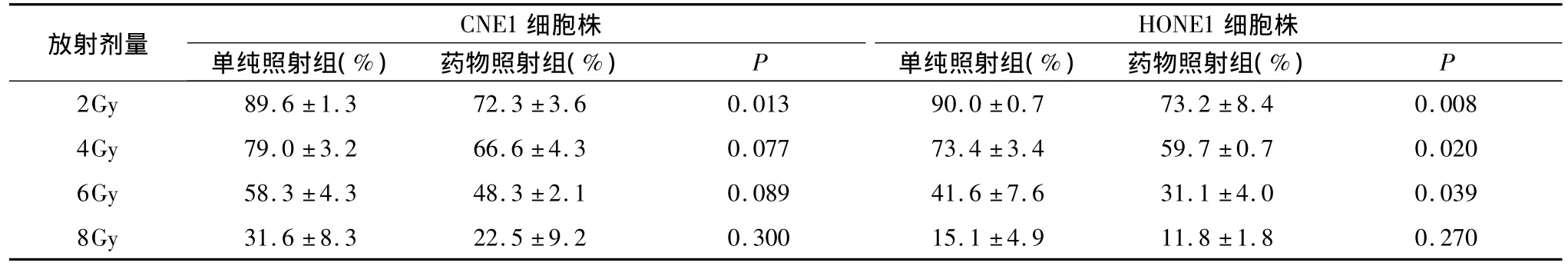
表1 单纯照射组和药物照射组细胞的存活率

图3 单纯照射及药物照射对CNE1细胞生长的抑制

图4 单纯照射及药物照射对HONE1细胞生长的抑制
3.存活曲线的绘制及SER值的计算:使用Sigmaplot软件绘制存活曲线见图5,拟合方程得出: CNE1细胞株单纯照射组细胞存活曲线的 Do为2.069Gy,Dq为3.99Gy,药物照射组Do为1.67Gy, Dq为2.49Gy,放射增敏比(SER)为1.23。HONE1细胞株照射组Do为2.0Gy,Dq为3.59Gy,药物照射组Do为1.490Gy,Dq为2.71Gy,SER为1.35。

图5 单纯照射组和药物照射组的细胞存活曲线
讨论
80%~96%的头颈部肿瘤中存在EGFR的过度表达及突变,EGFR作为头颈部肿瘤的诊断和预后的标志物成为研究的重要靶点。Ma等[5]的研究表明,在鼻咽癌组织中,EGFR阳性表达率为94%,强阳性表达率为50%。EGFR表达与鼻咽癌的原发灶分期相关,EGFR强阳性表达患者总生存率和无瘤生存率均较差。针对EGFR的分子靶向治疗方法备受关注,吉非替尼可抑制EGFR受体的酪氨酸激酶的自身磷酸化,抑制下游分子水平和通路活化。从而控制细胞增殖和诱导凋亡。在肺癌,乳腺癌,肠癌中已取得一定疗效,而对鼻咽癌的治疗效果报道结论不一[6,7]。临床治疗及研究旨在应用分子靶向治疗结合放化疗等联合治疗方法,旨在提高鼻咽癌患者生存率。
本研究显示,CEN1细胞和HONE1细胞中均有较高EGFR表达。单纯使用吉非替尼抑制细胞生长表明,鼻咽癌细胞CNE1和HONE1细胞吉非替尼较不敏感细胞。此结果与Brigette等人的研究结果相近。由于EGFR及其下游通路与旁通路信号网络相互影响,单一的靶向治疗尚难达到理想的抑制效果[7]。而药物照射组较单纯照射组表明,联合吉非替尼能均可提高两种细胞株鼻咽癌细胞的抑制率。吉非替尼可能通过提高放射敏感性,与放射线照射对肿瘤细胞起协同抑制作用。拟合曲线表明吉非替尼使细胞存活曲线的Do值降低,直接增加细胞对放射线的敏感性;并且使细胞存活曲线的肩区变窄,Dq值变小,抑制细胞对放射线所致的潜在致死损伤的修复(potential damage repair,PLDR)和亚致死损伤的修复(sublethal damage repair,SLDR)。
研究表明,放射线照射联合EGFR抑制剂在体外体内实验均证明可对肿瘤细胞有直接杀伤作用,提高肿瘤的局部控制[8]。多数研究证明吉非替尼竞争性抑制EGFR下游MARK和PI3K通道,而诱发G0/G1期阻滞的现象,从而导致细胞凋亡增加。最近研究表明,除了G1期阻滞外,联合治疗还可以延长G2期,减少放射抵抗的S期从而增强细胞的放射敏感性[9,10]。
PLDR是造成放射治疗失败的主要原因,PLDR与DNA双链断裂修复(DNA double strand break repair,DSB repair)相关[11]。放射线照射后初期野生型EGFR(wild type EGFR)由细胞膜向细胞核内的转移进而偶联生成DNA修复酶(DNA-repair enzyme)是照成放射抵抗的重要机制[12]。DNA-PKcs蛋白在DNA双链断裂修复中起着重要作用,是一种与放射敏感性密切相关的修复蛋白。EGFR通过下游PI3K-AKT通道刺激DNA-PKcs活化,高EGFR的表达和活化也伴随着DNA-PKcs的增加。而这一过程可有效地被EGFR抑制剂所抑制。另外,EGFR还被证实影响另外一种DSB修复的关键蛋白Ku70/ Ku80。实体瘤内细胞存在对射线和化疗药物有抗性的乏氧状态是肿瘤复发、治疗失败的主要原因。PET动态连续观察表明,EGFR抑制剂还可以改善细胞的含氧量而增强放射敏感性。
综上所述,本研究结果初步显示吉非替尼联合放射照射对鼻咽癌细胞的生长有显著抑制作用,并研讨其放射增敏机制。为分子靶向治疗联合放疗的综合治疗提供实验依据。
1 高黎,易俊林,黄晓东.鼻咽癌根治性放疗10年经验总结[J].中华放射肿瘤学杂志,2006,4:249-256
2 Lurje G,Lenz HJ.EGFR signaling and drug discovery[J].Oncology.2009,77:400-410
3 王树森,管忠震,向燕群,等.鼻咽癌组织中EGFR和p-ERK蛋白表达的检测及意义[J].中华肿瘤杂志,2006,328:(1)28-31
4 Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of nonsmall-cell lung cancer to gefitinib[J].New England JournalofMedicine,2004,350(21):2129-2139
5 Ma B,Poon T,To KF,et al.Prognostic significance of tumorangiogenesis,KI67,p53 oncoprotein,epidermal growth factor receptor and HER2 receptor protein expression in undifferentiated nasopharyngeal carcinoma:a prospective study[J].Head Neck,2003,25:864-872
6 Takeuchi K,Ito F.Receptor tyrosine kinases and targeted cancer therapeutics[J].Biol Pharm Bull,2011,34(12):1774-1780
7 Ma BB,Lui VW,Poon FF,et al.Preclinical activity of gefitinib in non-keratinizing nasopharyngeal carcinoma cell lines and biomarkers of response[J].Invest New Drugs,2010,28(3):326-333
8 Bonner JA,Harari PM,Giralt J,et al.Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck[J].N Engl JMed,2006,354:567-578
9 Chinnaiyan P,Huang S,Vallabhaneni G,et al.Mechanisms of enhanced radiation response following epidermal growth factor receptor signaling inhibition by erlotinib(Tarceva)[J].Cancer Res,2005,65: 3328-3335
10 Huang SM,Harari PM.Modulation of radiation response after epidermal growth factor receptor blockade in squamous cell carcinomas:inhibition of damage repair,cell cycle kinetics,and tumor angiogenesis[J].Clin Cancer Res,2000,6:2166-2174
11 Wilson KM,Keng PC.Radiation-induced DNA damage and repair in quiescentand proliferating human tumor cells in vitro[J].Int JRadiat Biol.1989,55(3):385-395
12 Chen DJ,Nirodi CS.The epidermal growth factor receptor:a role in repair of radiation-induced DNA damage[J].Clin Cancer Res,2007,13(22 Pt1):6555-6560
