有机化学中共振论的应用
2012-04-01刘显明
刘显明
(南京理工大学泰州科技学院化工学院,江苏 泰州 225300)
价键理论(电子配对理论)强调的是电子运动的局部性,即电子在分子中的运动只与2个成键原子有关,但是该理论在解释具有共轭体系的化合物的结构式时遇到了瓶颈[1]。为了更好地描述化合物的性质和结构之间的关系,美国化学家鲍林(L.Pauling)于1931年提出共振论,随后共振论在化学界特别是在有机化学界得到广泛应用[2]。建立在鲍利经验共振论基础上的现代结构共振论与价键理论、分子轨道理论一样在有机化学中得到广泛的应用。
只有正确理解共振论,正确书写共振结构式,才能够合理用共振论观点解释物质的物理性质和化学性质,以下讨论书写共振结构式的规则及该理论在有机化学中的应用。
1 共振论简介
1.1 基本概念
共振论是指当一个分子、离子或自由基的真实结构按电子配对理论不能用经典结构式中的任何一个来表示时,要用若干经典结构式的共振来描述分子的真实结构,即真实的结构就是这些极限结构式的共振杂化体[3]。例如:

图1 烯醇负离子的两种不等价共振式
实际上,负电荷平均分布在2个碳原子和1个氧原子上,这种现象称为“电子离域”。电子发生离域后,体系的能量会降低,这将会影响到离子的反应活性。就本例而言,图1中所示带负电荷的氧原子和碳原子上都可以与亲电试剂发生反应,并且这是酮类化合物通过烷基化反应增长碳链的重要方法;但一般发生的是C- 烷基化,很少发生O- 烷基化,因为氧原子是质子化的典型,容易形成烯醇转化为原来的酮[4]。
1.2 共振结构式的书写规则
(1)正确写出路易斯结构式;
(2)各共振式用双箭头连接起来,所有的共振式用方括号括起来;
(3)分子的各原子核的位置保持不变,仅通过电子对的转移实现互变;
(4)用弯曲箭头表示电子对的移动。
例如:亚硝酸根离子的(等价)共振式,可以根据上述原则很容易写出来。

1.3 等价与不等价共振式
正确理解和书写共振式对预测反应性至关重要,如前所举的例子:烯醇负离子各八电子稳定共振式有2种,而且是不等价的;而亚硝酸根离子各八电子稳定共振式有2种且是等价的。亚硝酸根离子中的任何一个氧原子都可以接受H+而转化为亚硝酸。
1.4 共振式对真实结构的贡献
我们可以根据以下原则作为判断依据[5]:
(1)拥有最多八电子结构的共振式是最重要的;
(2)电荷应该处于和其电负性一致的原子上;
(3)拥有较少相反电荷分离的结构更重要;
(4)电荷分离的共振式稳定性降低。
例如:氰酸根CNO-有2种共振式:

同为八电子结构的共振式,左边的结构更有利(贡献更大),因为电子分布更平均而且负电荷在电负性大的氧原子上。
如果把不等价共振式扩展到某些不具有八电子稳定结构的原子时,问题更为普遍。例如,亚硝酰阳离子:
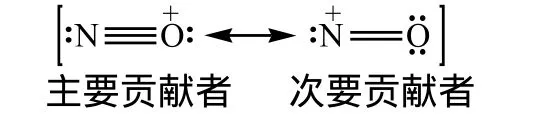
上面提到烯醇负离子的例子,按照判断依据(A)的贡献更大,应该有较多的烯醇生成,但实际上更多是生成醛或酮而较少生成烯醇,这是因为烯醇不稳定易异构化为原来的羰基化合物的缘故。不能据此说明(B)比(A)对烯醇负离子的真实结构贡献更多。因此通过共振式的贡献大小来预测反应性需要综合考虑。
2 有机化学中共振论的应用
2.1 化学性质方面
(1)解释有机物的酸碱性
①对硝基苯酚可发生解离,从而显酸性:
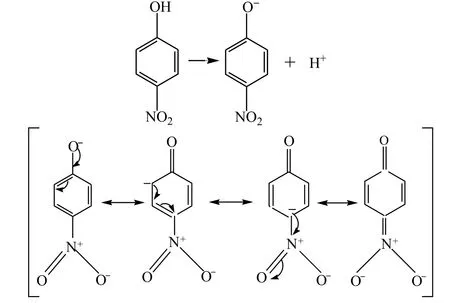
对硝基苯酚可以通过共振生成负电荷更分散也更稳定的硝基苯氧负离子,其酸性要强于间硝基苯酚。同样,我们也可以预测间三硝基苯酚的酸性会更强。
②RNH2是一个弱碱,而胍是一个强碱:
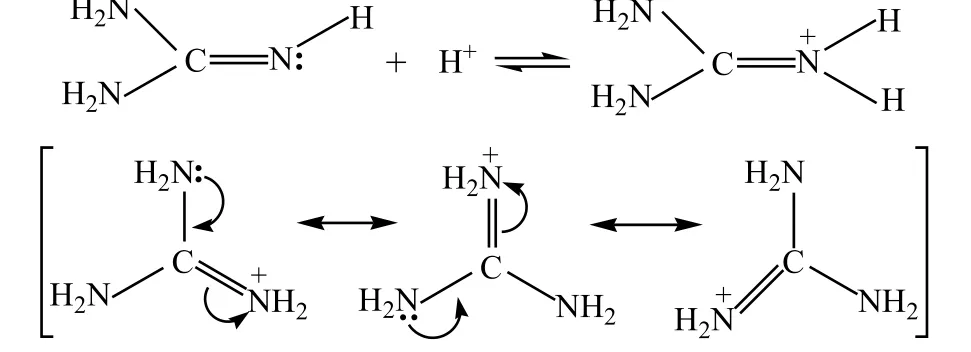
亚胺基上的孤电子对更难给出,但与质子(Lewis酸)结合后,所得到的共轭酸因共振而稳定。
(2)预测反应的主要产物
①三氟甲苯与亲电试剂反应主要得到间位取代产物,因为有如下共振:

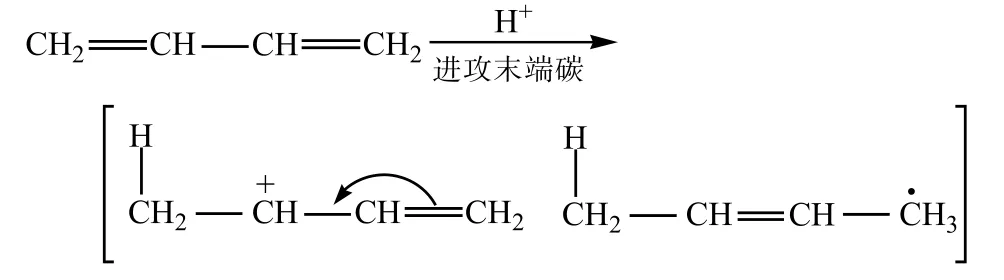
②1mol冷的溴化氢很容易加成到1,3- 丁二烯上,生成异构体产物:3- 溴 -1- 丁烯、1- 溴 -2- 丁烯,原因有如下共振:
(3)解释酸碱催化反应
腈的水解反应可用酸或碱作催化剂,因为腈存在下面的共振:

对(B)而言,碳正离子可以与碱作用,而氮负离子可以和酸作用,因此可以用酸或碱催化。
2.2 物理性质方面
(1)沸点
环丙烯酮常压下的沸点约为106.2℃,而丙酮在常压下的沸点约为56.1℃。因为环丙烯酮属于芳香族化合物,电子发生离域并且具有稳定的偶极共振式,是较强的极性分子,分子间作用力强:
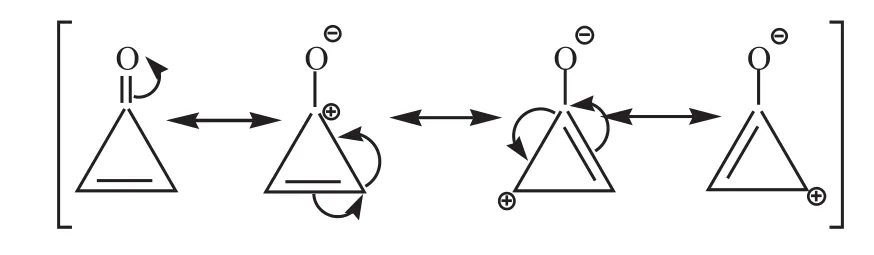
而丙酮则不存在共振式,极性相对较弱,导致分子间作用力相对较弱,沸点偏低。
(2)偶极矩
最典型的是具有苯环共振结构的有机物,如氯乙烷,μ=2.05D,氯苯,μ=1.54D,因为氯苯存在以下共振:

(3)键长
乙酸根负离子2个碳氧键的键长均为0.127nm,因为它是由2个等价的极限共振式参与共振所得到的杂化体:
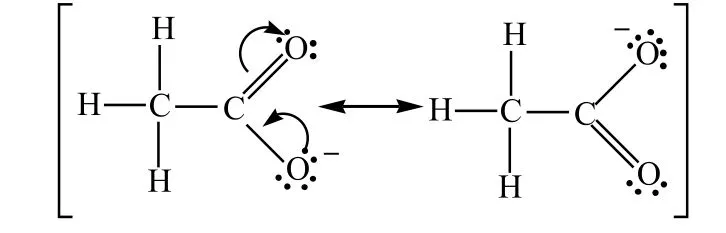
同样,用共振论可以解释碳酸根离子的3个碳氧键键长相同,烯丙基正离子的两端碳原子都可以和羟基反应得到相应的醇。
(4)分子伸缩振动频率
根据胡克定律,伸缩振动频率与键力常数成正比。键长越短,键力常数越大。N,N- 二甲基甲酰胺分子中羰基的伸缩振动频率(1650cm-1)比丙酮的低(1715cm-1)[6]。因为N,N- 二甲基甲酰胺存在如下共振结构:
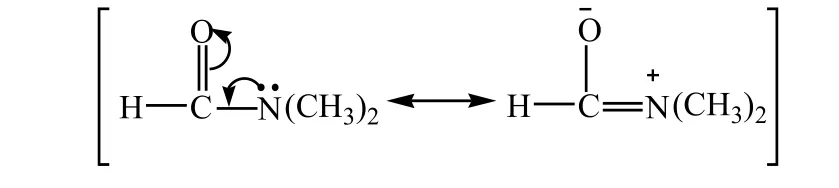
由于存在共振的贡献,碳氧单键键长变长,键能降低,故键力常数下降,伸缩振动频率变低。
3 结论
通过简述共振论的基本知识及正确的书写方法,可以更好地认识有机化合物的某些物理性质和化学性质,从而加深对有机化学的理解。上述例子只是共振论在有机化学中的部分应用,其最大优点是简明、直观、易于理解,但也存在一定程度的局限性和不足。随着现代共振论的不断发展,它在有机化学中的应用将会越来越广泛。
[1] 邢其毅,裴伟伟,徐瑞秋, 裴坚.基础有机化学(第3版)[M].北京:高等教育出版社,2005.
[2] 田瑞亭.共振论在有机化学中的应用[J].山东教育学院学报,2001,(4):58.
[3] 邢其毅,等.共振论的回顾与瞻望[M].北京:北京大学出版社,1982.
[4] [美] K.彼得 C. 福尔哈特,尼尔 E. 肖儿.戴立信,席振峰,王梅祥,等,译.有机化学结构与功能(原著第4版)[M].北京:化学工业出版社,2006.
[5] 李青仁,于广莹.共振论在化学中的应用[J].吉林师范大学学报(自然科学版), 2005,(1):72-73.
[6] 马纪伟,闫冬良.共振论在有机化学中的应用[J].卫生职业教育,2007,19(5):76-77.
