白木通籽分离蛋白酶法改性及功能性质研究
2012-03-20杜研学胡居吾钟红兰
史 卿 杜研学 熊 华 赵 强 胡居吾 钟红兰 阮 霞
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
白 木 通(Akebia trifoliate(Thunb.)Koidz.var.australis(Diels)Rehd)属木通科木通属植物。据《中国药典》2005版一部记载,其干燥茎藤入药可作木通用,味苦,性寒,具利尿,活血通脉,抗菌消炎之功效[1]。江西省科技人员通过采集白木通野生藤,经过多年驯化种植,已经培育出高产油、高结果率的新白木通果,平均产量可达22.5t/hm2,最高产量可达45t/hm2。通过对白木通籽和果皮基本组成进行成分分析,表明白木通是非常有价值的资源,可开发利用[2]。大量研究[3-5]表明,经Alcalase酶修饰处理过的蛋白拥有比原蛋白更优的营养或功能性质,所以Alcalase酶已被广泛应用制备蛋白酶解物。由于白木通籽分离蛋白的溶解性等性质在中性环境中较差,本试验拟采用Alcalase酶对其进行改性,并考察水解度对其功能性质的影响,旨为其应用于工业化生产提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
白木通籽分离蛋白:蛋白纯度86.63%,实验室自制;
Alcalase酶:丹麦诺维信公司;
叠氮钠、十二烷基硫酸钠、磷酸二氢钠、磷酸氢二钠、氯化钠、盐酸、氢氧化钠等:均为分析纯,市售。
1.2 仪器与设备
高速匀浆机:FSH-II,江苏环宇科学仪器厂;
氨基酸自动分析仪:L8800,日本日立公司;
差示扫描量热仪:PYRIS DIAMOND,美国PE公司;
紫外分光光度计:新世纪T6,北京普析通用仪器有限公司;
冷冻干燥机:FD-1,北京神泰伟业仪器设备有限公司。
1.3 试验方法
1.3.1 酶解物的制备 参照文献[6],略作修改。将10g白木通籽分离蛋白粉末分散在200mL 蒸馏水中,水浴升温至55 ℃,并用0.5mol/L氢氧化钠调节pH 至8.0。按照酶/蛋白底物4∶100的比例加入Alcalase酶开始水解,反应过程中通过加入0.5mol/L氢氧化钠维持溶液pH 8.0。反应一定时间后,将烧杯置于90 ℃水浴中灭酶10min,离心(5 000×g,20min)取上清液冷冻干燥得到各种水解度的酶解产物。
1.3.2 水解度的测定 采用pH-stat法[7]。
1.3.3 氨基酸组成 称取白木通分离蛋白及其酶解物各0.25g,将样品置于水解管中,加入含有10 mmol/L 多酚的6mol/L盐酸溶液,真空封口。在110 ℃下水解24h,冷却后定容、过滤并蒸干,采用氨基酸自动分析仪测定蛋白质的氨基酸含量。氨基酸含量以g/100g 蛋白表示。
1.3.4 示差扫描量热测定 采用差示扫描量热仪在20~200 ℃对样品进行扫描,测定各酶解物的热变性温度。
1.3.5 溶解性 将蛋白样品溶于蒸馏水中,配制成质量分数为1%的蛋白溶液,于磁力搅拌器上搅拌30min使其充分分散,再用0.5mol/L盐酸或0.5mol/L氢氧化钠将溶液pH分别调至3.0~9.0,25℃继续搅拌溶解30min后5 000×g离心15min。以牛血清蛋白为标准蛋白,用Lowry法[8]测定上清液中蛋白质的含量。溶解度按式(1)计算。

式中:
NSI—— 溶解度,%;
m—— 上清液中蛋白质的质量,g;
M—— 样品中蛋白质的质量,g。
1.3.6 乳化性与乳化稳定性 参照文献[9],略作修改。称取蛋白样品溶解于蒸馏水中,配成蛋白质量分数为0.1%的溶液。用0.5mol/L盐酸或0.5mol/L氢氧化钠调pH 值至2.0~9.0。常温下磁力搅拌30min后,取9mL 不同pH 值条件下蛋白溶液与3 mL 大豆油混合,放入50 mL 离心管中。在高速匀浆机作用下乳化60s(15 000r/min),迅速取50μL的乳化液与5mL,0.1%的SDS混合,在500nm 处测定吸光值,用0.1%的SDS 做空白对照。以乳化活力指数(emulsification activity index,EAI)表示蛋白乳化活性。乳化活力指数按式(2)计算。
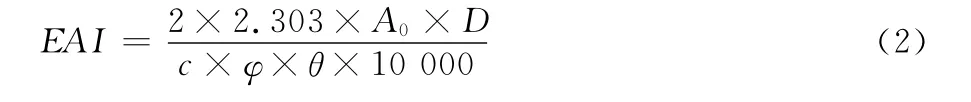
式中:
EAI—— 乳化活力指数,m2/g;
A0——0min时取样测定的吸光值;
D—— 稀释倍数;
c—— 乳化液形成前蛋白浓度,g/mL;
φ—— 光学路程,cm;
θ—— 乳化液中油的体积分数,L/L;
乳化稳定性用乳化稳定指数(emulsifying stability index,ESI)表示。乳化稳定指数按式(3)计算。

式中:
ESI—— 乳化稳定指数,min;
Δt—— 静置时间,10min;
A0——0min时取样测定的吸光值;
A10—— 静置10min后测定的吸光值。
1.3.7 起泡性与起泡稳定性 参照文献[10]以不同pH 值(3.0,5.0,7.0,9.0)的磷酸缓冲溶液配制20mL 质量浓度为1% 的蛋白溶液,用高速分散匀浆机以15 000r/min均质1min,迅速记录泡沫所占的体积;室温下静置30min后,再次记录泡沫的残余体积,分别按式(4)、(5)计算起泡性和起泡稳定性:

式中:
FC—— 起泡性,%;
FS—— 起泡稳定性,%;
V1—— 均质后记录的泡沫体积,mL;
V2—— 静置30min后记录的泡沫体积,mL;
V0—— 蛋白溶液的体积,即20mL。
2 结果与分析
2.1 酶解过程水解度的变化
采用pH-stat法测定水解300min过程中白木通籽分离蛋白水解度变化情况,结果见图1。
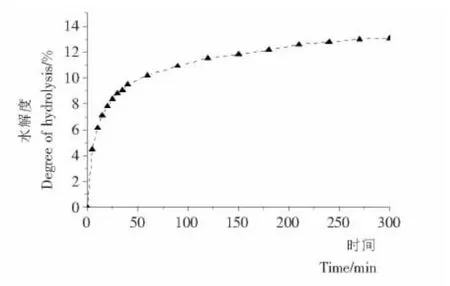
图1 酶解过程中分离蛋白水解度随时间变化情况Figure 1 Degree of hydrolysis of API treated with Alcalase 2.4Las influenced by time
由图1可知,水解度随着反应时间的增加而增加,说明随着酶解的进行,多肽片段慢慢被释放出来。酶解5 min后,水解度达4.48%,反应30min后,水解度可达8.9%。在刚开始的40min内,水解速率快速上升,而后缓慢释放出多肽片段。反应进行到200 min后,反应速度几乎没有变化。水解度的这种变化趋势,与用Alcalase酶处理小麦分离蛋白时水解度的变化趋势十分相似[11]。本试验为研究限制性酶解对分离蛋白理化性质的影响,选用水解时间为10,30,240min即水解度分别为6.1%,8.9%,12.8%的酶解产物进行分析研究。
2.2 氨基酸组成
表1是分离蛋白和经过不同时间酶解后的酶解物的氨基酸组成结果。经限制性酶解后,不同水解度的酶解产物的氨基酸组成差别不大。另一方面,白木通籽分离蛋白在不同时间段生成的酶解物的氨基酸组成模式能够探讨分析它们的抗氧化活性及其相关机制。表1 显示,分离蛋白经酶解后,疏水性氨基酸总量在不同水解度(6.1%,8.9%,12.8%)中均显著提高,分别为42.11%,42.03%,41.69%。酶解物中的单个氨基酸可能参与到抗氧化过程中来。据报道[12],赖氨酸、甲硫氨酸、组氨酸、酪氨酸和色氨酸这几种氨基酸在酶解物中对抗氧化活性有显著的贡献作用。而与甲硫氨酸、半胱氨酸、甘氨酸和缬氨酸相比,色氨酸和组氨酸的抗氧化能力更强[13]。组氨酸和含组氨酸的多肽的抗氧化活性归因于其咪唑环的螯合和脂质自由基猝灭作用,而多肽中的酪氨酸残基可能会充当氢供体的角色[14,15]。一般而言,因为芳香族氨基酸较易贡献质子给电子缺乏的原子团,所以被认为是有效的自由基清除剂。由结果可知,赖氨酸、甲硫氨酸、组氨酸和酪氨酸含量经酶解后均有所增加,说明白木通籽分离蛋白经Alcalase酶解后的抗氧化活性将会增强。
2.3 热学性质
热变性温度(Td)是衡量一种物质热稳定性的重要参数,较高的热变性温度意味着该物质拥有较强的热稳定性,在加工过程中能够耐受较高的温度[16]。
采用示差扫描量热测定白木通籽分离蛋白及其酶解物的热变性温度,结果见图2。分离蛋白和它的酶解物拥有不同的热转变曲线。分离蛋白呈现一个典型的吸热峰,变性温度为91 ℃左右。与分离蛋白相比,在各酶解产物中,可见较高的变性温度,酶解的大豆蛋白的变性温度也会出现同样的变化趋势。随着水解度从6.1% 增加到8.9% 或12.8%,主要吸热峰的变性温度从92.4 ℃上升到97.6~98.4 ℃。
同时,随着水解度从0 到12.8%,分离蛋白的热焓值(△H)显著降低(P<0.05)。热焓值体现了一种蛋白有序结构的程度[17],因此,随着酶解的进行,分离蛋白的有序结构程度将会逐渐降低。
2.4 溶解性
分离蛋白及其酶解物在pH 3.0~9.0范围内的溶解性见图3。分离蛋白在pH 4.0~6.0时溶解度很低,pH 9.0处呈现较高的溶解性,达80.12%。然而,经酶解后,分离蛋白在pH 4.0~6.0范围内得到显著提高,并且溶解度随着水解度的升高而升高。在低水解度(6.1%)时,其溶解度从2.2%~15.2%相应增加到30.5%~55.9%。当水解度达12.8%时,在所有测定的pH 值范围内,78%以上的蛋白都是可溶的。在pH 7.0处,水解度为0,6.1%,8.9%,12.8%的蛋白相对应的溶解度分别为35.8%,75.1%,82.1%,90.7%。溶解度提高的原因在于蛋白质或多肽等酶解后,产生的寡肽拥有更强的极性,能够形成强亲水键与水相互作用而呈现较高的溶解性[18]。
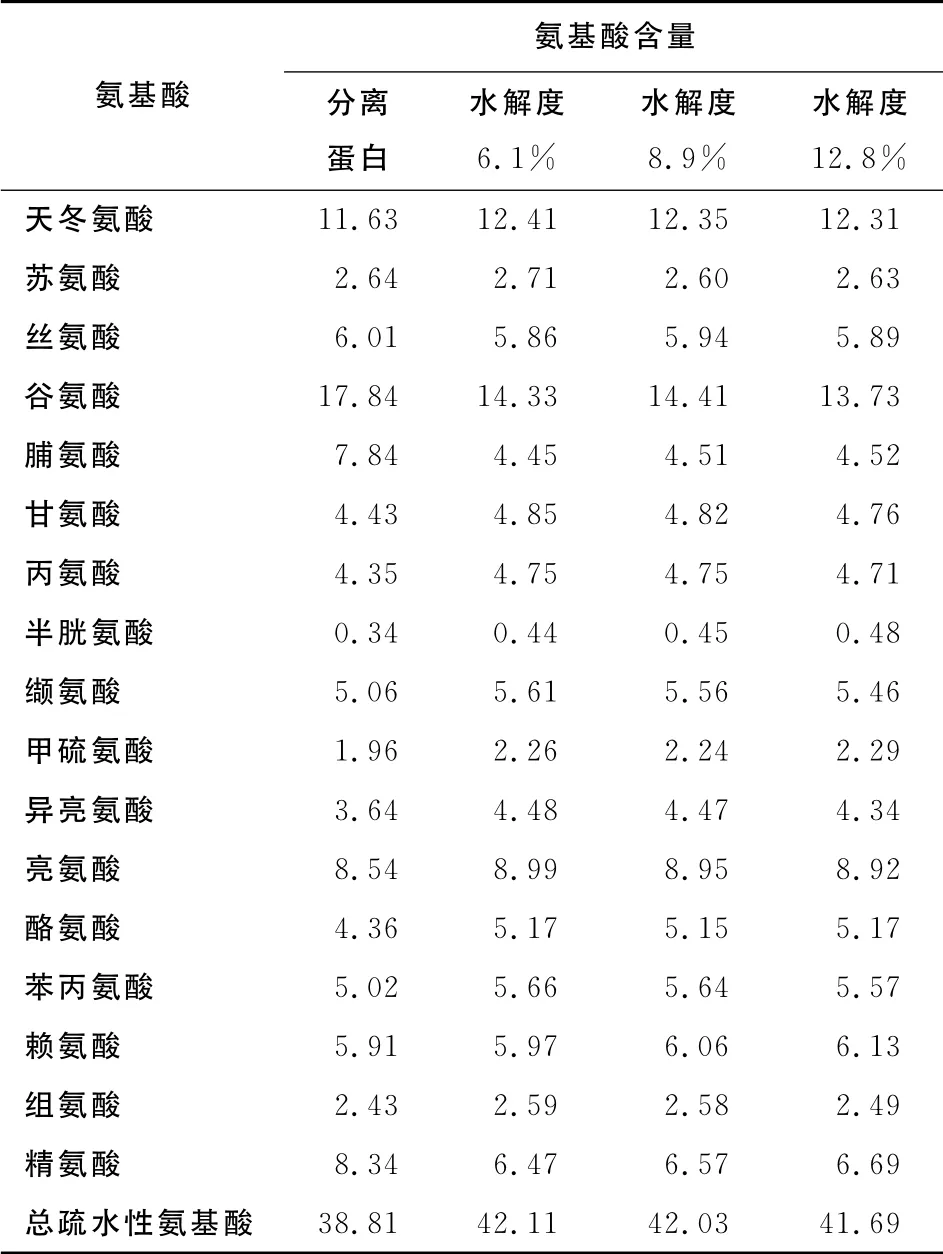
表1 分离蛋白及其酶解物的氨基酸组成Table 1 Amino acid composition of API and its hydrolysates(n=3)
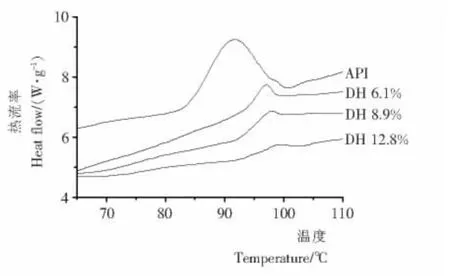
图2 分离蛋白及其酶解物的DSC图谱Figure 2 Differential scanning calorimetry(DSC)of API and its hydrolysates
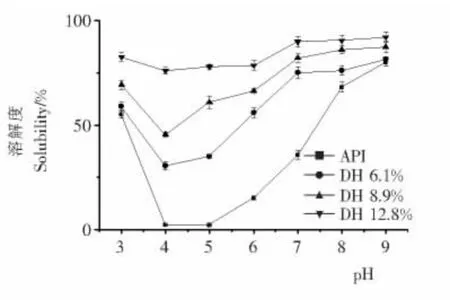
图3 分离蛋白及其酶解物溶解性随pH 变化情况Figure 3 Solubility of API and its hydrolysates as influenced by pH
2.5 乳化性与乳化稳定性
由图4和5可知,分离蛋白经不同程度的水解后,各酶解物乳化活性和乳化稳定性在所有pH 范围内均得到显著提高,并且各水解度酶解物乳化活性和乳化稳定性随pH 值变化趋势一致。然而,过度酶解(大于10min)后,酶解物乳化活性和乳化稳定性随着水解度的增加反而逐渐降低(P<0.05)。此结果表明,过度的水解对于蛋白乳化性能的改善是不利的。乳化性能的高低取决于蛋白质两亲性能的强弱,以上现象可能是酶解产生的低分子量肽的两亲性降低导致的结果。李玉珍等[19]同样也发现过度酶解能够导致蛋白的乳化活性大大地降低。虽然小肽能够迅速地扩散到油水界面,但是电荷排斥导致小肽很难凝聚形成厚的球状薄膜,从而导致它们稳定乳液的效率低下[20]。从已有文献[21,22]来看,有大量过度酶解导致蛋白乳化性能降低的报道。
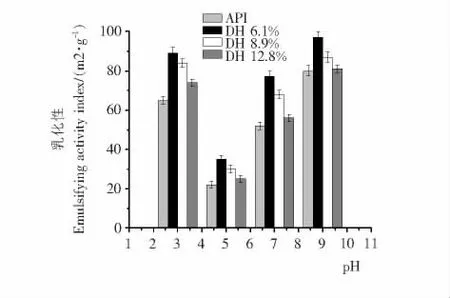
图4 分离蛋白及其酶解物的乳化活性指数随pH 变化的情况Figure 4 Emulsifying activity index(EAI)of API and its hydrolysates as influenced by pH
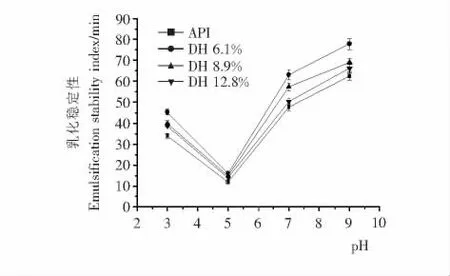
图5 分离蛋白及其酶解物的乳化稳定性指数随pH 变化的情况Figure 5 Emulsification stability index(ESI)of API and its hydrolysates as influenced by pH
2.6 起泡性与起泡稳定性
分散到溶液中的蛋白质能够降低水与空气界面的表面张力,从而产生泡沫[23]。分离蛋白及其酶解物在不同pH 值(3.0,5.0,7.0,9.0)条件下的起泡性质结果见图6。在试验pH 值范围内,各酶解物的起泡性能比之分离蛋白相对提高,但随着水解度的增加,起泡性和起泡稳定性略有降低。一般而言,分子量越大,蛋白或多肽起泡稳定性能越好,结果表明高分子量多肽或部分水解的蛋白在空气与水界面能够保持优良的薄膜内聚性,与之前Kong等[24]报道的结果一致。另外,从结果来看,分散介质的pH 值能够极大地影响酶解物的起泡性能,特别是起泡稳定性(图7)。在pH 5.0处,由于接近它们的等电点,溶解性低,故起泡与起泡稳定性最差。
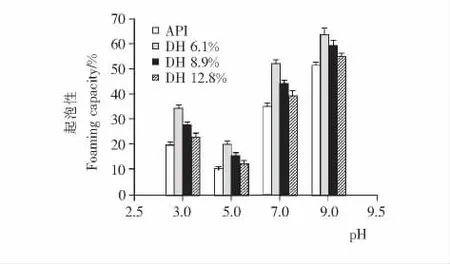
图6 分离蛋白及其酶解物起泡性能随pH 变化的情况Figure 6 Foaming capacity of API and its hydrolysates as influenced by pH
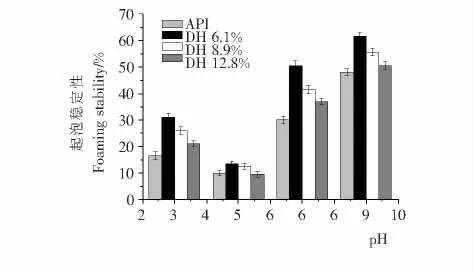
图7 分离蛋白及其酶解物起泡稳定性能随pH 变化的情况Figure 7 Foaming stability of API and its hydrolysates as influenced by pH
3 结论
本试验以白木通籽分离蛋白为原料,利用碱性蛋白酶,在温度55 ℃、底物浓度2%和pH 8.0条件下对白木通籽分离蛋白进行限制性酶解,探讨不同水解度对酶解产物功能性质的影响。氨基酸分析表明,分离蛋白经酶解后,疏水性氨基酸总量增加。具抗氧化活性的氨基酸残基相对含量均得到不同程度地提高,但是,不同水解度的酶解物的氨基酸组成模式比较接近。分离蛋白随酶解时间的增加,主要吸热峰的变性温度从92.4 ℃上升到97.6~98.4 ℃,而其热焓值反而显著降低,使得分离蛋白的有序结构分散开来。不同酶解物在所测pH 值范围内的溶解度均相应增加,并且溶解度随着水解度的升高而升高。说明分离蛋白经酶解后,产生的寡肽拥有更强的极性,能够形成强亲水键与水相互作用而呈现较高的溶解性。各水解度酶解物乳化和起泡性与pH 值变化趋势一致,同时,其乳化性能和起泡性能随着酶解的进行,均出现先增加后减少的趋势,但总体还是高于分离蛋白相对应值。说明过度的水解不利于白木通籽分离蛋白的乳化和起泡性能。
1 高慧敏,王智民.白木通中一个新的三萜皂甙类化合物[J].药学学报,2006,41(9):835~839.
2 Du Yanxue,Jiang Yan,Zhu Xuemei,et al.Physicochemical and functional properties of the protein isolate and major fractions prepared from Akebia trifoliata var.australis seed[J].Food Chemistry,2012,133(3):923~929.
3 Doucet D,Gauthier S F,Otter D E,et al.Enzyme-induced gelation of extensively hydrolyzed whey proteins by alcalase:Comparison with the plastein reaction and characterization of interactions[J].Journal of Agricultural and Food Chemistry,2003,51(20):6 036~6 042.
4 Klompong V,Benjakul S,Kantachote D,et al.Comparative study on antioxidative activity of yellow stripe trevally protein hydrolysate produced from alcalase and avourzyme[J].International Journal of Food Science and Technology,2008,43(6):1 019~1 026.
5 Pizones R V,Carrera S C,Yust M M,et al.Limited enzymatic hydrolysis can improve the interfacial and foaming characteristics of b-conglycin[J].Journal of Agricultural and Food Chemistry,2007,55(4):1 536~1 545.
6 Pownall T L,Udenigwe C C,Aluko R E.Amino acid composition and antioxidant properties of pea seed(Pisum sativum L.)enzymatic protein hydrolysate fractions[J].Journal of Agricultural and Food Chemistry,2010,58(8):4 712~4 718.
7 姚玉静,崔春,邱礼平,等.pH-stat法和早醛滴定法测定大豆蛋白水解度准确性比较[J].食品工业科技,2008,29(9):268~270.
8 焦利敏,廖学品,石碧.紫外分光光度法下直接测定蛋白质溶液的浓度[J].化学研究与应用,2007,19(5):562~566.
9 Zhao Guanli,Liu Yan,Zhao Mouming,et al.Enzymatic hydrolysis and their effects on conformational and functional properties of peanut protein isolate[J].Food Chemistry,2011,127(4):1 438~1 444.
10 Sze K W C,Sathe S K.Functional properties and in vitro digestibility of almond.(Prunus dulcis L.)protein isolate[J].Food Chemistry,2000,69(2):153~160.
11 Zhu Kexue,Zhou Huiming,Qian Haifeng.Antioxidant and free radical-scavenging activities of wheat germ protein hydrolysates(WGPH)prepared with alcalase[J].Process Biochemistry,2006,41(6):1 296~1 302.
12 任海伟,王常青.黑豆低聚肽的抗氧化活性评价及其氨基酸组成分析[J].食品与发酵工业,2009,35(9):46~50.
13 范远景,高海成,孟凡莉.抗氧化活性花生肽的氨基酸组成及质谱分析[J].食品科学,2011,32(13):32~36.
14 胡文琴,王恬.酪蛋白酶解物体外抗氧化作用的研究[J].食品科学,2004,25(4):158~162.
15 Je J Y,Park P J,Kim S K.Antioxidant activity of a peptide isolated from Alaska pollack (Theragra chalcogramma)frame protein hydrolysate[J].Food Research International,2005,38(1):45~50.
16 Tang C H,Sun X,Yin S W.Physicochemical,functional and structural properties of vicilin-rich protein isolates from three Phaseolus legumes:Effect of heat treatment[J].Food Hydrocolloids,2009,23(7):1 771~1 778.
17 朱建华,杨晓泉.大豆蛋白组分/葡聚糖复合体系相行为及热性质研究[J].中国粮油学报,2012,27(5):10~17.
18 Liu Qian,Kong Baohua,Xiong Youling,et al.Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J].Food Chemistry,2010,118(2):403~410.
19 李玉珍,肖怀秋.蛋白酶酶解液水解度对起泡性和乳化性的影响研究[J].粮油食品科技,2009,17(6):21~22.
20 Kristinsson H G,Rasco B A.Fish protein hydrolysates:Production,biochemical,and functional properties[J].Critical Reviews in Food Science and Nutrition,2000,40(1):43~81.
21 Gbogouri G A,Linder M,Fanni J,et al.In uence of hydrolysis degree on the functional properties of salmon by-product hydrolysates[J].Journal of Food Science,2004,69(8):615~622.
22 黄蔚东,吴克刚,唐彬婧,等.面筋蛋白酶解增溶及其乳化性能的研究[J].食品研究与开发,2006,27(8):4~8.
23 何希强,肖怀秋,王穗萍.豌豆蛋白质起泡性与乳化性研究初探[J].粮油食品科技,2008,16(3):50~54.
24 Kong Xiangzhen,Zhou Huiming,Qian Haifeng.Enzymatic preparation and functional properties of wheat gluten hydrolysates[J].Food Chemistry,2007,101(2):615~620.
