稻草添补百脉根体外甲烷产量的动态响应
2012-03-13李龙瑞张吉鹍邹庆华
李龙瑞,张吉鹍,邹庆华
(1.华南农业大学兽医学院 广东 广州510642;2.江西新天地药业有限公司兽药研究院,江西 峡江 331400;3.江西省农业科学院畜牧兽医研究所 江西 南昌 330200)
稻草是我国南方的主要农作物秸秆,由于其自身营养素的缺乏及硅、木质素等抗营养因子含量较高,不仅使饲喂单一稻草的反刍动物过瘤胃蛋白与生葡萄糖物质水平低,而且稻草在瘤胃内不能很好地被微生物发酵而导致消化率降低,从而不能有效地利用日粮的能量[1]。致使采食单一稻草的反刍动物饲料转化效率与生产性能低下,而单位畜产品的甲烷产量增加,加剧了当前的温室效应[2]。近年来,人们将研究的重点转向具有调控瘤胃发酵功能的植物次生代谢产物[3-5]。在日粮中补饲含皂苷类天然物质如无患子(Sapindussp.)果,可以降低反刍动物瘤胃原虫数量,增加真菌与细菌的产量,提高饲料利用率与生产性能[6-10]。牧草中的单宁可以增进反刍动物健康,减少甲烷的排放[11]。饲喂低质粗饲料的反刍动物,其生产性能低,主要是因为日粮中,蛋白质缺乏。所以,确保瘤胃中微生物生长所需的适宜氨氮水平是优化瘤胃低质粗饲料发酵的首选[12-13]。对饲喂以稻草为基础饲料的反刍动物以豆科牧草进行补饲,为瘤胃微生物提供足够的营养源(可发酵氮源、碳源和一些必须的矿物质元素),利用饲料间的组合效应来改善进入反刍动物体内的营养平衡,促进瘤胃发酵,是提高稻草等秸秆饲料利用率的重要举措[14-15]。可是,用豆科牧草进行补饲,虽可满足瘤胃微生物对氮的需求,增加瘤胃中纤维的降解率,但同时又会导致瘤胃甲烷产量的增加[2]。有报道指出,豆科牧草百脉根(Lotuscorniculatus)中高含量的浓缩单宁,能降低粗蛋白在瘤胃的降解率,放牧家畜即使过量采食,也不会发生臌胀病[16]。同时还可以保护过瘤胃蛋白,通过使较多的蛋白质进入小肠消化而提高氮的利用效率,增加肉、乳与毛的产量,使得畜体对环境的氮排泄与甲烷的排放量减少[17-19]。粪臭素与吲哚是由瘤胃微生物对色氨酸的脱氨基与脱羧基作用形成、存在于肉与脂肪中的风味物质,对肉的风味与品质有着负面影响。体外试验表明,百脉根中的浓缩单宁通过减少瘤胃蛋白的降解来减少粪臭素的产量,从而改善肉质[20]。百脉根叶量丰富,产量高,再生力强,粗蛋白含量高于其他豆科牧草,而粗纤维含量相对较低,特别是其茎秆细软更令家畜喜食而利用率高。百脉根适口性、营养价值均优于紫花苜蓿(Medicagosativa)等豆科牧草。此外,百脉根的生态适应性强(如南方高温多雨尤其是在苜蓿易烂根的平原地区),在南方无论是放牧利用还是调制干草或制作青贮都是较优良的豆科牧草[21]。近年来,有关植物次生代谢物调控瘤胃发酵的报道多见于其提取物[22-24],富含植物次生代谢物(如单宁)豆科牧草的过瘤胃蛋白保护作用[25-26]及其中的次生代谢物对瘤胃代谢与饲粮降解率的影响[16],作为含单宁豆科牧草在反刍动物日粮中的适宜比例[27]以及作为添补料对饲喂秸秆基础饲料绵羊体质量增加的组合效应[28],而有关反刍动物低质秸秆基础饲料补饲富含植物次生代谢物豆科牧草的瘤胃体外发酵及甲烷产量的报道较少。本研究根据豆科牧草百脉根富含单宁这一特性,就山羊(Caprasp.)稻草基础饲料补饲百脉根对瘤胃体外发酵参数及甲烷产量的动态变化进行研究。
1 材料与方法
1.1试验材料 体外批次培养发酵用稻草与百脉根均取自江西新天地乳业现代有机牧场。稻草为收获稻谷后的晚稻草,百脉根为在开花期刈割(留茬高度8 cm)的整株植株。稻草与百脉根粉碎过粒径为0.35 mm筛,备作常规化学成分分析与体外发酵。
1.2化学成分分析 试验所用稻草、百脉根中干物质(DM)、粗蛋白(CP)、粗脂肪(EE)与粗灰分(Ash)的测定依据AOAC[29]的方法进行,中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)与酸性洗涤木质素(ADL)采用Van Soest等[30]的方法进行测定。采用Folin-Ciocalteu比色法测定百脉根干草中的总单宁(Tannin)[31]。体外发酵所用稻草与百脉根的常规营养成分见表1。
稻草-百脉根混合发酵基质营养成分含量=稻草的营养成分含量×稻草比例+百脉根的营养成分含量×百脉根比例。

表1 试验用粗饲料的常规营养成分
1.3试验设计 本试验采用单因子11处理重复试验设计,RS与百脉根分别以100∶0(LC0)、90∶10(LC10)、80∶20(LC20)、70∶30(LC30)、60∶40(LC40)、50∶50(LC50)、40∶60(LC60)、30∶70(LC70)、20∶80(LC80)、10∶90(LC90)与0∶100(LC100)的比例各组成11个组合进行体外发酵,共进行2个批次。在进行批次发酵时,每个样品设3个重复,同时设1个空白对照组(无发酵样品的瘤胃液与培养液混合物,3个重复)与1个标准干草组(3个重复)用于校正各时间点因取样、培养瓶的体积差异以及瘤胃液菌源变异所引起的产气量变化。
1.4瘤胃液供体动物 选3只体况良好、体质量相近[(33±1) kg]、安装有永久性瘤胃瘘管的山羊供采集瘤胃液用。日粮的精粗比为3∶7,以混合粗饲料(稻草与百脉根各半)700 g·d-1为基础饲料,另按干物质计日补充300 g精料。日喂2次(08:00和18:00),自由饮水,常规光照。
1.5体外培养装置 采用由Theodorou等[32]建立并经Mauricio等[33]改进的压力传感器体外产气技术进行体外批次培养,压力传感技术主体装置由若干产气瓶、产气瓶支架、压力传感器、带特定软件的计算机及恒温培养箱等组成。每批可同时培养60个样品。
1.6缓冲液配制 本试验所用发酵液的配制按照Mauricio等[33]的介绍配制。
1.7体外批次发酵
1.7.1试验步骤 准确称取(1 000±10)mg已按要求粉碎的待发酵底物于发酵瓶中,然后加入100 mL缓冲液-瘤胃液混合液(9∶1)。小心排出发酵瓶中的多余气体,记录活塞的初始位置,然后将发酵瓶置于39 ℃恒温培养箱中培养,每个批次培养48 h。分别在发酵的3、6、12、24、36与48 h取发酵液样测定pH值与氨氮(NH3-N)浓度。
1.7.2测定方法 pH值用pH计(Sartorius PB-20型)直接测定。NH3-N浓度参照冯宗慈和高民[34]的比色方法进行测定。分别记录培养后3、6、12、24、36与48 h的压力,每次读数,取甲烷测定用气样后即将瓶内的气体放掉,将各时间点的压力转化为气体体积即产气量,然后将各时段的产气量累加,即为特定时间点全程累计产气量,48 h产气量为全程各时间点产气量之和。甲烷浓度参照Hu等[35]的气相色谱法测定。
1.8统计分析 用SAS(6.12)软件的一般线性模型(GLM)程序进行方差(AVOVA)分析和Dancan多重比较。
2 结果
2.1百脉根不同补添水平对发酵液pH值的影响 48 h内,发酵液各时间点pH值随发酵基质中百脉根添补水平的增加呈降低的趋势,且降幅有随添补量增加而加大的趋势(表2)。各添补组间多数差异显著(P<0.05)。从时间点分析,各添补组pH值总体上随培养时间的延长呈下降趋势,24 h降到最低点,而后有所回升。究其原因,可能是体外批次培养,随着发酵的进行,挥发性脂肪酸等有机酸(如乳酸)的积累引起pH值下降,同时由于饲料蛋白质分解加速使得氨的浓度增加,导致pH值上升。微生物对氨的利用又会降低氨的浓度,继而降低发酵液的pH值,而微生物的溶菌与原虫的自溶又会释放出氨而增加发酵液的pH值。此外,体外批次培养发酵液的pH值还与所用缓冲液的缓冲能力有关,而发酵基质中添补的豆科牧草中所含的丰富矿物质又会加强这种缓冲能力[2]。这些因素综合作用,决定着体外发酵液的最终pH值。
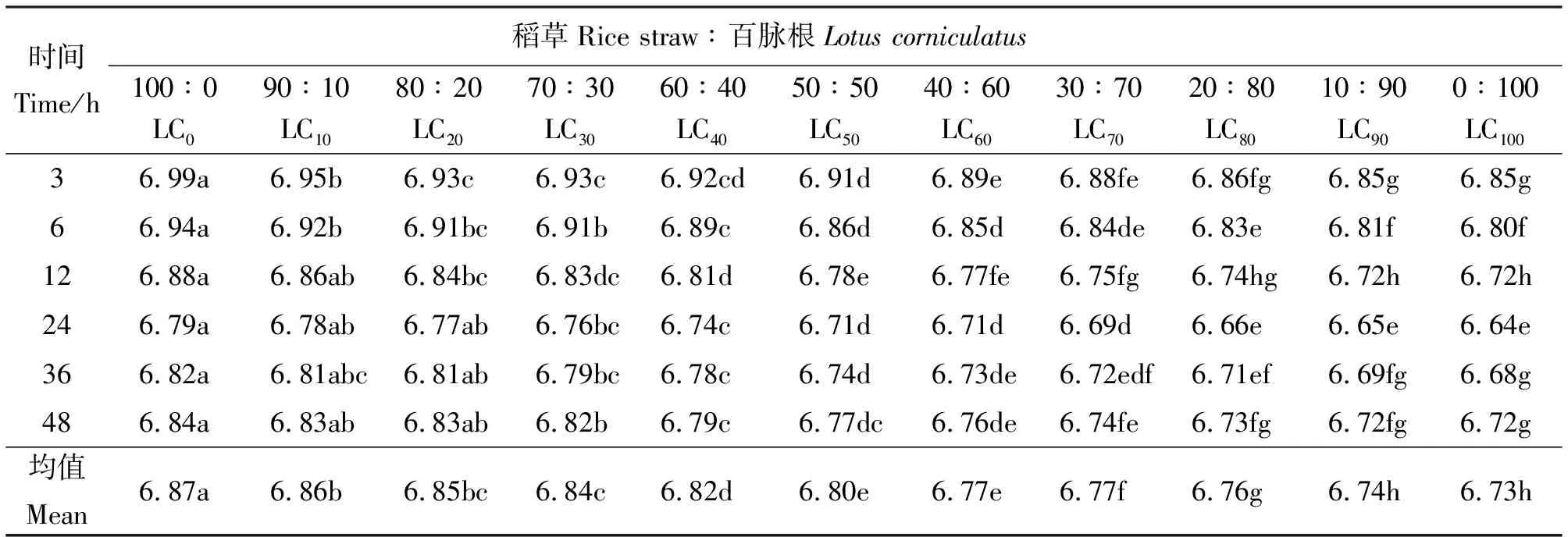
表2 稻草与不同比例百脉根组合体外发酵3~48 h在所测定时间点的pH值
2.2百脉根不同添补水平对发酵液氨氮质量浓度的影响 0~12 h,除12 h的NH3-N质量浓度LC100略低于LC90外,氨氮浓度在各时间点均随百脉根在混合发酵基质中比例的增加而升高。除12 h的LC100、LC90与LC80组间差异不显著外(P<0.05),其余各组间差异显著(P>0.05)(表3),这可能与豆科牧草百脉根较秸秆稻草易在瘤胃降解,微生物发酵百脉根中的含氮物质产生大量氨有关。可见,0~12 h的NH3-N质量浓度基本反映了发酵基质中蛋白质的降解情况。24~36 h,发酵液中NH3-N质量浓度除24 h的 LC10显著高于LC0外(P<0.05),其余添补组NH3-N质量浓度均随百脉根在混合发酵基质中比例的增加而降低,可能是因为微生物利用氨合成自身蛋白的速度大于对发酵底物产生氨的速度所致。24 h各组的NH3-N质量浓度差异显著(P<0.05),但在36 h,LC0与LC10,LC20与LC30,LC30、LC40与LC50以及LC80、LC90与LC100等多个添补组间差异不显著(P>0.05)。说明在24~36 h,随着发酵时间的延长,各添补组NH3-N质量浓度差异趋向不显著(P>0.05)。发酵至48 h,NH3-N质量浓度随混合发酵基质中百脉根的增加,由LC0的11.19 mg·dL-1降至LC30的8.42 mg·dL-1,随后又随百脉根的增加而增加,至LC50的9.13 mg·dL-1,接着又随百脉根的增加而降低,至LC80的7.24 mg·dL-1,最后又随百脉根的增加而增加,至LC100的9.57 mg·dL-1。NH3-N质量浓度在整个变化过程中出现了3处拐点,即LC30、LC50与LC80。发酵液中NH3-N质量浓度的回升,可能是细菌溶菌、纤毛虫自溶或纤毛虫的吞噬作用释放出氨所致。

表3 稻草与不同比例百脉根组合体外培养3~48 h NH3-N质量浓度的变化
2.3百脉根不同添补水平对甲烷产量的影响 体外批次发酵的3~12 h,甲烷产量随百脉根在混合发酵基质中比例的增加而增加,3 h LC0的最低,为0.038 mmol,12 h时LC90和LC100的最高,为0.072 mmol(表4)。随着发酵的进行,各组合的甲烷产量均缓慢增加,组间差异趋向不显著。在3 h时,除LC10与LC20、LC40与LC50、LC90与LC100组间差异不显著外(P>0.05),其余组间差异显著(P<0.05)。然而,在6 h与12 h,则多数组间差异不显著(P>0.05)。这可能与本试验所用发酵基质为稻草与百脉根有关,由于稻草为难以消化的秸秆,瘤胃微生物需要较长时间进行降解,故在发酵初期,甲烷产量较少。百脉根的纤维较稻草的容易降解,使得混合发酵基质甲烷产量随着百脉根在其中比例的增加而增加,尤其在发酵最初的3 h增加明显,6~12 h 增加较慢,可能与百脉根中的单宁部分地保护其中的蛋白免受瘤胃微生物的降解有关。发酵至24 h,各组合的甲烷产量均迅速增加,以后缓慢增加直至发酵终点(48 h),甲烷产量变化范围在1.006~1.313 mmol,最小的为24 h的LC100,最大的为48 h的LC0。24~48 h各组合的甲烷产量,随百脉根在混合发酵基质中比例的增加而减少,组间差异显著(P<0.05)。各组甲烷产量均随发酵时间的延长而增加,尤其在24 h后显著增加,这与所用发酵基质均为粗饲料有关,通常秸秆类粗饲料在瘤胃中发酵降解需要36~48 h。总单宁含量随百脉根在混合发酵基质中比例的增加而增加,即LC0、LC10、LC20、LC30、LC40、LC50、LC60、LC70、LC80、LC90与LC100中相当于添加了0、1.973、3.946、5.919、7.892、9.865、11.838、13.811、15.784、17.757与19.730 mg的单宁。这些成比例增长的单宁在一定程度上保护百脉根中蛋白免受瘤胃微生物降解的功能随混合发酵基质中粗蛋白含量的增加而得到加强,因而甲烷产量随百脉根在混合发酵基质中比例的增加而减少。
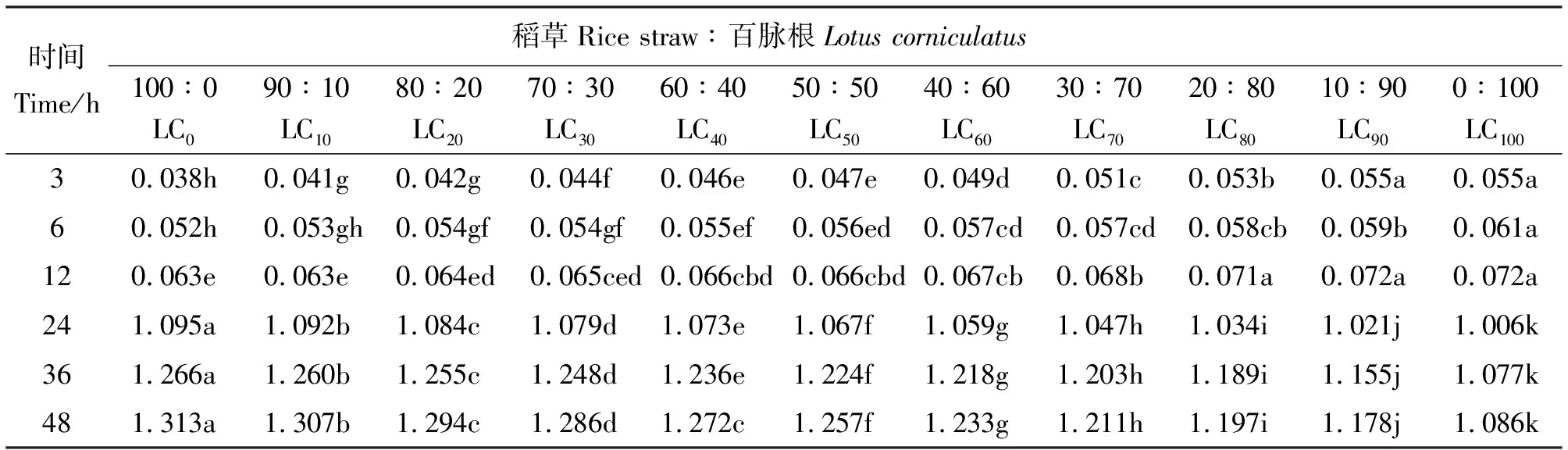
表4 稻草与不同比例百脉根组合体外发酵3~48 h甲烷产量的变化
2.4百脉根不同添补水平对48 h产气量的影响 各组48 h的产气量同甲烷一样,随百脉根在混合发酵基质中比例的增加而减少,多数组间差异不显著(P>0.05),而降低的幅度则随之增加(表5),同样可能与随混合发酵基质中百脉根比例增加而增加的单宁有关。
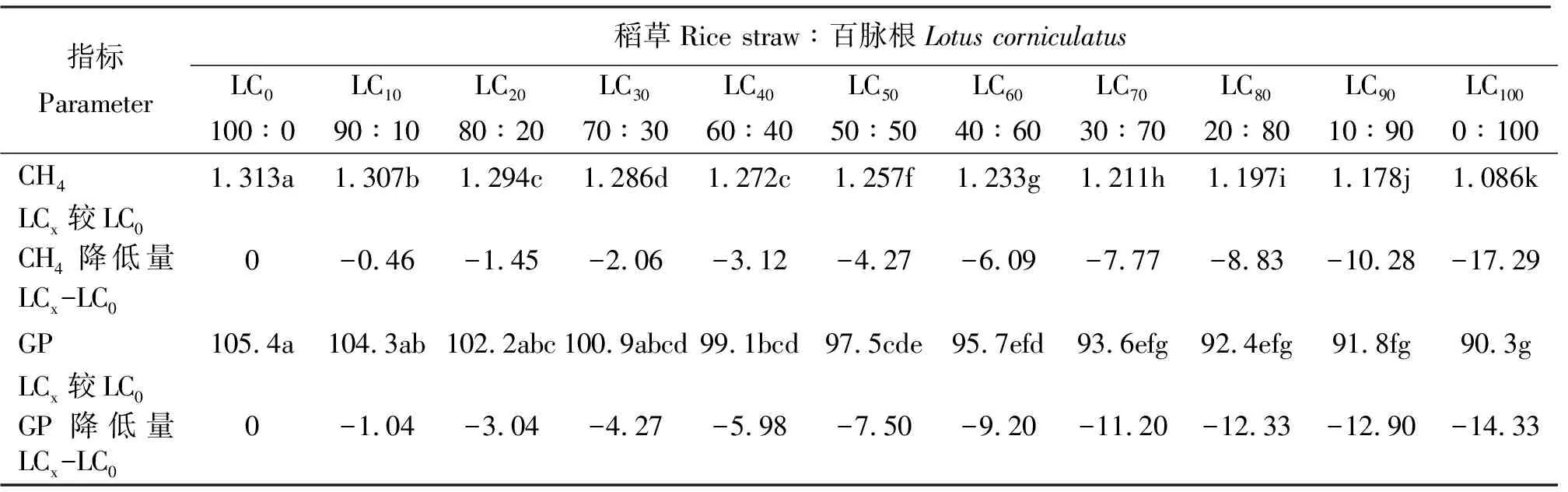
表5 稻草与不同比例百脉根组合体外发酵48 h的总产气量及甲烷产量
3 讨论
3.1百脉根不同补添水平对发酵液pH值的影响 瘤胃是瘤胃微生物赖以生存的直接环境,因此相对稳定的瘤胃内环境是瘤胃微生物正常生长及发挥正常功能的必要条件。瘤胃液pH值是反映瘤胃内环境的重要指标之一,它是饲料在瘤胃内发酵程度与模式的一个表观特征,是衡量瘤胃发酵状况的敏感指标,反映了瘤胃的综合发酵水平。它受唾液分泌量、挥发性脂肪酸及其他有机酸生成量、吸收与排出量等因素的影响。瘤胃液pH值的大幅度波动会影响到瘤胃微生物的合成效率,其波动的原因与动物个体、日粮组成与性质以及环境等因素有关。瘤胃液pH值正常的变化范围一般在6~7,这是因为过高或过低的pH值对于正常瘤胃微生物生长、发育及底物发酵均有不利的影响。pH值越低,说明发酵所产的酸累积得越多。当pH值低于5.5时,瘤胃MCP合成的效率会受到影响[36]。本试验所采用的体外批次培养法,因无底物外流与挥发性脂肪酸的吸收以及唾液的缓冲作用,发酵产物大量累积,故各百脉根添补组pH值在所测定的时间点,总体上均随培养时间的延长而呈现不断下降趋势。在培养后的3~24 h,各组发酵液pH值均有所降低,除与此间发酵基质内一些营养物质发酵产酸(主要是挥发性脂肪酸)有关外,亦可能与发酵液中氨被瘤胃微生物吸收利用有关。各百脉根添补组24 h后的pH值又有所回升,这种回升可能与原虫自溶以及细菌溶菌有一定关系。稻草基础日粮添补不同水平百脉根的48 h内,所测定发酵液各时间点pH值的变动范围在6.64~6.99,在瘤胃微生物特别是纤维分解菌生长所需的适宜pH值范围(6.2~7.0)内[37]。这说明本体外发酵试验没有改变瘤胃内环境,对瘤胃发酵没有产生不利影响。同时亦表明,本研究所用缓冲液缓冲能力较强,足以维持培养液的pH值在正常范围之内。段智勇[38]采用相同缓冲液研究稻草NDF添加不同水平的玉米(Zeamays)淀粉组合效应时,测得的稻草NDF和玉米淀粉混合物培养液24 h的pH值在6.68~6.84,并没有随玉米淀粉含量的增加与培养时间的延长而显著降低。Sommart等[39]研究稻草或5%尿素处理稻草添补不同水平的木薯(Manihotesculenta)对体外微生物发酵特性与微生物蛋白合成的影响时,发现尽管pH值受到木薯的添加水平及粗饲料的影响,且随培养时间的延长而显著降低,但pH值在6.70~6.88。本研究与这些研究结果相似。
3.2百脉根不同添补水平对发酵液氨氮浓度的影响 瘤胃液氨氮质量浓度是瘤胃内环境参数中反映氮代谢的一个重要指标,主要取决于日粮含氮物质降解速度与微生物对氨利用速度的动态平衡,其浓度基本可以反映出日粮蛋白质的降解情况与微生物的合成效率[40]。瘤胃内NH3-N既是瘤胃氮代谢过程中外源(饲料)蛋白质,内源含氮物质降解的重要产物,同时也是在有能量和碳链的情况下,瘤胃微生物合成菌体蛋白的原料。Clark等[41]通过体外批次发酵研究证明,在瘤胃微生物区系中,约80%的瘤胃细菌以NH3作为生长的唯一氮源,约50%的细菌可以以NH3-N或氨基酸作为生长的氮源,另26%的细菌的生长离不开NH3-N。因此,瘤胃内NH3-N浓度是瘤胃内环境参数的重要指标,是瘤胃内饲料蛋白降解及微生物对NH3-N利用的综合反映,故保证最佳的瘤胃NH3-N浓度是获得最大瘤胃微生物蛋白合成量的关键因素。体外批次发酵体系中的NH3-N浓度主要取决于3个因素。首先是发酵基质中的蛋白质含量及其降解率与理化特性;其次是含氮物质与能量载体物质的比例,能氮释放是否同步;再次为MCP的合成效率与微生物自溶。这3个因素关系紧密、相互影响。NH3-N浓度过低会影响微生物蛋白产量,过高表明氨释放速度高于其利用与吸收速度,造成氨的损失。Owens和Bergen[42]指出,瘤胃内微生物蛋白合成所需的NH3-N浓度为0.35~29 mg·dL-1,本研究的NH3-N浓度为3.92~26.23 mg·dL-1。一些学者就适于微生物生长的最佳NH3-N浓度作了较为深入的探讨,Schaefer等[43]报道,体外培养液中满足微生物生长需要的理想NH3-N浓度为2~5 mg·dL-1。Petersen[44]报道,放牧反刍动物瘤胃液中NH3浓度在1~2 mg·dL-1时,就可满足细菌对纤维降解的需要。Clark等[41]证实奶牛瘤胃液中的NH3-N浓度在2 mg·dL-1时,就能满足瘤胃微生物合成蛋白的需要。可见瘤胃微生物以氨作氮源合成瘤胃微生物蛋白的效率很高,即使瘤胃液中的氨态氮很低,亦能为微生物利用[43]。因此,有理由认为本研究中的氨氮浓度足以满足瘤胃微生物生长的需要,有效能(稻草纤维的有效降解)成为合成微生物蛋白的主要制约因素。
3.3百脉根不同添补水平对产气量及甲烷产量的影响 瘤胃发酵所产气中最主要的气体为CO2与CH4,分别占总量的70%与30%左右。产气量是一个综合反映饲料中有机物可发酵程度的指标,表现了瘤胃微生物活动的总体趋势[13]。饲料中糖(可发酵纤维)的产气量要高于蛋白质的产气量,因此,产气量同时也是反映饲料蛋白价值的综合指标[14]。饲料的可发酵有机物含量越多,瘤胃微生物的活性越高,产气量就越大;饲料中的可发酵有机物含量越少,瘤胃微生物的活性越弱,产气量也越少[41]。产气量 (或有机物降解率)主要反映的是饲料中可利用能量的多少,而瘤胃微生物蛋白反映的是饲料提供微生物蛋白能力的大小,只有把这2个指标结合起来,进行综合的整体评定[45],才能较为准确地评定稻草与百脉根的组合效应。本研究中,48 h的产气量随百脉根在混合发酵基质中比例的增加而减少,而瘤胃微生物蛋白则随百脉根在混合发酵基质中比例的增加而增加[46],表明提高混合发酵基质中百脉根的比例,可以使得混合发酵基质的能氮平衡趋于合理。本研究所报道的产气量及甲烷产量,随混合发酵基质中百脉根(单宁)比例的增加而下降,且下降的幅度亦随之增加。王丽凤[47]用不同的甲烷抑制剂进行体外抑制甲烷的试验,亦发现甲烷产量随着不同甲烷抑制剂在混合发酵基质中比例的增加而减少。胡伟莲[23]用皂苷进行体外抑制甲烷的试验,亦得出了同样的结论。此外,本研究体外发酵的甲烷产量在段志勇[38]与胡伟莲[23]报道的范围之内。
4 结论
山羊稻草基础日粮添补不同水平百脉根均可降低山羊瘤胃体外发酵甲烷产量,可以根据实际需要进行补饲。
[1]张吉鹍,李龙瑞,邹庆华.稻草与不同饲料混合在体外消化率上的组合效应研究[J].草业科学,2010,27(11):137-144.
[2]Diaz A,Avendano M,Escobar A.Evaluation ofSapindussaponariaas a defaunating agent and its effects on different ruminal digestion parameters[J].Livestock Research for Rural Development,1993(5):1-6.
[4]Wallace R J,McEwan N R,McIntosh F M,etal.Natural products as manipulators of rumen fermentation[J].Asian-Australasian Journal of Animal-Science,2002,15,1458-1468.
[5]Wina E,Muetzel S,Becker K.The impact of saponins or saponincontaining plantmaterials on ruminant production ——a review[J].Journal of Agricultural Food Chemistry,2005,53:8093-8105.
[6]Hess H D,Lascano C E,Carulla J E,etal.Potential of forage legumes and of saponin-containing fruits as tropical feed resources to manipulate rumen fermentation and to improve ruminant nutrition[J].Tropical and Subtropical Agroecosystems,2003:555-559.
[7]Ningrat R W S,Garnsworthy P C,Newbold C J.Saponin fractions inSapindusrarak:effects on rumen microbes[J].Reproduction Nutrition Development,2002,42(suppl.1):82.
[8]Thalib A,Widiawati Y,Hamid H,etal.The effects of saponin fromSapindusrarakfruit on rumen microbes and performance of sheep[J].Journal Ilmu Ternak dan Veterinary,1996,2:17-20.
[9]Wina E.The utilization ofSapindusrarakDC.Saponins to improve ruminant production through rumen manipulation[D].Stuttgart,Germany:University of Hohenheim,2005.
[10]Wina E,Muetzel S,Hoffmann E,etal.Saponins containing methanol extract ofSapindusrarakaffect microbial fermentation,microbial activity and microbial community structureinvitro[J].Animal Feed Science and Technology,2005,121:159-174.
[11]Waghorn G C,McNabb W C.Consequences of plant phenolic compounds for productivity and health of ruminants[J].Proceedings of the Nutrition Society,2003,62:383-392.
[12]Leng R A.Factors affecting the utilization of‘ poor-quality’ forages by ruminants particularly under tropical conditions[J].Nutrition Research Reviews,1990(3):277-303.
[13]张吉鹍,邹庆华,钟小军.稻草添补矮象草体外发酵组合效应的综合评定研究[J].中国畜牧杂志,2008,44(21):38-41.
[14]张吉鹍,刘建新.用压力传感器产气技术评定玉米秸秆添补苜蓿的组合效应[J].中国畜牧杂志,2007,43(21):40-43.
[15]张吉鹍.饲料间的组合效应及其在配方设计中的应用[J].草业科学,2009,26(12):113-117.
[16]张晓庆,郝正里,李发弟,等.红豆草缩合单宁对绵羊瘤胃代谢及饲粮尼龙袋降解率的影响[J].草业学报,2010,19(1):166-172.
[17]Barry T N,McNabb W C.The implications of condensed tannins on the nutritive value of temperate forages fed to ruminants[J].British Journal of Nutrition,1999,81:263-272.
[18]Min B R,Barry T N,Attwood G T,etal.The effect of condensed tannins on the nutrition and health of ruminants fed fresh temperate forages: a review[J].Animal Feed Science and Technology,2003,106:3-19.
[19]Woodward S L,Waghorn G C,Ulyatt M J,etal.Early indication that feeding lotus will reduce methane emission from ruminants[J].Proceedings of the New Zealand Society of Animal Production,2001,61:23-26.
[20]Schreurs N M,Tavendale M H,Lane G A,etal.Effect of white clover (Trifoliumrepens),perennial grass (Loliumperenne) andLotuscorniculatusoninvitroskatole and indole formation[A].In:Stockdale R,Heard J,Jenkin M.Animal Production in Australia,Proceedings of the 25th Biennial Conference of the Australian Society of Animal Production[C].Melbounce,Australia:CSIRO Publishing,2004:164-167.
[21]张鸭关,匡崇义,陈功.云南引进帝国百脉根的研究[J].四川草原,2004(12):9-11.
[22]王雅倩,赵国琦,闫韩韩,等.利用体外法研究不同水平苜蓿皂苷对山羊瘤胃内pH值和挥发性脂肪酸的影响[J].饲料工业,2009,30(3):35-40.
[23]胡伟莲.皂苷对瘤胃发酵与甲烷产量及动物生产性能影响的研究[D].杭州:浙江大学,2005.
[24]Yuan Z P,Zhang C M,Zhou L,etal.Inhibition of methanogenesis by tea saponin and tea saponin plus disodium fumarate in sheep[J].Journal of Animal and Feed Sciences,2007,16:560-565.
[25]牛菊兰,马文生.红豆草中单宁对过瘤胃蛋白的保护研究[J].草业科学,1995,12(3):60-65.
[26]张晓庆.红豆草中单宁对饲粮蛋白质保护的效果[D].兰州:甘肃农业大学,2005.
[27]张晓庆,李勇,李发弟,等.红豆草单宁含量对绵羊养分消化率及氮利用的影响[J].畜牧兽医学报,2009,40(3):356-362.
[28]Ben Salem H,Makkar H P S,Nefzaoui A,etal.Benefit from the association of small amounts tannin-rich shrub foliage (AcaciacyanophyllaLindl) with soya bean meal given as supplements to Barbarine sheep fed on oaten hay[J].Animal Feed Science and Technology,2005,122:173-186.
[29]AOAC.Official Methods of Analysis. Association of Official Analytical Chemists[M].15th Ed.Washington, DC,USA:Association of Official Analytical Chemists,1990.
[30]Van Soest P J,Robertson J B,Lowis B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74:3583-3597.
[31]Horvath P J.The nutritional and ecological significance of acer-tannins and related polyphenols[D].Ithaca,N.Y.P:Cornell University,1981:138.
[32]Theodorou M K,Williams B A,Dhanoa M S,etal.A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds[J].Animal Feed Science and Technolgy,1994,48:185-197.
[33]Mauricio R M,Mould M L,Dhanoa M S,etal.A semi-automatedinvitrogas production technique for ruminant feedstuff evaluation[J].Animal Feed Science and Technolgy,1999,79:321-330.
[34]冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].内蒙古畜牧科学,1993(4):40-41.
[35]Hu W L,Wang J K,Lv J M,etal.Rapid gas chromatogram determination of methane,organic acid ininvitroruminal fermentation products[J].Journal of Zhejiang University(Agriculture & Life Science),2006,32(2):217-221.
[36]Calsamiglia S,Ferret A,Devant M.Effects of pH and pH fluctuations on microbial fermentation and nutrient flow from a dual-flow continuous culture system[J].Journal of Dairy Science,2002,85:574-579.
[37]Mould F L,ørskov E R,Mann S O.Associative effects of mixed feeds.I.Effects of type and level of supplementation and the influence of the rumen fluid pH on cellulolysisinvivoand dry matter digestion of various roughages[J].Animal Feed Science and Technolgy,1983,10(1):15-30.
[38]段智勇.反刍动物日粮中淀粉与纤维的组合效应及其机理的研究[D].杭州:浙江大学动物科学学院,2006.
[39]Sommart K,Parker D S,Rowlinson P,etal.Fermentation characteristics and microbial protein synthesis in aninvitrosystem using cassava, rice straw and dried ruzi grass as substrates[J].Asian-Australasian Journal of Animal-Science,2000,8:1084-1093.
[40]张吉鹍.粗饲料分级指数参数的模型化及粗饲料科学搭配的组合效应[D].呼和浩特:内蒙古农业大学,2004.
[41]Clark J H,Klusmeyer T H,Cameron M R.Nitrogen metabolism and amino acid nutrition in dairy cattle:Microbial protein synthesis and flows of nitrogen fractions to the duodenum of dairy cows[J].Journal of Dairy Science,1992,75:2304-2323.
[42]Owens F N,Bergen W G.Nitrogen metabolism of ruminant animals:Historical perspective,current understanding and future implications[J].Journal of Animal Science,1983,57 (Suppl.2):498.
[43]Schaefer D M,Davis C L,Bryant M P.Ammonia saturation constants for predominant species of rumen bacteria[J].Journal of Dairy Science,1980,63:1248.
[44]Petersen M K.Nitrogen supplementation of grazing liverstock[A].Proceeding Grazing Liverstock Nutrition Conference[C].Jackson:University of Wuoming,1987:115-122.
[45]张吉鹍,邹庆华,王金芬,等.稻草与多水平苜蓿混合瘤胃体外发酵组合效应的整体研究[J].饲料工业,2011,32(17):40-48.
[46]张吉鹍,邹庆华,王金芬,等.稻草补饲百脉根瘤胃体外发酵及微生物蛋白合成的组合效应研究[J].江西农业大学学报,2011, 33(5):0942-0948.
[47]王丽凤.日粮中添加甲烷抑制剂对绵羊瘤胃中甲烷产量影响的研究[D].呼和浩特:内蒙古农业大学,2004.
