钝裂银莲花ISSR-PCR反应体系优化
2012-03-13刘左军孙文斌刘凤梅
孙 涛,刘左军,孙文斌,刘凤梅,李 冰
(兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
ISSR(Inter-simple sequence repeat)又称简单重复序列扩增,是由Zietkiewicz等[1]1994年提出的一种DNA标记技术,是近年来发展起来的一类新型的分子标记技术。ISSR标记技术具有无需知道任何靶标序列的微卫星背景信息、遗传多态性高、检测快等特点,在植物分类与进化、遗传多样性研究以及遗传图谱构建和基因定位方面具有广泛的应用前景[2]。虽然ISSR-PCR具有重复性高的优点[3],但不同材料、不同引物的扩增条件有异,反应体系不同也可产生不同的结果。因此,有必要建立与优化不同实验材料的ISSR-PCR的反应体系和扩增程序,以期获得稳定、可靠的ISSR 分析结果。
钝裂银莲花(Anemoneobtusiloba)为毛茛科(Ranunculaceae)毛茛亚科银莲花属(Anemone)[4]植物。分布于喜马拉雅山区和青藏高原东缘,祁连山、帕米尔高原一带,多数分布于西南部。由于其生长海拔高、生境分布广泛、进化较为低等,是很好的分子遗传学和分子生态学的研究材料[5]。因此,本研究通过提取甘肃合作的高寒草甸地区钝裂银莲花的DNA,采用ISSR分子标记技术,对银莲花进行ISSR-PCR反应条件优化,以期建立重复性高、反应条件稳定的反应体系,为深入研究高寒草甸银莲花属植物遗传多样性[6]奠定良好的基础。
1 材料与方法
1.1材料 钝裂银莲花样品采集于甘肃省甘南藏族自治州合作市(海拔2 973 m,34°57′ N,102°53′ E),材料采后立即放入保鲜袋中,用硅胶干燥保存。
1.2实验药品与仪器 引物UBC807(AG)8T、Taq DNA聚合酶、MgCl2、dNTPs、100 bp DNA Ladder Plus Marker(购自上海生物工程有限公司),PCR仪(型号MG96+,杭州朗基科学仪器有限公司生产)、电泳仪(型号DYY-11,北京六一仪器公司生产)。
1.3DNA的提取及检测 采集钝裂银莲花幼苗期嫩叶,采用改良的CTAB法[7]提取获得基因组DNA,即用氯仿-异戊醇抽提之前加用苯酚∶氯仿∶异戊醇(25∶24∶1)抽提一次,以减少酚类物质和其他杂质的含量。用紫外可见分光光度计测定260、280 nm处的吸收值,计算DNA的含量。以1%琼脂糖凝胶电泳检测所提取DNA的质量。
1.4ISSR-PCR反应体系设计与PCR扩增
1.4.1ISSR-PCR反应体系正交试验设计 采用L16(54)正交试验设计对模板浓度、dNTPs浓度、引物浓度、Mg2+浓度、Taq DNA聚合酶浓度进行5因素4水平筛选(表1、表2)。
按表2设计的16个反应体系组合,每个处理重复2次进行加样,PCR反应体系总体积为20 μL。PCR扩增程序[8]:94 ℃预变性5 min;94 ℃变性30 s,引物退火45 s,72 ℃延伸90 s,循环35次;72 ℃延伸7 min,4 ℃保存。采用1%琼脂糖凝胶电泳(电压为100 V) 分析扩增产物,凝胶成像系统观察成像记录。

表1 ISSR-PCR反应体系的因素与水平
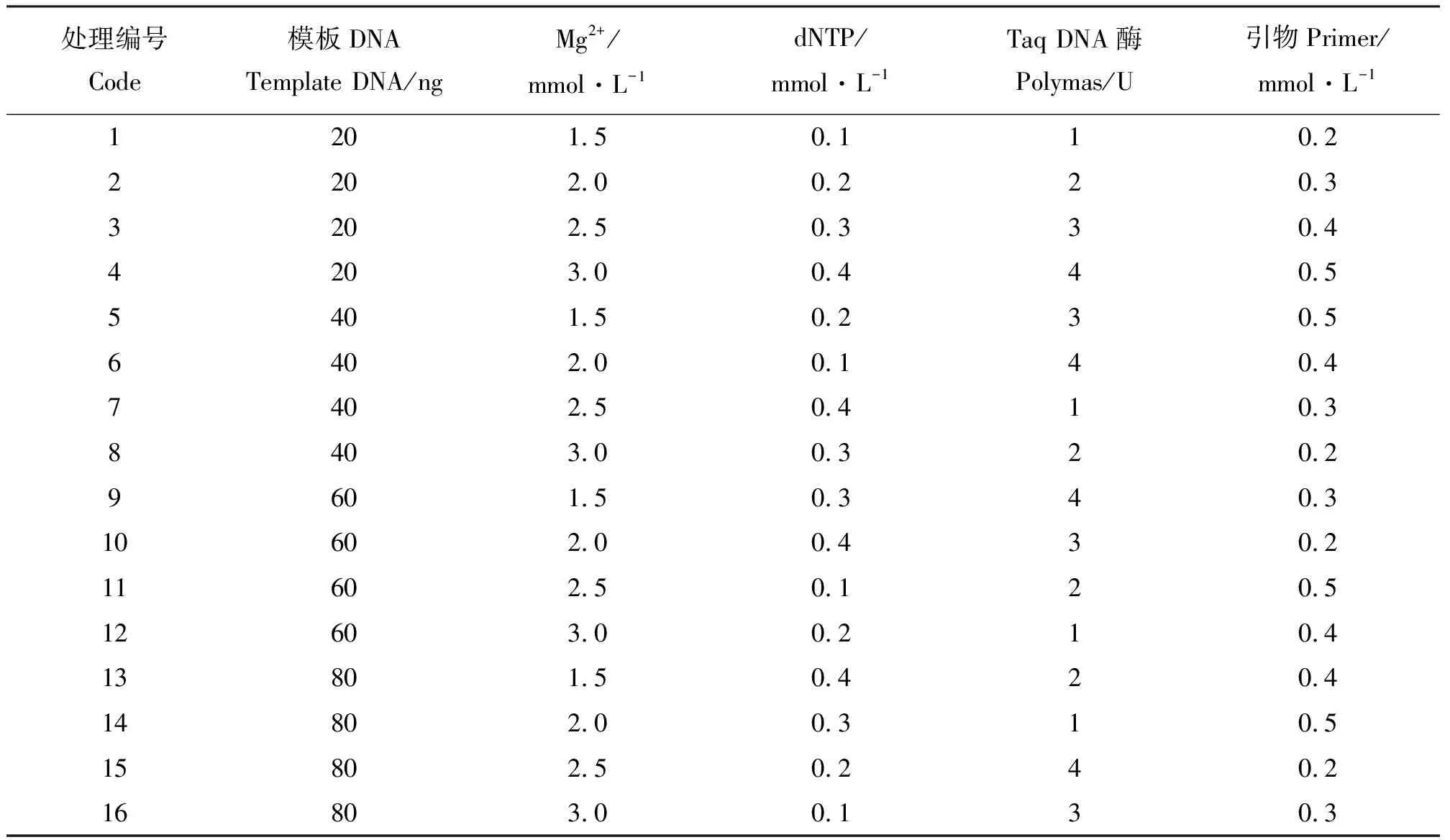
表2 ISSR-PCR反应体系的正交试验设计
1.4.2ISSR-PCR反应体系的单因素试验设计 在正交试验的基础上,对反应体系中各因素进行单因素试验。将正交体系中得到的特异性谱带清晰、谱带多态性较高,且谱带稳定的体系中的5个因素最优水平的设为固定值,对单个因素进行梯度筛选,将筛选出的该因素的最佳值作为固定值,然后将其他4个因素中的一个作为变量进行梯度筛选,其他3个固定因素不变,这样,依次完成对各因素的筛选,从而得到最佳反应体系[9-10]。
2 结果与分析
2.1DNA的提取与检测 提取高质量的钝裂银莲花基因组的DNA是ISSR扩增成功与否的关键。本试验用改进的CTAB法,所提取的DNA的电泳显示在点样孔附近都呈现出一条亮带;且条带整齐明亮,没有明显的拖尾,也未见RNA条带,说明提取的DNA质量高,完整性好,可用于ISSR体系优化分析和其他试验(图1)。
2.2ISSR-PCR反应体系的正交优化 参照何正文等的方法[11],根据本试验的正交设计PCR扩增结果和电泳检测,依据琼脂糖电泳谱带的强弱和杂带的多少进行直观分析。不同处理间,由于dNTP、引物、Mg2+和Taq DNA聚合酶的浓度不同,其扩增结果存在明显差异(图2)。反应体系1、9、14没有条带出现;2、5、13拖带,背景较重;4扩增条带较弱,但多态性较高;6扩增条带的多态性较低,且谱带较弱;8、16只有两条清晰的条带,扩增条带的多态性较低;16为模板、dNTP浓度和Mg2+浓度过高,使Taq DNA聚合酶的活性降低,反应不完全;10、11、12、15扩增条带的多态性较低,且谱带较弱;3、7扩增条带多态性高,且较清晰,但7中 Taq DNA聚合酶浓度过低,可能会使反应无法充分进行,从而影响扩增效果[12]。最佳组合应选择特异性谱带清晰、谱带多态性较高,且谱带稳定的组合[13],故本试验选择反应体系3为最佳组合,即20 μL ISSR-PCR反应体系中含有模板20 ng、10×PCR Buffer 2 μL、dNTPs 0.3 mmol·L-1、引物0.4 mmol·L-1、Mg2+2.5 mmol·L-1、和3 U Taq DNA聚合酶。
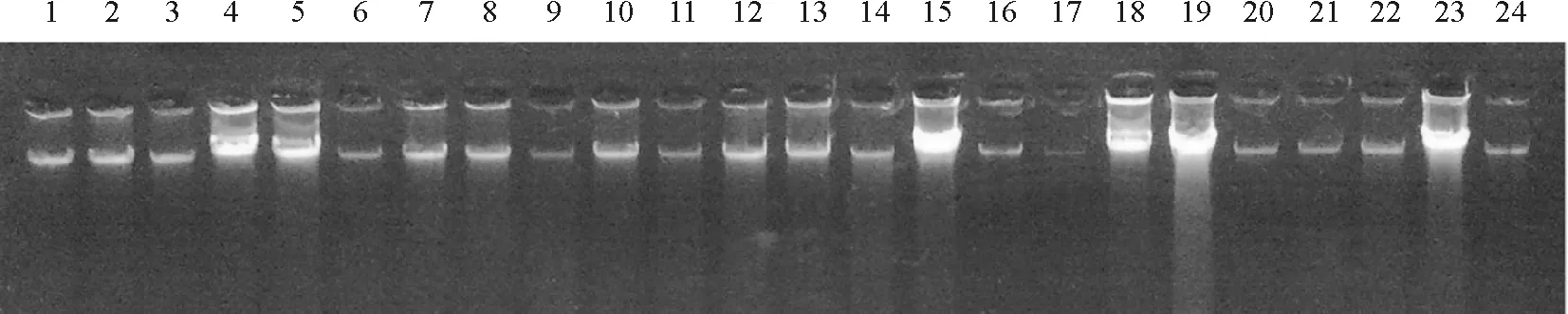
图1 钝裂银莲花24个样品基因组DNA电泳检测
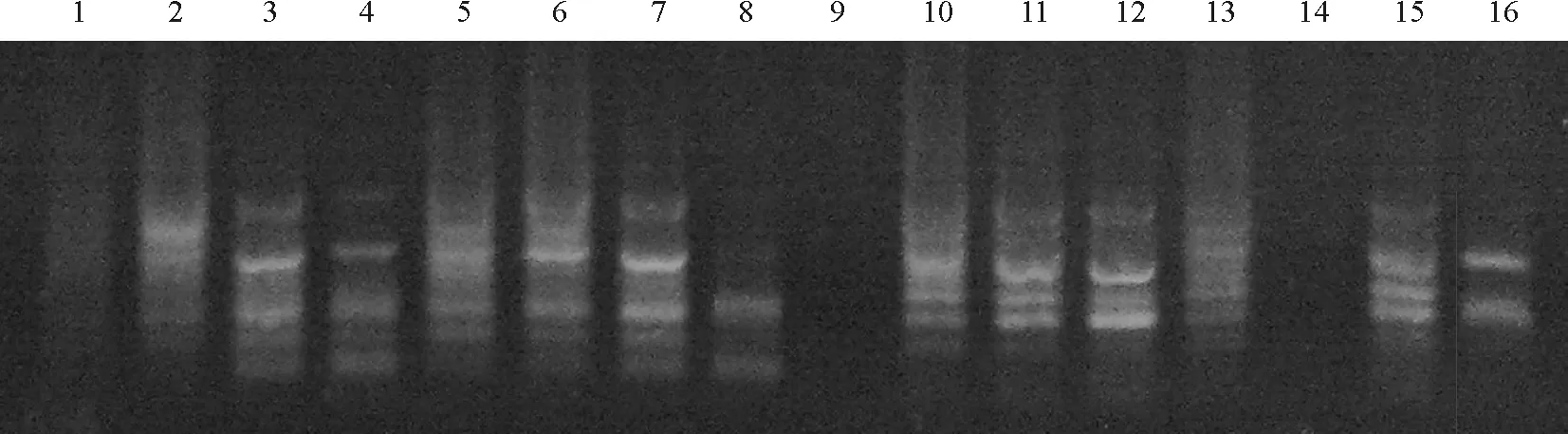
图2 正交试验设计ISSR-PCR反应体系的扩增结果
2.3ISSR-PCR反应体系的单因素试验
2.3.1不同模板DNA浓度对ISSR-PCR反应体系的影响 DNA模板的质量和用量是ISSR-PCR扩增效果的重要影响因素[14],用量过高会出现非特异性扩增,甚至抑制扩增的进行,浓度过低则得不到扩增产物。本试验设置了4个模板DNA的梯度(图3),模板DNA为20 ng时,扩增条带多且较亮;为40 ng时,扩增条带清晰且背景弱;为60、80 ng时,扩增条带较强,背景较亮,多态性较差。因此,本试验选择40 ng为反应体系中模板DNA的用量。
2.3.2dNTP浓度对ISSR-PCR反应体系的影响 dNTP作为ISSR-PCR反应的原料参与新链DNA的合成过程。在PCR反应中,dNTPs的用量影响到碱基掺入的正确与否以及扩增产率的高低,浓度过高或过低都导致分子量相对较大的条带得不到有效扩增。本试验设置了0.1、0.2、0.3和0.4 mmol·L-1共4个浓度梯度。dNTPs浓度为0.1 mmol·L-1时扩增条带模糊,为0.2 mmol·L-1时,扩增条带清晰,但背景较高,0.3 mmol·L-1时扩增条带清晰,背景清晰,产率最高,0.4 mmol·L-1时出现非特异性条带(图4)。因此,钝裂银莲花ISSR-PCR反应体系选择0.3 mmol·L-1的dNTPs浓度。
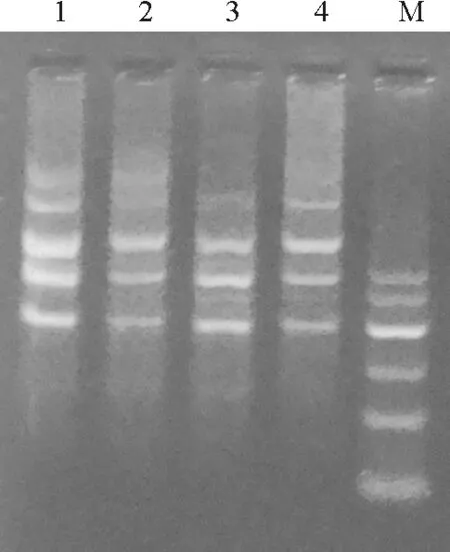
图3 不同的模板DNA用量下的扩增结果
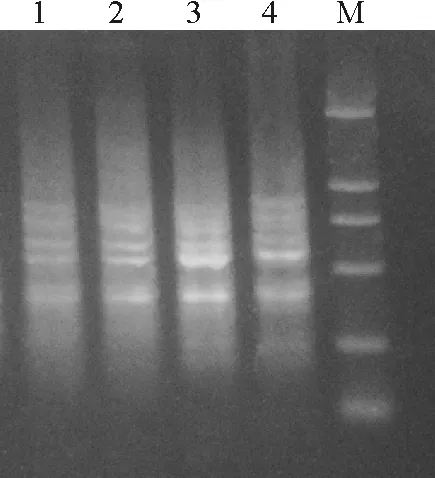
图4 不同的dNTP浓度用量下的扩增结果
2.3.3Mg2+浓度对ISSR-PCR反应体系的影响 Mg2+作为TaqDNA聚合酶的辅因子,它影响着TagDNA聚合酶的活性、退火温度和产物的特异性,而且能和反应体系中的dNTP、模板DNA和引物结合,影响它们的有效浓度[15],从而影响ISSR-PCR扩增结果。本试验验设置了1.0、1.5、2.0和2.5 mmol·L-1共4个梯度。当Mg2+浓度为1.0 mmol·L-1时扩增条带不稳定且背景较重,1.5 mmol·L-1时扩增条带不稳定,2.0 mmol·L-1时扩增条带减少,2.5 mmol·L-1时能扩增出清晰稳定的条带且无非特异性扩增(图5)。因此,在钝裂银莲花遗传多样性ISSR分析中,Mg2+浓度以2.5 mmol·L-1较为适宜。
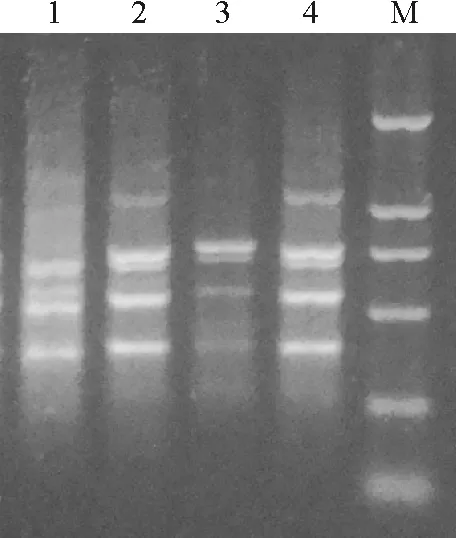
图5 不同的Mg2+浓度用量下的扩增结果
2.3.4TagDNA聚合酶浓度对ISSR-PCR反应体系的影响 在PCR反应中,Taq DNA聚合酶的用量是扩增结果的一个重要因素。用量过多不仅增加试验成本,而且容易扩增出非特异性条带。本试验设置了1、2、3、4 U共4个梯度。当酶的用量为1 U时条带很弱,说明酶用量不足,2 U时条带清晰且非特异性条带少,产物稳定,3和4 U时条带强度明显增强,但有非特异性条带出现(图6)。因此,在钝裂银莲花遗传多样性ISSR分析中,Taq DNA聚合酶以2 U较为适宜。
2.3.5引物浓度对ISSR-PCR反应体系的影响 PCR中过高的引物浓度会造成引物二聚体。因此,本试验设置0.2、0.3、0.4和0.5 mmol·L-14个浓度梯度。浓度在0.2和0.3 mmol·L-1时,扩增条带弱,背景较亮,而在0.4和0.5 mmol·L-1时,可以扩增出较为清晰稳定的条带(图7)。因此,在钝裂银莲花遗传多样性ISSR分析中,最佳引物浓度为0.4 mmol·L-1。
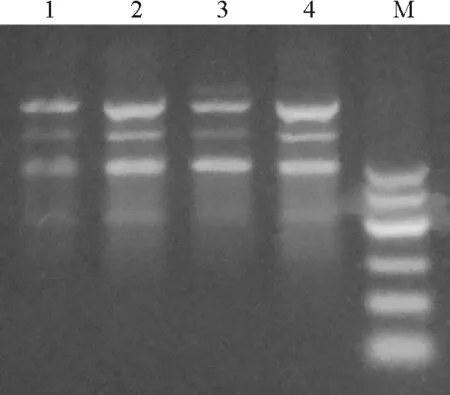
图6 不同TagDNA聚合酶浓度用量下的扩增结果

图7 不同的引物浓度用量下的扩增结果
3 讨论
本试验利用正交设计的方法得到了钝裂银莲花ISSR-PCR反应的最佳试验条件的组合,即:20 ng、10×PCR Buffer 2 μL、dNTPs 0.3 mmol·L-1、引物0.4 mmol·L-1、Mg2+2.5 mmol·L-1和3 U Taq DNA聚合酶。但该方法也存在着一定的局限性,不能很好地估计试验误差。在正交试验的基础上,结合单因子试验的方法,这两种方法的结合,不仅克服了正交试验主观上造成的误差,也克服了单因素忽视了各因子间的相互效应的影响,所得到的模板、dNTPs和引物最佳浓度是一致的,证明了试验的可信度[16-17];另外在Taq DNA聚合酶和Mg2+最佳浓度的确定上,两种方法的结果存在差异,这可能与PCR反应的不稳定性有关系,也可能是由于两者各自的局限性所造成的。结合两种方法,尽可能减少试验误差。该试验中模板量较低,扩增条带弱且少,模板量较大,扩增条带较强;dNTPs浓度对结果影响较小,较低浓度扩增条带模糊,较高出现非特异性条带;Mg2+浓度过低造成扩增产物量不足,过高出现非特异性扩增。说明钝裂银莲花ISSR反应体系对Mg2+浓度较为敏感;Taq DNA聚合酶浓度过低条带弱,过高出现非特异性产物且成本过高;引物浓度对结果影响不太明显,都有条带出现,说明体系对引物的浓度不敏感[18-19]。
致谢:本研究得到了兰州大学高寒草甸与湿地生态系统定位研究站的支持与帮助,在此衷心感谢!
[1]Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification[J].Genomics,1994,20(2):176-183.
[2]Jelena M,Mike C,Leitch A R,etal.Vinja Besendorfer Molecular structure and chromosome distribution of three repetitive DNA families inAnemonehortensisL. (Ranunculaceae)[J].Chromosome Research,2009,17:331-346.
[3]钱韦,葛颂.居群遗传结构研究中显性标记数据分析方法初探[J].遗传学报,2001,28:244-255.
[4]刘媖心.中国植物志[M].北京:科学出版社,1993:17-67.
[5]赵志刚.青藏高原高寒草甸常见毛茛科植物繁殖对策研究[D].兰州:兰州大学,2006:5.
[6]李昂,葛颂.植物保护遗传学研究进展[J].生物多样性,2001,10(1):61-71.
[7]肖冰梅,周小江,罗京,等.总DNA提取方法的比较研究[J].湖南中医药大学学报,2008,28(2):31-32.
[8]曾黎辉,洪自同,许家辉,等.龙眼ISSR反应体系的建立和优化[J].中国农学通报,2007,23(9):111-114.
[9]白锦军,魏安智,王佳,等.仁用杏ISSR分析体系的正交优化[J].分子植物育种,2009,7(6):1237-1224.
[10]TsumuraY,Ohba K,Strauss S H.Diversity and inheritance of inter-simple sequence repeat polymorphisms in Douglas-firc(Psendotsugumenziesii) and sugi(Cryptomeriajaponica)[J].Theoretical and Applied Genetics,1996,92(1):40-45.
[11]何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科,1998,23(4):403-404.
[12]王江波,钟风林,潘东明,等.荔枝ISSR扩增条件优化[J].中国农学通报,2008,24(2):71-74.
[13]李开拓,钟凤林,郭志雄,等.40个黄皮品种的ISSR分析[J].亚热带植物科学,2009,38(4):22-26.
[14]解新明,卢小良.SSR和ISSR标记及其在牧草遗传与育种研究的应用前景[J].草业科学,2005,22(2):30-36.
[15]Arrecibia A,Gentinetta E,Cuzzoni E,etal.Molecular analysis of the genome of transgenic rice(OryzasativaL)plant produced via particle bombardments or intact cell dectroporatlo[J].Molecular Breeding,1998,4:99-109.
[16]刘莉,邓春婷,包满珠.野牛草实生群体多样性的表型及ISSR分析[J].草业科学,2008.25(1):100-106.
[17]白成科,俞君如,于凤,等.山茱萸种质资源的ISSR遗传多样性分析与初级核心种质库的构建[J].西北植物学报,2009,29(12):2401-2407.
[18]刘兴菊,汤新彩,梁海永,等.枣树ISSR反应体系的建立及优化[J].西北林学院学报,2007,22(5):62-65.
[19]隋晓青,王堃.克氏针茅ISSR-PCR反应体系的建立与优化[J].草业学报,2008,17(3):71-78.
