不同沙土配比对约书亚树幼苗生理特征的影响1)
2012-03-05刘力宁满秀玲唐中华曲弨琪段亮亮
刘力宁 满秀玲 唐中华 李 奕 曲弨琪 段亮亮
(东北林业大学,哈尔滨,150040)
在沙生环境中,幼苗的生长受到多种因素的影响[1]。土壤水分状况是影响其生长的关键因素之一[2]。同一土壤吸力条件下,土壤含水量随含沙量的增加而逐渐降低[3]。水分不仅是植物体内重要的物质组成部分,同时植物诸多生理过程均需要水分参与[4]。植物适应环境特征的研究即植物生理生态学的研究对于阐明植物适应逆境的生理生态机制,寻找植物新的抗逆途径,从而对开发优良种质资源、育种、生态恢复以及抗旱性能评价等都具有重要意义[5]。
约书亚树(Yucca brevifolia)是百合科(Liliaceae)丝兰属(Yucca L.)植物,原产于美国西南部干旱半干旱地区,广泛分布在莫哈维沙漠[6],常绿乔木,树形优美,耐干旱瘠薄,抗干扰,能抵抗沙漠火灾[7],寿命长,在严酷的沙漠环境中可生存200 a 以上。它的耐热性极强,可以忍受50 ℃以上的高温及较大温差,对水的需求较小,是理想的固沙、景观植物。因此,本文选择引进树种约书亚树幼苗为研究对象,在土壤不同沙土配比条件下,测定2年生约书亚树幼苗生理生态指标的变化特征,揭示不同土壤条件下约书亚树幼苗生理响应机制,为约书亚树在我国成功引种奠定基础,为我国沙区造林及荒漠化防治提供理论依据。
1 试验材料
试验选用长势良好、无病虫害的2年生约书亚树幼苗作为试验材料。于2010年4月20日将幼苗移栽到17 cm×18 cm 塑料营养钵中。试验用土壤取自东北林业大学帽儿山实验林场的自然土壤,属腐殖质土。试验用沙从河北省石家庄市平山县购买,为经过筛分的天然河沙,类型为中沙。栽植土壤按体积比设计5个处理,即V(腐殖质)∶V(河沙)=9 ∶1、7 ∶3、5 ∶5、3 ∶7、1 ∶9,分别记为处理Ⅰ、处理Ⅱ、处理Ⅲ、处理Ⅳ和处理Ⅴ,每个处理有20 个重复,在温室中进行培养,每隔30 d 浇一次水,浇灌后保证每种处理的土壤水分均达到饱和状态。于2010年9月至10月测定约书亚树幼苗的各项指标。利用PSYPRO 露点水势仪测定不同处理土壤基质水势,于浇水25 d 后测得的处理Ⅰ、处理Ⅱ、处理Ⅲ、处理Ⅳ和处理Ⅴ土壤基质水势分别为:-42.681、-69.298、-100.191、-127.277、-151.787 kPa。
2 研究方法
2.1 光合作用指标测定
采用LI—6400 型便携式植物光合作用仪,统一取植株中部的叶片,对各处理约书亚树幼苗的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2的摩尔分数(Ci)[8]进行测定。测定时间为2 010年9月20日 至25日(连 续5日 晴 天),每 天8:00—16:00,每隔2 h 测定1 次。每个处理均取5个叶片进行测定,结果取平均值。
2.2 抗氧化酶及渗透调节物质测定
于2010年9月27日取幼苗叶片中间部位进行各项指标的测定,每个处理重复3 次,结果取平均值。其中:超氧化物歧化酶(SOD)活性采用硝基四唑氮蓝(NBT)还原法[9];过氧化物酶(POD)活性采用愈创木酚比色法[10];过氧化氢酶(CAT)活性的测定根据Aebi 的方法[11];抗坏血酸过氧化物酶(APX)活性及谷胱甘肽还原酶(GR)活性测定参照文献[12]的方法;蛋白质(Pr)质量分数采用考马斯亮蓝G-250 法[13];脯氨酸(Pro)采用酸性茚三酮比色法[14]。
2.3 数据处理及统计
根据测定的生理指标,检验约书亚树幼苗水分利用效率、气体交换特性在各个处理间的差异显著性。分别计算不同处理条件下树种的净光合速率及蒸腾速率的日平均值[15],然后使用Excel 及SPSS多元统计分析软件对数据进行分析。
3 结果与分析
3.1 约书亚树幼苗生境环境因子的日变化
环境因子日变化为光合日变化测定时温室内环境的变化。由表1可知,一天之内的光合有效辐射(PA,R)呈先升高后降低的变化趋势。8:0 0—12:00PA,R逐渐增强。其中,10:00—12:00 增强较迅速,12:00 达到最大值(314.72 μmol·m-2·s-1),之后逐渐下降,到16:00 降至最低值(42.09 μmol·m-2·s-1)。空气温度(ta)的变化趋势为先升高,持一定时间后,略微降低。由于温室环境的影响,ta的日变化幅度较小,为21.2 ~30.0 ℃,从8:00 开始逐渐上升,12:00 达到最高,之后缓慢下降,至16:00下降为25.5 ℃,但仍高于初始温度。空气相对湿度(RH)先降低后稍微升高,与PA,R和ta的变化趋势相反。8:00RH值最高(19.8%),随后下降,到12:00 时降到最低值(10.4%),仅为最大值的1/2,之后稍微回升。空气CO2摩尔分数(Ca)的日变化规律呈逐渐缓慢升高的趋势。一天中温室内Ca值在379.5 ~384.4 μmol/mol 之间,变化幅度非常小。
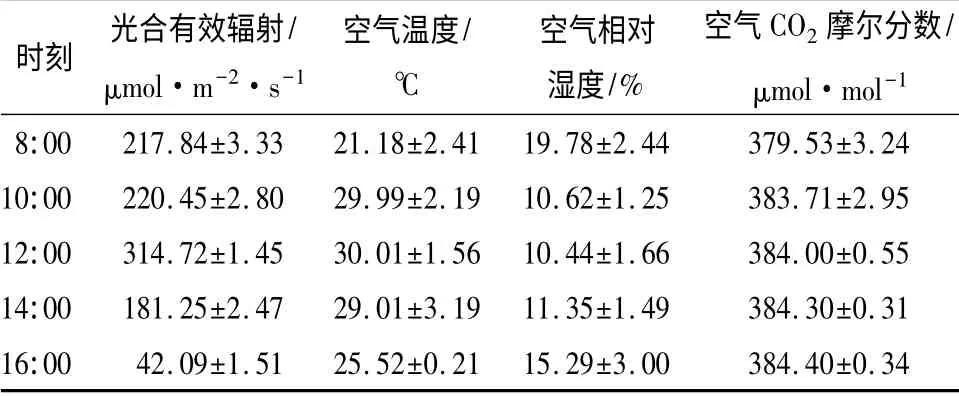
表1 环境因子的日变化
3.2 不同沙土配比对约书亚树幼苗净光合速率(Pn)及蒸腾速率(Tr)的影响
由表2可知,不同沙土配比条件下约书亚树幼苗净光合速率有不同的日变化规律。处理Ⅰ净光合速率的日变化符合一般植物的光合规律,即上午10:00Pn最高,12:00 明显降低,呈现光合“午休”现象,此后升高,下午16:00 降为最低。除处理Ⅰ外,其他处理均表现为上午8:00Pn最高,下午16:00 降为这一时段的最低值。其中处理Ⅱ上午8:00 时Pn达到6. 245 μmol·m-2·s-1,其他处理则在3 ~5 μmol·m-2·s-1范围内变化,各处理间差异极显著(P<0.01)。处理Ⅱ幼苗日平均Pn值最大(3.488 μmol·m-2·s-1),而 处 理Ⅳ日 平 均Pn值 较 小(1.441 μmol·m-2·s-1),二者相差2.4 倍。不同处理间Pn在不同时段差异不同,从8:00 至16:00,随着时间的推移,各处理间差异性变小。上午8:00 左右,处理ⅡPn明显高于其它处理,其它各处理的Pn较相近;处理Ⅰ、Ⅱ在10:00 附近Pn趋近,是其它处理Pn的3 倍多,随着时间的推移,各处理的Pn逐渐接近,14:00 出现趋同现象;直至下午16:00,幼苗Pn出现负值,Pn伴随着胞间CO2(Ci)摩尔分数的上升而下降,且Ci上升幅度越大,净光合速率的下降越大(表3)。由此推断,当温度下降、光强减弱时,气孔仅为次要因素,而其他非气孔因素则成为主要因素[16]。
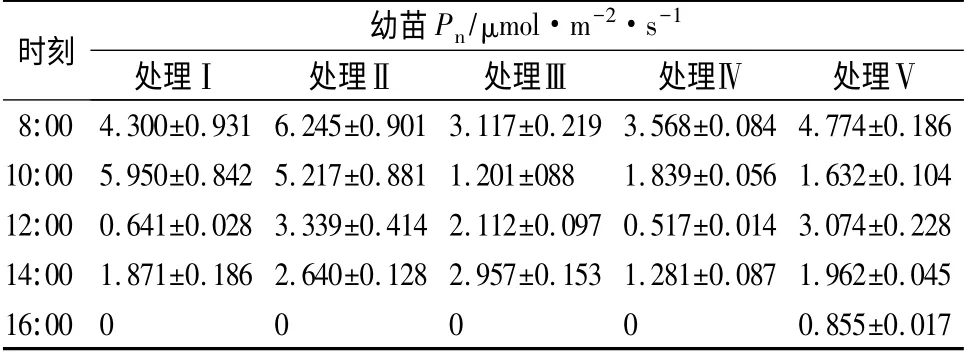
表2 不同处理对约书亚树幼苗Pn 的影响
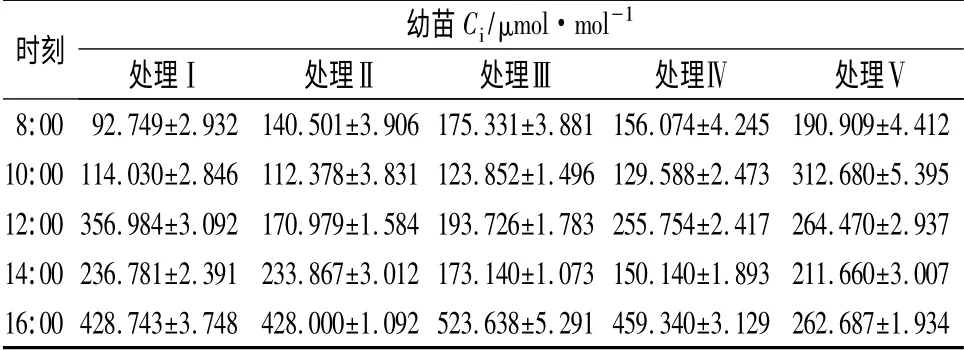
表3 不同处理下约书亚树幼苗Ci日变化
从表4可以看出,不同时段各处理间蒸腾速率(Tr)差异很大。上午8:00 至下午14:00,各处理间Tr波动性较大,规律性差,但到下午16:00,各处理幼苗Tr较为接近。处理Ⅱ约书亚树幼苗日平均Tr最大(1.0173 μmol·m-2·s-1),处理Ⅳ日平均Tr最小(0.4128 μmol·m-2·s-1),日平均Tr最大值是最小值的近2.5 倍。不同处理间Tr上午8:00 及中午12:00 时差异性显著(P<0.01)。处理Ⅱ和处理Ⅴ的Tr明显高于其它处理;处理Ⅰ、Ⅱ及Ⅳ的Tr日变化规律相似,在12:00 时蒸腾速率有明显的下降趋势;处理Ⅲ和处理Ⅴ的Tr日变化规律较接近,与其它处理差异显著,即12:00 时蒸腾速率出现上升趋势。
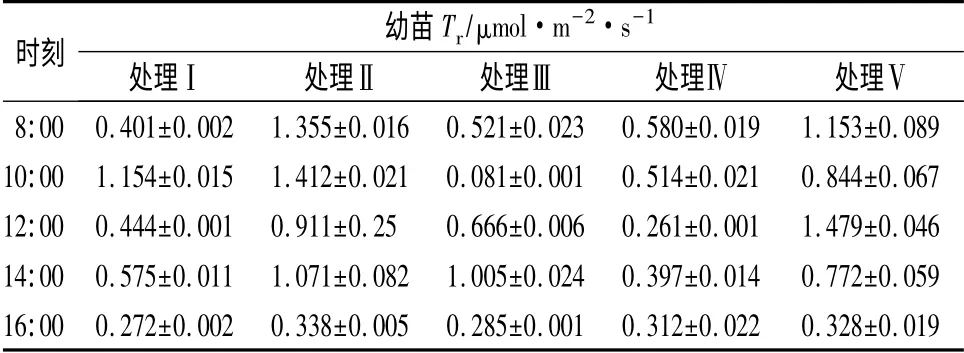
表4 不同处理对约书亚树幼苗Tr 的影响
由表5可知,处理Ⅱ幼苗气孔导度(Gs)在8:00左右明显高于其它处理,随着时间的推移,各处理的Gs逐渐接近,直至下午16:00,不同处理间的Gs相近。由此可见,约书亚树幼苗Pn与Gs的变化趋势具有同步性,说明Gs的下降是造成Pn下降的主要原因,同时也是使Tr变化的原因之一。净光合速率下降伴随着蒸腾速率和胞间CO2的摩尔分数下降,主要是气孔因素,如果净光合速率下降伴随着胞间CO2摩尔分数的上升,则说明净光合速率的下降以非气孔因素为主,即净光合速率的下降是由于叶肉细胞光合活性下降造成的[16]。约书亚树幼苗在不同处理中Pn与Gs同步下降,净光合速率的下降受到气孔因素的影响,但同时伴随着胞间CO2摩尔分数Ci的上升,这说明幼苗Pn下降既有气孔因素,又有非气孔因素的限制。
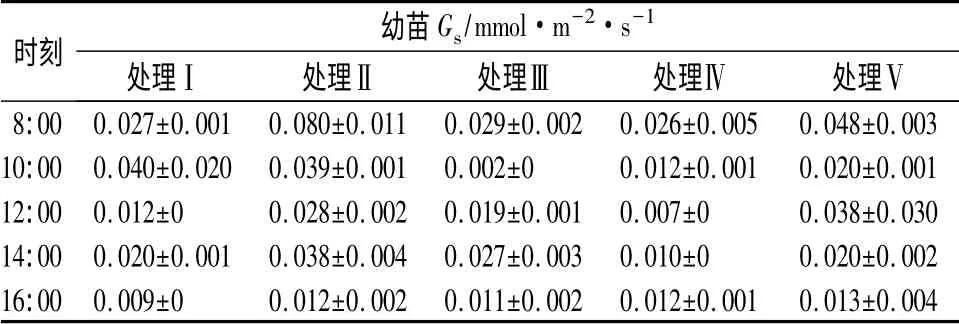
表5 不同处理下约书亚树幼苗Gs日变化
3.3 不同沙土配比对约书亚树幼苗水分利用效率(Wu,e)的影响
水分利用效率(Wu,e)是衡量植物水分消耗与物质生产之间关系的重要综合指标[17]。本试验用某测定时间叶片的Pn与Tr(蒸腾速率)之比表示该时刻的Wu,e[18]。由表6可见,处理Ⅰ、Ⅱ、Ⅴ水分利用率呈波动式降低,而处理Ⅲ、Ⅳ在上午10:00 Wu,e迅速升高,出现了一个峰值,分别为24. 410、17. 239 μmol·m-2·s-1,是其它处理的3 倍以上。10:00后,随着气温上升,空气相对湿度降低,为保持水分、减少蒸腾,气孔部分关闭,导致Pn下降,但Tr仍处于较高水平[2],Wu,e逐渐降低。由于各处理14:00 左右净光合速率的变化与蒸腾速率的变化趋势相同,所以此时各处理的Wu,e值非常接近。Wu,e在16:00 为一天中最低值,由于此时幼苗受到非气孔因素的影响,净光合速率出现负值,相应的Wu,e也为负值。其中处理Ⅲ幼苗的日平均水分利用率最高,达7. 366 μmol·m-2·s-1,其次是处理Ⅳ(5.664 μmol·m-2·s-1),处理Ⅴ最低(2.990 μmol·m-2·s-1),最高值是最低值的2.5 倍。不同处理Wu,e在8:00、12:00、16:00 时都表现出极显著差异性(P<0.01)。

表6 不同处理对约书亚树幼苗Wu,e 的影响
3 .4 不同沙土配比对约书亚树幼苗渗透调节物质及酶活性指标的影响
植物体内脯氨酸(Pro)是一理想的有机溶质渗透调节物[19]。脯氨酸是水溶性最大的氨基酸,被认为是有效的渗透调节物质[20-21],有助于提高植物细胞及组织的持水能力,从而增加植物抗旱性。旱生植物体内会积累大量的脯氨酸[22],脯氨酸在植物中的大量积累可能对植物的渗透调节起着重要作用[5]。由表7可知,随着土壤中沙量的增加,约书亚树幼苗脯氨酸质量分数表现为先增加后缓慢减少的趋势。沙量中等的土壤,幼苗脯氨酸质量分数明显高于沙量较低或较高的土壤。其中处理Ⅲ幼苗脯氨酸质量分数最高(4.886 μg·g-1),其次是处理Ⅳ(4.219 μg·g-1),处理Ⅰ幼苗脯氨酸的质量分数最低(1.778 μg·g-1),处理Ⅲ是处理Ⅰ的2.8 倍。不同处理间幼苗脯氨酸质量分数有较大的相关性(R2=0.853),土壤沙土配比与幼苗脯氨酸质量分数之间满足二次曲线关系,见表8。
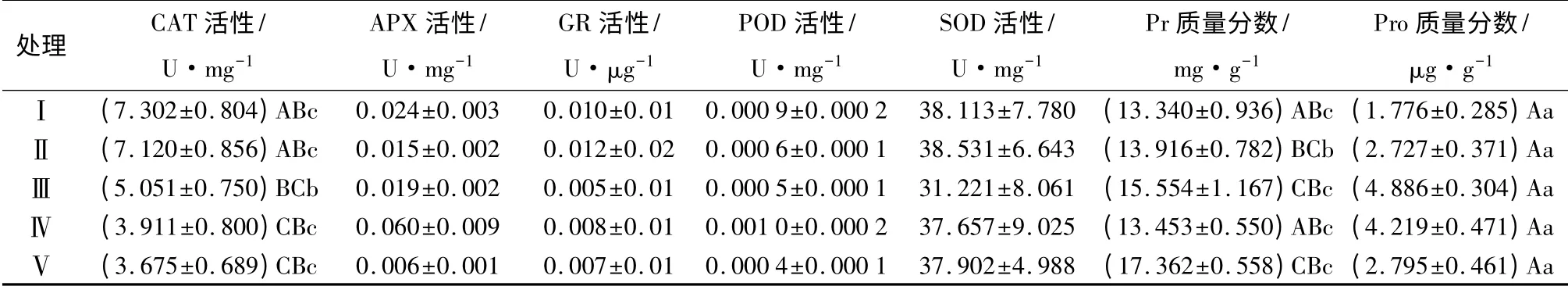
表7 不同处理下约书亚树幼苗抗氧化指标及相关性

表8 约书亚树幼苗生理生态指标与沙土配比的线性回归结果
植物体内的可溶性蛋白质(Pr)质量分数是了解植物体总代谢的一个重要指标[23]。由表7可知,不同处理之间幼苗可溶性蛋白质质量分数有一定差异,处理Ⅴ幼苗可溶性蛋白质质量分数最高(17.362 mg·g-1),而处理Ⅰ可溶性蛋白质质量分数最低(13.340 mg·g-1)。不同沙土配比培育的幼苗可溶性蛋白质质量分数之间差异显著(P<0.05)。高等植物H2O2的清除主要靠CAT、APX 等酶催化[23]。处理Ⅰ幼苗CAT 活性最强,为7.302 U·mg-1,处理Ⅴ幼苗CAT 活性最小,为3.675 U·mg-1,仅为处理Ⅰ的一半左右,不同处理间CAT 活性差异极显著(P<0.01)。随着土壤中沙量的增加,约书亚树幼苗CAT 活性呈递减趋势,这表明土壤中沙量越少,约书亚树幼苗体内产生的保护性酶CAT 活性越高,越有利于幼苗细胞的保护及植株的生长。另外,约书亚树幼苗体内的APX、GR、POD 等指标的活性非常低,且不同沙土配比之间差异性不显著(P>0.05),因此,这些酶的活性与土壤沙土配比的相关性较小(表8),但相比之下,处理Ⅲ的APX、GR、POD 及SOD 活性较其它处理均偏低。
4 结论与讨论
沙量配比较高的土壤虽然导水率理想,但是对土壤的持水性也带来负面影响。随着沙量的增加,土壤持水性逐渐下降[3]。因此不同沙土配比的土壤环境必然会影响幼苗的生长状况。结果表明:自然光照条件下,约书亚树幼苗净光合速率的变化既受气孔因素的限制,又受到非气孔因素的限制,但光照及温度相对较低时非气孔因素则成为主要因素,气孔仅为限制其净光合速率的次要因素。另外,不同沙土配比培育的约书亚树幼苗光合作用存在较大差异。处理Ⅱ~Ⅳ的变化趋势表明,随着土壤含沙量的增加,约书亚树幼苗的净光合速率逐渐降低,与此同时,水分利用率呈升高趋势[24]。造成处理Ⅰ变化趋势不符合规律的原因,可能是约书亚树更适宜较干旱的土壤环境,水分充足并不一定有利于其生长,而处理Ⅴ的极度缺水环境造成了幼苗生长代谢的紊乱。相比之下,在干旱的土壤环境中,处理Ⅲ的日平均水分利用率最高(7.366 μmol·m-2·s-1),而处理Ⅴ最低(2.990 μmol·m-2·s-1),仅为最高值的2/5。这说明,沙土配比5 ∶5 左右的土壤环境,可以促进约书亚树幼苗自身光合能力的有效调节,以适应干旱的沙漠环境。
约书亚树幼苗脯氨酸质量分数与土壤基质存在极显著的相关关系(R2=0.853),其中处理Ⅲ幼苗的脯氨酸质量分数最高(4.886 μg·g-1),其次是处理Ⅳ(4.219 μg·g-1),而处理Ⅰ幼苗的脯氨酸质量分数最低(1.778 μg·g-1),脯氨酸质量分数最高值是最低值的2.8 倍。约书亚树幼苗可溶性蛋白质质量分数与沙土配比之间也存在显著的相关性(R2=0.537),其中处理Ⅴ幼苗的可溶性蛋白质质量分数最高(17.362 mg·g-1),其次是处理Ⅲ的幼苗(15.554 mg·g-1),而处理Ⅰ幼苗的可溶性蛋白质质量分数最低(13.340 mg·g-1)。研究发现:不同处理幼苗的脯氨酸质量分数、可溶性蛋白质的质量分数均与沙土配比成正相关,说明其积累的脯氨酸既具有渗透调节作用,又稳定了体内的蛋白质[5],对约书亚树幼苗适应干旱环境具有重要作用。相对于其它处理,处理Ⅲ幼苗的脯氨酸质量分数及可溶性蛋白质质量分数均较高,说明生长在沙土配比为5 ∶5 左右的土壤环境中的约书亚树幼苗,其体内的渗透调节物质含量较高,可以在干旱环境中更好地保护自身的细胞及组织,以适应恶劣的生长环境。另外,抗氧化酶(CAT、SOD、POD 等)活性的增强,可以加强植物体内活性氧的清除能力,从而降低膜脂的过氧化程度,保护膜结构的完整性[25]。约书亚树幼苗CAT活性直接受沙土配比的影响,且呈显著负相关(r=-0.886,P<0.05)。不同处理间幼苗CAT 活性差异极显著(R2=0.925),随着含沙量的增加,约书亚树幼苗CAT 活性呈递减趋势。CAT 活性的受抑,说明体内酶性防御系统受到削弱[26]。试验表明,配比土壤中沙量的增加会导致约书亚树幼苗体内CAT 酶防御系统受破坏,使CAT 酶对幼苗的保护能力削弱。而约书亚树幼苗SOD、POD、APX、GR 活性与沙土配比的相关性小,且不同处理之间差异性不显著(P>0.05)。但相比之下,处理Ⅲ的APX、GR、POD及SOD 活性较其它处理均偏低,说明处理Ⅲ土壤生境对约书亚树幼苗的胁迫最小,幼苗更适应这种土壤环境。
由于沙漠干旱的土壤环境会对幼苗生理生态特征产生不同程度的影响,在旱生土壤生境中,渗透调节物质含量增高,可以有效提高约书亚树幼苗的抗性能力。综上所述,幼苗在沙土配比为5 ∶5 左右的土壤中生长,无论是水分利用率、脯氨酸质量分数、可溶性蛋白质量分数都相对较高,且抗氧化酶的活性相对较低,较其它处理对干旱的适应性较强。所以,如果在沙区栽植约书亚树,可以在约书亚树幼苗期利用客土的方法为其创造沙土配比为5 ∶5 左右的土壤小生境,以更好地适应恶劣、干旱的生存环境,从而有效地促进荒漠地区约书亚树幼苗的生长。
[1] 李文婷,张超,王飞.沙埋与供水对毛乌素沙地两种重要沙生植物幼苗生长的影响[J].生态学报,2010,30(5):1192-1199.
[2] 姬兰柱,肖冬梅,王淼. 模拟水分胁迫对水曲柳光合速率及水分利用效率的影响[J].应用生态学报,2005,16(3):408-412.
[3] 宋桂龙,韩烈保,李德颖.不同沙土配比根系层土壤的持水特性研究[J].土壤通报,2008,29(2):233-237.
[4] 郑明清,郑元润,姜联合.毛乌素沙地4 种沙生植物种子萌发及出苗对沙埋及单次供水的响应[J].生态学报,2006,26(8):2474-2484.
[5] 胡小文,王彦荣,武艳培.荒漠草原植物抗旱生理生态学研究进展[J].草业学报,2004,13(3):10-15.
[6] Loik M E,Huxman T E,Hamerlynck E P,et al. Low temperature tolerance and cold acclimation for seedlings of three Mojave Desert Yucca species exposed to elevated CO2[J]. Journal of Arid Environments,2000,46(1):43-56.
[7] DeFalco L A,Esque T C,Scoles-Sciulla S J,et al. Desert wildfire and severe drought diminish survivorship of the long-lived Joshua tree (Yucca brevifolia;Agavaceae)[J]. American Journal of Botany,2010,97(2):243-250.
[8] Nijs I,Ferris R,Blum H. Stomatal regulation in a changing climate:a field study using Free Air Temperature Increase (FATI)and Free Air CO2Enrichment (FACE)[J]. Plant,Cell and Environment,1997,20(8):1041-1050.
[9] Krivosheeva A,Tao Dali,Ottander C,et al. Cold acclimation and photoinhibition of photosynthesis in Scots pine[J]. Planta,1996,200(3):296-305.
[10] 张以顺,黄霞,陈云凤.植物生理学实验教程[M].北京:高等教育出版社,2009:139-141.
[11] Aebi H. Catalase in vitro[J]. Methods in Enzymology,1984,105(13):121-126.
[12] Ma Fengwang,Cheng Lailiang. The sun-exposed peel of apple fruit has higher xanthophyll cycledependent thermal dissipation and antioxidants of the ascorbate glutathione pathway than the shaded peel[J]. Plant Science,2003,165(4):819-827.
[13] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[14] 赵树兰,廉菲,多立安.草坪植物对生活垃圾堆肥基质的生理生态响应[J].生态学报,2009,29(2):916-923.
[15] 徐利霞,杨水平,姚小华.石漠化地区3 个树种幼苗在水分胁迫下的光合特性与抗旱性关系[J]. 林业科学研究,2006,19(6):785-790.
[16] Farquhar G D,Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology,1982,33:317-345.
[17] 王美云,李少昆,赵明.关于玉米光合作用与叶片水分利用效率研究中的作用[J].作物学报,1997,23(3):345-352.
[18] 张正斌,山仑.小麦旗叶水分利用效率比较研究[J]. 科学通报,1997,42(17):1876-1881.
[19] 周瑞莲,孙国钧,王海鸥. 沙生植物渗透调节物对干旱、高温的响应及其在抗逆性中的作用[J].中国沙漠,1999,19(1):18-22.
[20] 马玉心,蔡体久,宋丽萍,等. 兴安鹿蹄草(Pyrola dahurica(H. Andr. )Kom.)在雪盖前后丙二醛及渗透调节物质的变化规律[J].生态学报,2007,27(11):4596-4602.
[21] Hare P D,Cress W A,Van Staden C J. Dissecting the roles of osmolyte accumulation during stress[J]. Plant,Cell and Environment,1998,21(6):535-553.
[22] Wang Soumin,Wan Changgui,Wang Yanrong,et al. The characteristics of Na+,K+and free proline distriribution in several drought-resistant plants of the A lxa Desert,China[J]. Journal of A rid Environments,2004,56(3):525-539.
[23] Asada K. Ascorbate peroxidase—a hydrogen peroxide scavenging enzymes in plants[J]. Physiologia Plantarum,1992,85(2):235-241.
[24] 牛书丽,蒋高明.内蒙古浑善达克沙地97 种植物的光合生理特征[J].植物生态学报,2003,27(3):318-324.
[25] Agarwal S,Sairam R K,Srivastava G C,et al. Changes in antioxidant enzymes activity and oxidative stress by abscisic acid and salicylic acid in wheat genotypes[J]. Biol Plant,2005,49(4):541-550.
[26] 钮福祥,华希新,郭小丁,等. 甘薯品种抗旱性生理指标及其综合评价初探[J].作物学报,1996,22(4):392-398.
