柽柳类锌指基因ThZFL的功能分析1)
2012-07-02曲冠证郑唐春杜兆伟赵思雯夏德安
曲冠证 郑唐春 杜兆伟 赵思雯 夏德安
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
柽柳(Tamarix hispida)是分布在干旱荒漠区域的抗胁迫性较强的生态植物,除具有抗干旱能力外,还主动将积累的盐分储存在液泡中而实现区隔化[1-2]。因此,柽柳是进行林木抗逆研究的理想物种。通过对柽柳cDNA文库的测序及Blast比较分析,获得了一个具有完整开放读码框的基因序列(GenBank No.EG971462),其与拟南芥中命名为C2H2 型锌指蛋白(AT5G16470,AT3G02790,TAIR)的基因具有较高的相似性(氨基酸序列相似性约为80%)。植物锌指蛋白是一类广泛研究的抗逆性基因蛋白,例如在胡椒中克隆的新基因CaAbsi1、从菊花中分离的DgZFP基因和锌指蛋白基因Tsip1转烟草中都对NaCl、干旱、冷冻及激素等胁迫产生应答反应[3-5]。但通过对 SwissProt数据库进行 Blast未发现有相似的已知植物蛋白基因,因此可以认为此基因为一个新基因,故暂时命名该基因为ThZFL(Tamarix hispida Zinc finger like gene)[6]。
本试验在前期的试验基础上,对转基因烟草植株进行盐胁迫、干旱胁迫处理,探究ThZFL基因在应对非生物胁迫的生理功能。通过酵母双杂交技术,筛选与ThZFL基因表达的蛋白具有相互作用的蛋白,为研究蛋白质与蛋白质间的相互联系提供支持,也为探究新基因的生理功能提供理论依据。通过克隆ThZFL基因的启动子,转化拟南芥分析表达规律,为进一步探究该基因的生理功能、分析抗逆机制的形成提供理论依据。
1 材料与方法
1.1 试验材料
本试验所用烟草野生型为Nicotiana tabacum‘Havana SRI’;拟南芥野生型为 Columbia-0 型;酵母双杂交表达载体pGBKT7-BD、对照质粒pGBKT7-53、pGBKT7-lam、pGADT7-T、Y2Hgold 和 Y187 酵母菌种,酵母省缺培养基及转化试剂均购自Clontech公司;PCR相关试剂、DNA marker、pMD18-T载体、限制性内切酶、T4 DNA ligase均购自TaKaRa公司(中国,大连);EasyPure Plant RNA Kit(Transgen,中国);其他试验试剂为进口或国产分析纯。
1.2 ThZFL基因转烟草的非生物胁迫分析
盐胁迫下种子的发芽率 将收获的转基因烟草种子消毒后点种到含有200 mmol/L NaCl MS培养基中,放到培养室中从第7天起开始统计发芽率,以野生型烟草种子为对照。
盐胁迫下叶片的分化情况 将转基因烟草组培苗的叶片切成1 cm×1 cm的小块,转移到含有200 mmol/LNaCl的MS分化(MS+0.5mg/L6-BA+0.05 mg/L NAA)培养基上,观察叶片的分化情况,以野生型烟草叶片为对照。
盐及干旱胁迫下植株的生长状况 将3周大小的转基因烟草7、16、20、21号株系幼苗种植到土壤中,壮苗一周后,用200 mmol/L的NaCl溶液浇灌烟草植株,每隔3 d浇水一次。在处理后的第3天、第7天、第14天测量植株高度。40 d后将烟草植株用清水洗净,晾干后测量鲜质量,烘干后测量干质量;同时,另一组一直不浇水,进行干旱处理,观察20 d后的生长状况。
ThZFL基因互作蛋白的筛选 从柽柳cDNA文库中克隆出ThZFL目的基因序列,用 BamHⅠ和EcoRⅠ限制性内切酶双酶切后连接到pGBKT7-BD载体中,获得重组质粒pGBKT7-ThZFL。转化酵母Y2Hgold菌株,对转化后的酵母涂布 SD/-Trp、SD/-Trp/X、DDO、TDO平板,验证目的基因无自激活作用,通过对酵母生长曲线的测定验证诱饵蛋白无毒性作用[7]。将活化好的含有诱饵表达载体的Y2Hgold菌,与构建好的柽柳酵母文库Y187菌进行酵母杂交,然后涂布TDO平板。3 d后挑取三缺板上的单克隆转移到QDO/X/A平板,初步检验阳性克隆。从酵母中营救质粒转化大肠杆菌,送北京六合华大公司测序。
ThZFL基因启动子的克隆及其表达分析 用CTAB法提取柽柳基因组DNA[8],根据已知的ThZFL基因序列设计3条特异引物:Th-SP1/Th-SP2/Th-SP3(表1),设计方向为需要扩增的未知区域。以柽柳基因组DNA为模板,分别以AP1、AP2、AP3、AP4引物为上游引物。根据染色体步移试剂盒(TaKaRa)说明书进行3轮PCR。将PCR产物胶回收后连接pMD18-T载体,送北京六合华大公司测序。根据启动子序列设计启动子特殊引物Th-PF/Th-P-R(表1),用限制性内切酶 NcoI和 Hind III将启动子剪切后连入NcoI和Hind III内切酶处理的pCAMBIA-1301载体中,构建植物表达载体p1301-PThZFL-gus。然后转入农杆菌EHA105菌中,采用浸花法侵染野生型拟南芥,获得转p1301-PThZFL-gus拟南芥植株[9]。

表1 ThZFL基因启动子克隆引物汇总
播种转基因种子后,在幼苗期取材,放入GUS染色液中在37℃染色10 h,然后用卡诺固定液(V(无水乙醇)∶V(冰醋酸)=3∶1)脱色并拍照[10]。GUS染色液配制如下:100 mmol/L sodium phosphate、pH=7.0,1 mmol/L 5-bromo-4-chloro-3-indolyl-β-D-glucuronide,0.5 mmol/L potassium ferrocyanide,0.5 mmol/L potassium ferricyanide,10 mmol/L Na2EDTA and 0.1%Triton X-100。用透明剂(V(水)∶V(甘油)∶V(乳酸)∶V(苯酚)=1∶1∶1∶2)处理拟南芥幼苗后,放在Zeiss荧光实体显微镜下进行观察。
2 结果与分析
2.1 ThZFL基因转烟草的非生物胁迫分析
2.1.1 盐胁迫下转基因烟草种子发芽率
将种子种在含有200 mmol/L NaCl的培养基上培养7 d后,统计其发芽率,结果如表2和图1A。非胁迫条件下,野生型和转基因烟草种子的发芽率几乎都为100%,差异不大。200 mmol/L NaCl胁迫后,发芽率差异较大。转基因烟草种子各株系发芽率降低,为60%左右,而野生型烟草种子的发芽率降到10%左右。以上结果表明,ThZFL基因的过表达提高了转基因烟草种子的抗盐能力。

表2 ThZFL转烟草种子发芽率
2.1.2 盐胁迫下转基因烟草离体叶片生长情况
将转基因烟草叶片在含有200 mmol/L NaCl的分生培养基上培养,1个半月后观察的结果如图1B。野生型烟草在胁迫初期是缓慢进行分化的,但随着时间的变化,野生型烟草叶片逐渐褐化,丧失分化能力,最后死亡;而转基因烟草叶片则能在含盐的分化培养基上继续分化生长。这些结果表明,ThZFL基因的过表达提高了转基因烟草叶片的抗盐能力。
2.1.3 盐及干旱胁迫下转基因烟草植株的生长情况
转基因烟草植株在盐和干旱胁迫下的结果如图2。在200 mmol/L NaCl处理后,转基因烟草长势高于野生型一倍左右(表3),在处理40 d后,转基因烟草的叶片和茎比野生型烟草鲜艳,叶绿素含量更高;通过对根的比较发现,受胁迫后,野生型烟草的根系发育迟缓,根系不如转基因植株发达,侧根条数较少,根部出现萎蔫现象(图2A);通过胁迫后植株的鲜质量和干质量比较发现,转基因植株与野生型植株的相对含水量差异不大,但转基因株系根干质量比野生型的高2~3倍,与图2A中根系发达程度相近(表4)。干旱胁迫20 d后,转基因株系比野生型植株抗旱能力稍强一些,转基因烟草植株比野生型茁壮,叶片保绿保水程度更高一些,复水24 h后植株恢复能力更强(图2B)。以上结果说明,ThZFL基因的过表达提高了转基因烟草植株的抗盐、抗旱能力。

图1 ThZFL转烟草的盐胁迫试验

表3 ThZFL转烟草200 mmol/L NaCl处理植株长势
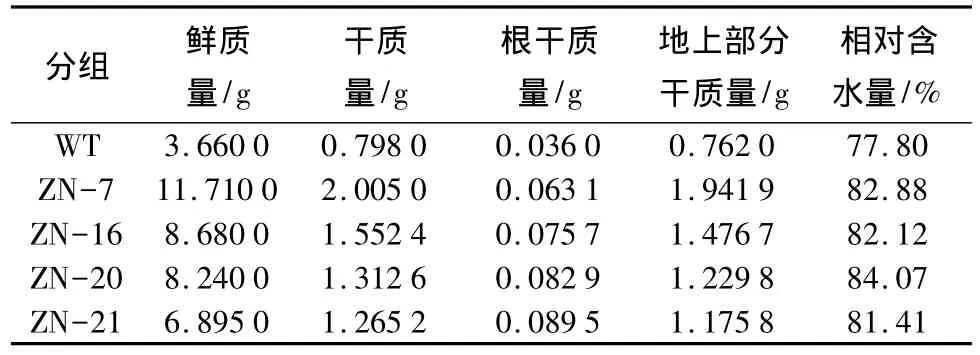
表4 ThZFL转烟草200 mmol/L NaCl处理的植株质量
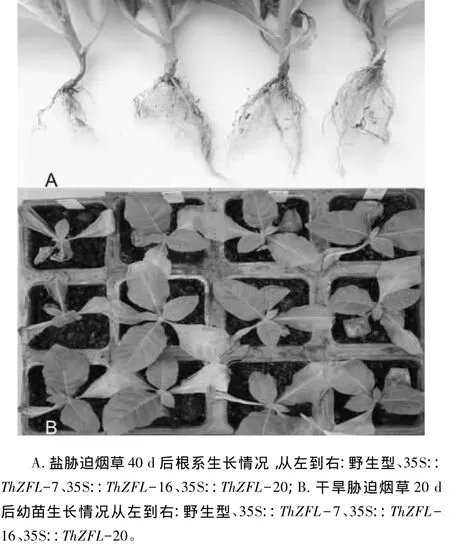
图2 ThZFL转烟草植株的胁迫试验
2.2 与ThZFL蛋白互作蛋白的筛选
诱饵 Y2Hgold(pGBKT7-ThZFL)和柽柳文库Y187(pGADT7-library)酵母杂交后,涂布TDO平板,长出单克隆后进行菌落PCR。PCR结果显示,目的基因的长度为500~1 000 bp(图3A)。然后转移到QDO/X/A平板上,初步筛选到10多个阳性克隆(图3B)。通过测序结果分析,阳性克隆多为重复序列。最后检测得到一个与诱饵(pGBKT7-ThZFL)互作的蛋白。通过酵母双杂交试验以及进一步的双杂交验证,确认这个基因是与ThZFL互作的蛋白。此基因开放读码框长度为462 bp,可预测编码153个氨基酸序列(图3C)。
2.3 ThZFL基因启动子的克隆
利用染色体步移法经过3轮PCR后,电泳检测到一条长度1 200 bp左右的片段,将该片段回收连接到pMD18-T克隆载体中,测序后通过序列比对分析,发现该序列与ThZFL基因的ORF的30个碱基序列一致,说明扩增得到的序列包含ThZFL基因的上游启动子序列。用Bioedit软件将序列拼接后,获得1 185 bp的ThZFL的启动子序列(图4)。利用PLACE 数 据 库 (http://www.dna.affrc.go.jp/PLACE/signalscan.html),对获得的 ThZFL启动子序列进行分析。ThZFL启动子含有7个元件:(1)TATA-box,RNA聚合酶Ⅱ结合的位点,是核心的启动子元件。(2)CAAT-box,可能与转录的起始频率有关,有增强基因转录的作用,是真核生物基因启动子典型元件之一。(3)ARE元件:序列中含有1个ARE元件,与厌氧诱导有关。(4)CGTCA-motif和TGACG-motif:序列中含有5个,这两种元件与茉莉酸(MeJA)诱导相关。(5)HSE元件:序列中含有1个HSE(heat stress element)元件,与热反应相关。(6)GATA-motif、GT1-motif、LAMP-element和 Sp1:都是与光作用的顺式元件。(7)TC-rich repeats:和防御与胁迫相作用的元件。

图3 酵母双杂交筛选互作蛋白

图4 ThZFL基因启动子的碱基序列
2.4 ThZFL基因启动子在拟南芥中的表达模式
将柽柳ThZFL基因启动子构建植物表达载体p1301-PThZFL-gus,用 ThZFL 启动子驱动 GUS 基因在转基因拟南芥中表达。转基因植株GUS活性检测表明:拟南芥幼苗几乎整株表达(图5A),幼嫩的叶片和茎尖分生组织表达较弱(图5B),叶脉表达强一些(图5C),而老叶中GUS活性明显减弱,同时还发现毛状体中GUS表达较强(图5D)。
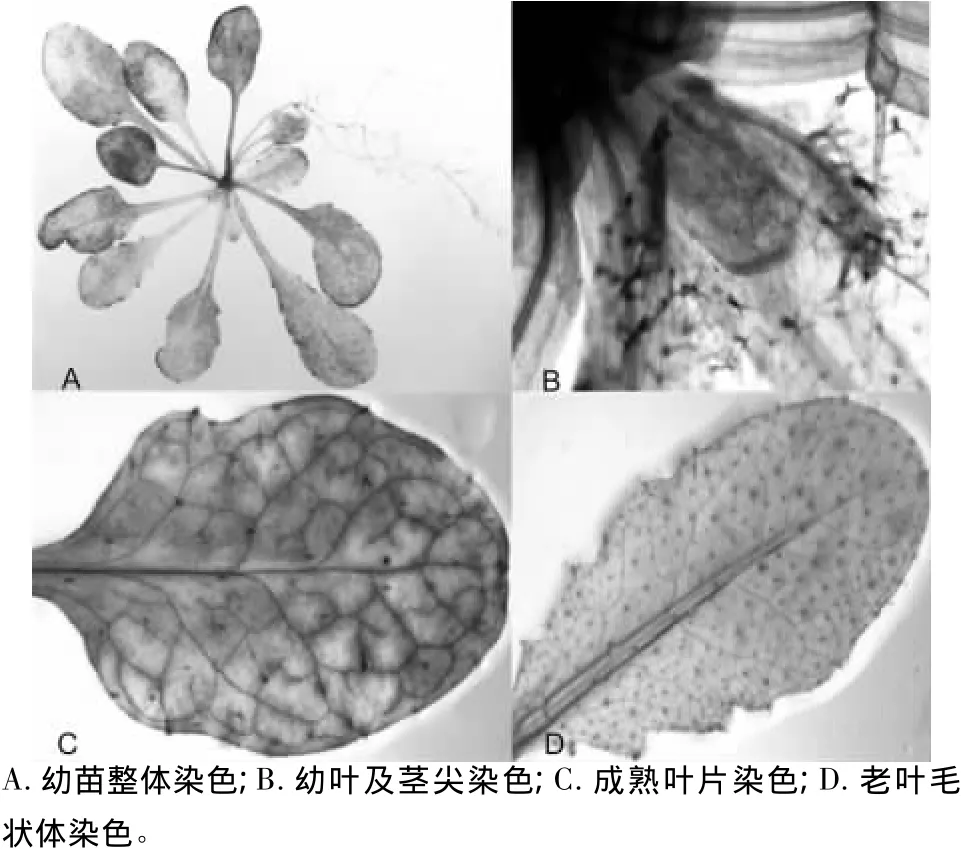
图5 ThZFL-Promotor转拟南芥植株的GUS活性检测
3 结论与讨论
柽柳生长于环境恶劣的荒漠地区,在自然选择的条件下,适应严酷条件的抗性基因得到富集与积累。例如,王玉成等[11]从柽柳中克隆到一个新的bZIP基因,在转基因烟草中能增强过氧化酶(POD)和过氧化物歧化酶(SOD)的活动,并增加可溶性糖与可溶性蛋白质的含量;Guo XiaoHong等[12]从柽柳根系盐胁迫cDNA文库中分离出一个编码冷冻适应蛋白基因ThCAP,转基因杨树对低温具有较强的抵抗能力;最新研究表明,柽柳ThVHAc1转酵母菌株能提高对盐、干旱、紫外线、氧化剂、重金属、冷冻和高温的耐性[13]。所以从柽柳基因组中探究新基因的生理功能具有重要的经济价值与生态意义。
酵母双杂交是一种简便快速研究蛋白质间相互作用的一种方法,与传统的方法相比,其最大的优势在于不用分离纯化蛋白质,而是将所研究的基因置于真核酵母细胞体内表达目的蛋白,从而为蛋白的功能修饰提供一个场所。研究中从柽柳cDNA文库中筛选出一个与ThZFL基因互作的基因序列,该基因也未见报道,其基因的功能将在以后进一步深入研究。
目前锌指蛋白基因主要应用于植物抗旱、耐盐、抗冻以及抗病研究上。Kim等[14]从大豆中克隆了一个锌指基因ZPT223,然后转染拟南芥和烟草后,能显著提高转基因植物抗干旱胁迫能力;Mukhopadhyay等[15]也从水稻中克隆了一个锌指基因OSISAP1,转基因烟草同样表现出对干旱、盐渍的抗性增强。Sakamoto等[16]克隆了拟南芥锌指基因AZF1、AZF2、AZF3,发现这些基因在干旱、高盐、冷和外源ABA的诱导下表达量增高。ThZFL基因启动子驱动GUS基因表达,GUS活性显示:该启动子的表达部位在幼苗的整体、叶脉和毛状体中表达显著,但在茎尖生长点处表达微弱,推测ThZFL基因主要在成熟组织中发挥抗逆作用。
试验结果显示,转柽柳ThZFL基因烟草对盐渍、干旱等非生物胁迫具有显著的增强效果,说明该基因可能参与植物逆境胁迫调节。尽管ThZFL基因的同源基因在拟南芥中被标注为锌指基因,但实际上柽柳ThZFL基因完全不属于锌指蛋白基因家族,而是一个新基因[3]。
因为自然环境的原因,我国干旱、盐碱地面积广大,严重制约着农业、林业的发展。研究表明,植物抗盐机制是错综复杂的,是受植物多基因控制的[17],因此柽柳ThZFL基因在生物工程中作为一个优良的抗性基因,在农业、林业中或许可以起到重要的作用。
[1]Bosabalidis A M,Thomson W W.Ultrastructural development and secretion in the salt glands of Tamarix aphylla L.[J].Journal of Ultrastructure Research,1985,92(1/2):55-62.
[2]Thomson W W,Platt-Aloia K.The ultrastructure of the plasmodesmata of the salt glands of Tamarix as revealed by transmission and freeze-fracture electron microscopy[J].Protoplasma,1985,125(1/2):13-23.
[3]Seong E S,Wang M H.A novel CaAbsi1 gene induced by earlyabiotic stresses in pepper[J].Biochemistry and Molecular Biology,2008,41(1):86-91.
[4]Liu Qinglin,Xu Kedong,Ma Nan,et al.Isolation and functional characterization of DgZFP:a gene encoding a Cys2/His2-type Zinc finger protein in chrysanthemum[J].Japanese Journal of Applied Physics,2010,37(2):1137-1142.
[5]Ham B K,Park J M,Lee S B,et al.Tobacco Tsip1,a DnaJ-type Zn finger protein,is recruited to and potentiates Tsi1-mediated transcriptional activation[J].The Plant Cell,2006,18(8):2005-2020.
[6]An Yan,Wang Yucheng,Lou Lingling,et al.A novel Zinc-finger-like gene from Tamarix hispida is involved in salt and osmotic tolerance[J].Journal of Plant Research,2011,124(6):689 -697.
[7]郑唐春,王英,臧丽娜,等.柽柳类锌指基因ThZFL酵母诱饵表达载体的构建及其表达验证[J].东北林业大学学报,2011,39(12):(4-7,15).
[8]Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochem Bull,1987,19(1):11-15.
[9]Clough S J,Bent A F.Floral dip:A simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J].Plant Journal,1998,16(6):735-743.
[10]Jefferson R A,Kavanagh T A,Bevan M W.GUS fusions:β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].Embo Journal,1987,6(13):3901-3907.
[11]Wang Yucheng,Gao Caiqiu,Liang Yenan,et al.A novel bZIP gene from Tamarix hispida mediates physiological responses to salt stress in tobacco plants[J].Journal of Plant Physiology,2010,167(3):222-230.
[12]Guo Xiaohong,Jiang Jing,Lin Shijie,et al.A ThCAP gene from Tamarix hispida confers cold tolerance in transgenic Populus(P.davidiana × P.bolleana)[J].Biotechnology Letters,2009,31(7):1079-1087.
[13]Gao Caiqiu,Wang Yucheng,Jiang Bo,et al.A novel vacuolar membrane H+-ATPase c subunit gene(ThVHAc1)from Tamarix hispida confers tolerance to several abiotic stresses in Saccharomyces cerevisiae[J].Japanese Journal of Applied Physics,2011(2),38:957-963.
[14]Kim J C,Lee S H,Yoo C M,et al.A novel cold-inducible zinc finger protein from soybean,SCOF-1,enhances cold tolerance in transgenic plants[J].The Plant Journal,2001,25(3):247 -259.
[15]Mukhopadhyay A,Vij S,Tyagi A K.Overexpression of a zincfinger protein gene from rice confers tolerance to cold,dehydration and salt stress in transgenic tobacco[J].Proc Nati Acad Sci USA,2004,101(16):6309-6314.
[16]Sakamoto H,Maruyama K,Sakuma Y,et al.Arabidopsis Cys2/His2-type zinc-finger proteins function as transcription Repressors under drought,cold,and high-salinity stress conditions[J].Plant Physiol,2004,136(1):2734-2746.
[17]Sairam R K,Tyagi A.Physiology and molecular biology of salinity stress tolerance in plants[J].Current Science,2004,86(3):406-421.
