柑橘溃疡病菌快速诊断胶体金速测卡的研制
2012-02-28殷幼平吴瑜佳王中康
殷幼平, 吴瑜佳, 于 红, 李 蒙, 王中康
(重庆大学生物工程学院基因研究中心,重庆 400030)
柑橘溃疡病(Citr us bacterial canker disease,CBCD)是一种由柑橘黄单胞菌(Xanthomonas citri pv.citri,Xcc)所引起的,危害全世界柑橘种植业最严重的检疫性细菌病害[1]。该病能侵染多种芸香科植物,包括柑橘属的绝大多数商品化栽培品种。此病主要随罹病种苗等繁殖材料远距离传播,发病严重时往往导致树势衰退,枯枝落叶、果实上布满病斑、品质变劣甚至未熟先落,严重影响柑橘的产量和质量。由于抗病品种和特效药剂的匮乏,对于感病植株仍然沿用挖除病树集中烧毁的铲除方法。目前对该病的防控主要依靠加强植物检疫检测,早期诊断病害,切断传播途径。目前,常用的针对柑橘溃疡病的检测方法主要包括免疫检测和分子检测,免疫检测主要有酶联免疫吸附法(ELISA)和斑点免疫结合法(DIA),分子检测主要包括常规PCR检测和荧光定量 PCR检测[2-3],其中 ELISA 检测和 DIA检测操作步骤繁琐、检测时间较长,常规PCR检测和荧光定量PCR检测虽然灵敏度较高,但需要专门的仪器设备,这几种检测方法都无法适应基层检验检疫部门的需要。随着我国经济快速发展,柑橘产品的调运和交换更加频繁,人为传播的危险性急剧加大,在这样的形势下迫切需要更加快速简便的病害现场诊断方法。胶体金免疫技术(ICG)是以胶体金作为示踪标记物[4-6],应用于抗原抗体反应的一种新型免疫标记技术。胶体金溶液是指分散相粒子直径在1~150 n m之间的金溶胶颗粒,依据颗粒大小的不同颜色呈橘红色到紫红色。胶体金颗粒能迅速而稳定地吸附生物大分子,而不改变其生物活性,它可以作为探针进行细胞表面和细胞内精确定位;也可以用于日常的免疫诊断。其优点是快速、灵敏、特异性强、稳定性好,且操作简便、无需任何仪器设备,结果判断直观可靠、易被基层人员掌握等。因而在电镜[7-8]、免疫印迹[9-10]、体外诊断 试 剂 盒[11-13]的 制 造、药 物 残 留[14-16]、临 床 诊断[17-18]等领域都得到了广泛应用。胶体金免疫层析技术应用于植物病害检测起步虽晚,但作为一种新型的免疫研究技术发展很快,具有极大的发展潜力和应用前景。利用胶体金示踪结合电镜技术探讨植物病害感病致病机理方面:利用该方法研究过水稻内生细菌、玉米矮花叶病毒、甜菜坏死黄脉病毒的侵染部位、葡萄扇叶病毒移动蛋白、稻瘟病附着胞的形成和穿透过程[19-21]。在植物病害检测方面,出现了黄龙病菌胶体金快速诊断试剂盒[22];魏梅生[23-24]利用胶体金免疫层析法检测马铃薯X病毒和马铃薯Y病毒以及烟草环斑病毒,随后又进一步开发银加强法。本研究针对现有检测技术难以应用于基层、田间柑橘溃疡病菌诊断的缺陷,利用重庆大学基因工程研究中心前期筛选的多克隆抗体、重组抗体,制备并比较单抗与它们实际应用特性,在前期建立溃疡病菌的胶体金快速诊断方法基础上[25],首次研发了具有自主知识产权的柑橘溃疡病菌快速诊断胶体金速测卡,为柑橘溃疡病菌的诊断提供一种简便、快速、特异、实用的检测方法。
1 材料与方法
1.1 主要试验材料
重组抗体Xcc-dsf v工程菌株由本实验室前期构建[26-28]。碱性磷酸酶标记羊抗鼠抗体、牛血清白蛋白BSA、聚乙二醇PEG20000购于北京鼎国生物技术有限公司。硝酸纤维素膜AE99、玻璃纤维膜Ahlstrom8964、纯棉垫Rapid27及CF6均购自上海捷宁生物科技有限公司。
1.2 抗体制备
单克隆抗体制备工作主要由上海吉尔生化公司完成;重组抗体 Xcc-sc-dsfv为本实验室前期构建[22];多克隆抗体采用Xcc菌悬液免疫家兔的抗血清提纯所得。
1.3 抗体特性评价及筛选
对获得的3类4株抗体:单克隆抗体Xcc-2D6、Xcc-2D8;多克隆抗体 Xcc-pab2;重组抗体 Xcc-scdsf v,通过间接ELISA方法进行特异性、灵敏度和稳定性评价。最终筛选两株最优抗体进行胶体金速测卡的研发。
1.3.1 特异性测试
采用抗原菌Xcc及10株供试菌种,均稀释成A600=0.5的菌悬液,采用间接ELISA方法分别包被96孔酶联板上,1%BSA-PBS封闭后每孔加入100μL PBS稀释的纯化抗体,浓度10 ng/μL,37℃孵育1 h。洗脱后加入用PBS 1∶1000倍稀释的碱性磷酸酶标记的二抗抗体,37℃孵育1 h[29]。p NPP显色,酶标仪405 n m读数。分别测试几种抗体与各个菌种的结合能力。该试验重复3次以保证结果的真实可靠。
1.3.2 灵敏度测试
将抗原菌Xcc菌悬液稀释成A600=0.5,分别将4株抗体用PBS按照1∶1000倍开始等比例稀释到1∶256 000倍,采用上述相同的间接ELISA方法,分别测试4株抗体与抗原菌Xcc特异性结合的灵敏度。该试验重复3次以保证结果的真实可靠。
1.3.3 稳定性测试
将分装好的4株抗体(用PBS 1∶1000倍稀释)于4℃冰箱中分别放置30、60、90、120、150、180 d后取出,间接ELISA方法测试各个时间段下4株抗体与抗原菌Xcc的结合能力。该试验重复3次以保证结果的真实可靠。
1.4 胶体金的制备
吸取浓度为1.67 mg/mL氯金酸原液6.11μL,加入100 mL超纯水中配制成0.01%的氯金酸,在磁力搅拌器上加热直至煮沸;迅速加入1.8 mL 1%柠檬酸三钠,继续加热3~5 min,溶液变为鲜亮的酒红色,停止加热,冷却至室温全波长扫描鉴定金颗粒大小及均一度。定容到100 mL,置4℃密封保存备用。
1.5 金标抗体的制备
1.5.1 胶体金颗粒与抗体结合最适p H范围
用0.l mol/L的 K2CO3溶液和0.5 moL/L的HCl调节胶体金溶液的p H 分别为5.0、5.5、6.0、7.0、7.5、8.0、8.5、9.0、9.5;分别加入20μg的标记抗体混匀制成金标抗体稳定30 min后分别加入0.l mL 10%的NaCl,1500 g离心,测上清在520 nm处的光密度。
1.5.2 胶体金颗粒最适加入抗体标记量
0.1 mol/L K2CO3或0.1 mol/L HCl调节胶体金溶液p H至标记最适结合p H。将调好p H的胶体金溶液分装10管,每管1 mL。加入标记抗体使每管浓度依次为5、10、15、20、25、30、35、40、45、50 mg/mL。对照管加1 mL稀释液(不含抗体蛋白),混匀。静置稳定30 min后,在上述各管中加入0.1 mL 10%的Na Cl溶液,混匀后静置2 h,测上清在520 n m处的光密度。
1.5.3 金标抗体的制备及纯化
用0.1 mol/L K2CO3调节30 mL胶体金溶液至最适合p H 10.0~10.5,磁力搅拌器匀速搅拌,缓慢滴加标记抗体Xcc-2D8,继续搅拌40 min;加入10%BSA溶液,使终浓度为1%,静置1 h;加入1%PEG20000,使终浓度为0.1%,静置40 min;金标抗体4℃15 000 r/min离心30 min;收集管静置底可流动的暗红色沉淀于保存液[30]中,4℃保存。
1.6 速测卡的组装及结果判定
依次将硝酸纤维素膜、金标垫、吸水垫、样品垫粘贴在底板上,裁剪成0.4 c m×5.5 c m的速测卡,包被塑料卡套,放入铝箔袋中,加入干燥剂,密封4℃保存。
检测滴加待测样液60~80μL到加样区,5 min后观察结果。若仅出现质控C线未见检测T线则说明样品为阴性;若同时出现质控C线和检测T线则说明样品为阳性;若无条带或仅出现检测T线未见质控C线则说明检测结果无效。显色过程应该在5~10 min中内完成,超过规定时间所得结果不具有参考价值。
1.7 速测卡性能分析及评价
1.7.1 速测卡特异性分析
采用抗原菌Xcc以及其他植物病原菌、柑橘伴生菌及常见细菌共10株供试菌种,分别稀释成高浓度菌悬液(A600=0.5,约1×108cf u/mL),滴管吸取60~80μL分别滴加到加样区,5 min后观察并记录结果,验证胶体金速测卡的特异性效果。该试验重复3次保证结果的真实可靠。
1.7.2 速测卡灵敏度分析
将抗原菌Xcc稀释成10倍梯度,即1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101cf u/mL的菌悬液。滴管吸取60~80μL分别滴加到加样区,5 min后观察并记录结果,测试胶体金速测卡的菌悬液最低检测下限。该试验重复3次。
1.7.3 速测卡稳定性分析
将同批制作的胶体金速测卡分若干份,密封干燥储存在4℃冰箱中。于7、15、30、60、90、180 d时取出,检测抗原菌Xcc菌悬液 (A600=0.5,约1×108cf u/mL),验证胶体金速测卡的保存稳定性。该试验重复3次。
1.7.4 速测卡批间重复性检测
随机抽取5个批次的胶体金速测卡,分别测试Xcc菌悬液(阳性对照)、样品稀释液(阴性对照)、显症叶片浸出液,每个样本重复3次,判断速测卡是否存在批次间差异。
1.7.5 与q PCR法结果一致性分析
q PCR与速测卡检测模板均为柑橘样品无菌水浸泡液。本实验室前期建立qPCR方法检测来自重庆忠县、巫山、渝北、江津等地区的206份柑橘送检样本,每个样本重复3次。对该206份送检样品的浸泡液分别滴加60~80μL到加样区,5 min后观察并记录结果,每个样本重复3次。统计两种方法所得结果。
2 结果与分析
2.1 抗体特性评价及筛选
2.1.1 抗体特异性测试
采用ELISA方法验证单克隆抗体、多克隆抗体及重组抗体的特异性,以植物病原细菌、柑橘组织内生菌、常见细菌作对照。结果显示单克隆抗体(Xcc-2D6和Xcc-2D8)与抗原菌Xcc有很好的结合活性,对其余10种对照细菌无结合能力,特异性最好。多克隆抗体(Xcc-Pab2)、重组抗体(Xcc-sc-dsf v)与抗原菌Xcc有很好的结合活性,对其余10种对照细菌无明显结合能力,特异性较好。
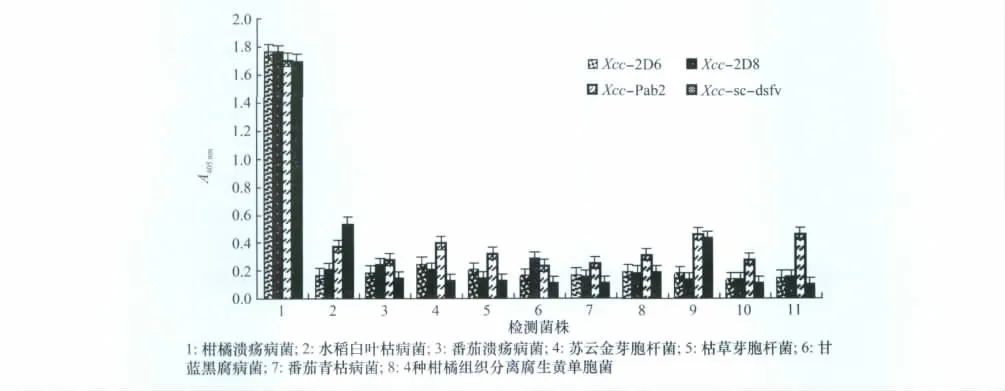
图1 各抗体特异性测试结果
2.1.2 抗体灵敏度测试
抗体的灵敏度直接影响胶体金速测卡的测试性能,为验证抗体灵敏度,将单克隆抗体、多克隆抗体、重组抗体从1∶103倍开始等比例稀释到1∶106倍,用ELISA方法验证各稀释度的抗体与抗原菌抗原菌Xcc的结合能力。结果显示各种抗体在稀释1∶16 000~1∶32 000范围内结合能力下降最快。单克隆抗体Xcc-2D6对抗原菌Xcc的结合能力达到1∶256 000倍;单克隆抗体Xcc-2D8对抗原菌Xcc的结合能力达到1∶128 000倍;多克隆抗体Xcc-Pab2对抗原菌Xcc的结合能力达到1∶128 000倍;重组抗体Xcc-sc-dsf v对抗原菌Xcc的结合能力达到1∶64 000倍。
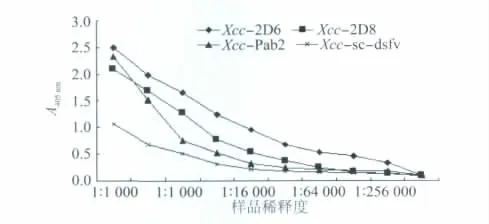
图2 各抗体灵敏度
2.1.3 抗体稳定性测试
抗体的稳定性是衡量胶体金速测卡成功与否的另一重要标准,间接ELISA方法分别测试30、60、90、120、150、180 d时单抗、多抗、重组抗体在低温下长时间放置后与抗原菌Xcc结合能力的变化。结果显示抗体在低温下放置结合能力没有出现陡然下降的现象;稳定性从大到小依次为单克隆抗体Xcc-2D8>单克隆抗体Xcc-2D6>多克隆抗体Xcc-pab2>重组抗体Xcc-sc-dsf v;放置180d后单克隆抗体Xcc-2D8的活性仍保持50%,单克隆抗体Xcc-2D6活性保持40%,多克隆抗体Xcc-pab2和重组抗体Xcc-sc-dsf v的活性仅存20%以下。
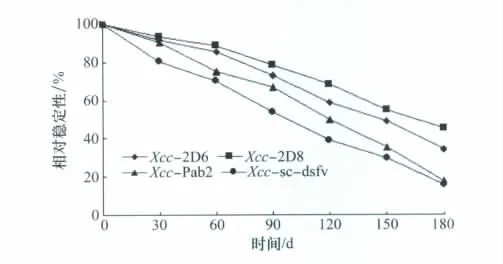
图3 各抗体稳定性
根据3项性能评价,杂交瘤细胞制备的单克隆抗体Xcc-2D8和Xcc-2D6性能相对较优,为后续胶体金速测卡的研究提供一定参考。
2.2 胶体金颗粒的制备
制备好的胶体金颗粒呈鲜红透亮状态,在室温下放置能稳定保持该状态。用全波长紫外分光光度计扫描测得它的最大吸收波长Amax=520.324 n m,在该处的光密度为A520=0.597 8。
2.3 金标抗体的制备及纯化
2.3.1 胶体金颗粒与抗体结合最适p H范围
p H值直接影响金标抗体的结合稳定性。根据测试各p H梯度下金标抗体结合物的吸光值,结果显示标记p H值与抗体相关,不同抗体的最适p H值不同,多克隆抗体Xcc-pab2的最适标记p H为8.0~8.5范围内,单克隆抗体 Xcc-2D8和Xcc-2D6的最适标记p H为10.0~10.5范围内,在此范围p H值下金标抗体的光密度最大,说明抗体与胶体金颗粒的吸附最为稳定。
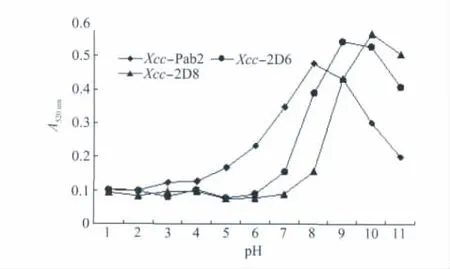
图4 不同p H下各抗体标记胶体金溶液的最大吸光度值
2.3.2 金标抗体最适标记量
抗体标记量是直接影响金标抗体的结合稳定性的另一关键因素。测试各抗体浓度梯度下金标抗体结合物的吸光值,结果显示20 mg/mL以上抗体加入量能保证与胶体金颗粒稳定吸附,并抵抗高盐离子的加入。
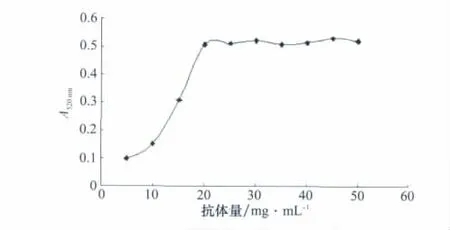
图5 标记不同量抗体后胶体金溶液的最大吸光度值
2.4 速测卡性能评价
2.4.1 速测卡特异性测试
对照菌选取了植物病原菌水稻白叶枯病菌(Xanthomonas or yzae pv.or yzae)、番 茄 溃 疡 病 菌(Clavibacter michiganensis subsp.michiganensis)、甘蓝黑腐病菌(Xanthomonas campestris pv.campestris)及番茄青枯病菌(Ralstonia solanacear um),4种从柑橘组织分离的伴生菌(鉴定为黄单胞菌属Xanthomonas)以及常见细菌苏云金芽胞杆菌(Bacillus thuringiensis)、枯草芽胞杆菌(B.subtilis)、大肠杆菌(Escherichia coli)
速测卡测试结果显示:测试Xcc速测卡为阳性,其余11种菌种的速测卡阴性,质控线(C线)显色证明结果可靠。特异性检测时供试菌悬液浓度偏高(A600=0.5),8、9号速测卡检测伴生黄单胞菌时检测线(T线)隐约显色,但对照12号Xcc速测卡检测线颜色明显偏淡,该现象为细菌浓度过高出现的轻微堆积现象,而不是抗原抗体特异性反应的正常显色。
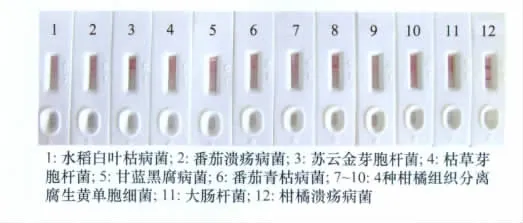
图6 速测卡测试Xcc以及其他11种常见菌种
2.4.2 速测卡灵敏度检测
将Xcc菌悬液从1×108cfu/mL稀释到1×101cfu/mL,用速测卡测试。根据结果,免疫金层析速测卡能够检测1×103~1×104浓度的Xcc菌悬液。
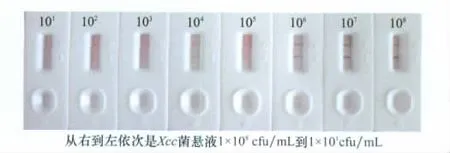
图7 速测卡灵敏度检测结果
2.4.3 速测卡批间重复性检测
随机5个批次速测卡测试Xcc菌悬液 (阳性对照)、样品稀释液(阴性对照)、病叶浸出液,每个样本重复3次,观察并统计结果。随机5个批次速测卡对Xcc菌悬液(阳性对照)、样品稀释液(阴性对照)、显症叶片浸出液检测结果经统计:5个批次速测卡测试结果一致,无批间差异。
2.4.4 速测卡与q PCR方法检测结果比较
对206份柑橘样品的检测结果发现:206份样品中q PCR法检出阳性样本为66个,阴性样本140个;胶体金速测卡法检出阳性样本为56个,阴性样本150个。两组方法测试结果差异存在于10份无病症携带微量柑橘溃疡病Xcc样本,此种样本q PCR法检出为阳性,胶体金速测卡法检出为阴性。对所有qPCR法检出为阴性的样本,胶体金速测卡法检出亦为阴性,与q PCR法结果无差异。
经计算两种检测方法结果如下。
符合率kap pa值=(56+140)/(56+0+10+140)×100%=95.15%;
速测卡阳性检出率=56/(56+10)=84.85%;
速测卡阴性检出率=140/(140+0)=100%。

表2 速测卡与qPCR实测柑橘送检样品汇总表
3 讨论
3.1 胶体金颗粒的制备
在制备前必须对所有玻璃仪器进行清洁处理,并酸化硅化。因为金颗粒外层所带的等量负电荷保证胶体的稳定,也是它们能与抗体蛋白稳定吸附的重要因素。任何微量的电解质都可能破坏胶体金溶液的带电环境,影响金标抗体的稳定性,所以要特别注意避免微量污染,在每次使用前都要对玻璃仪器进行彻底的清洗,并用三蒸水冲洗数次。
本试验采用的胶体金大小为30n m左右。不同大小的金颗粒应用到胶体金速测卡上产生的效果截然不同,根据免疫层析的原理,检测线及质控线的显色是由于金颗粒的堆积形成的。金颗粒粒径过大容易在检测线处堆积;然而粒径过小,大量的金不容易封闭完全,剩下的位点会吸附其他待测样品,也容易产生假阳性结果,胶体金颗粒的大小直接影响显色效果,因此在试验中要对所制备胶体金颗粒的大小进行鉴定。均匀度不好的胶体金颗粒会出现聚集成黑色大颗粒沉淀的现象,在制备金标抗体时离心的过程中出现挂壁的现象。
3.2 金标抗体最适p H
新制备的胶体金溶液的p H在5.5左右,放置一段时间其p H不会发生变化。当标记抗体蛋白后,由于抗体蛋白的带电作用,要调整溶液的p H值,使金颗粒与抗体蛋白稳定的结合。本试验中发现最适p H应该是一个p H范围而非准确值,每株抗体的最适标记p H范围均不同,多克隆抗体Xccpab2的最适标记p H为8.0~8.5范围内,单克隆抗体Xcc-2D8和 Xcc-2D6的最适标记p H 为10.0~10.5范围内,因此每使用一株抗体都要进行最适p H的分析。一个有趣的现象是:在非最适p H时抗体蛋白会与胶体金颗粒聚集沉淀,但当抗体失去生物活性后金颗粒又会重新悬浮起来,恢复鲜红透亮的稳定胶体状态,其p H也回到了最初的范围(5.5左右)。
3.3 测试卡性能评价
前期同类产品[25]检测下限在1×106cf u/mL。本研究制备的胶体金免疫层析速测卡用于检测柑橘溃疡病菌灵敏度高,检测下限为1×103~1×104cfu/mL,较之前灵敏度得到了很大的提高。采用画线而非点滴的方式固定检测线和指控线,速测卡背景降低,外观上有了较大的改进。
由于柑橘溃疡病是植物细菌性病害,因此选择了其他植物致病菌、从柑橘组织中分离的伴生菌以及环境中常见的细菌来检测特异性,速测卡无交叉反应,特异性的效果理想。
与目前最灵敏稳定的q PCR方法比较,结果一致性达到了95.15%。主要差异存在于10份无病症携带微量柑橘溃疡病Xcc样本,此种样本q PCR法检出为阳性,胶体金速测卡法检出为阴性。q PCR方法的检测灵敏度在1×101~1×102cf u/mL,微量的细菌靶DNA能够在q PCR反应体系中扩增并放大信息。而胶体金速测卡的显色原理是由抗体结合待测样品中的细菌,并在检测线抗体的拦截堆积下形成显色条带,待测样品中的细菌不能自行扩增,所以细菌的量是造成最后显色深浅的直接因素。细菌浓度过低,截留效果不明显,检测线所显色的结果就会显得模棱两可,需要进一步采用其他方法进行判别。但是目前的检测下限在实际应用中已经可以对大部分样品进行初步诊断,对于少数结果不太有把握的样本送检相关检测机构,工作量已经大幅度的减少,为基础检验检疫工作提供了一定的帮助。
4 结论
本研究利用免疫学技术所研发柑橘溃疡病菌胶体金速测卡灵敏度下限1×103~1×104cfu/mL,快速,特异性强,效果稳定,操作简便,结果直观,与常规qPCR方法的检测结果一致性高(kappa值=95.15%),具有一定的实用效果,基本满足柑橘实际样品的柑橘溃疡病的快速诊断检测要求,达到向基层推广使用,克服现有技术缺陷的研究目的。
[1] Gott wald T R,Graham J H,Schubert T S.Citr us canker:The pat hogen and its i mpact planthealth progress[J/OL].Plant Health Progress,2002.http://hdl.handle.net/10113/11855.
[2] 王中康,孙宪昀,夏玉先,等.柑桔溃疡病菌PCR快速检验检疫技术研究[J].植物病理学报,2004,31(1):14-20.
[3] 殷幼平,黄冠军,赵云,等.柑桔溃疡病菌实时荧光定量PCR检测与应用[J].植物保护学报,2007,34(6):607-614.
[4] Fowler J.Pr otein staining and i mmunodetection using colloidal gold[M]//The Pr otein Pr otocols Handbook,1996:275-287.
[5] Link S.Size and temperat ure dependence of the plasmon absor ption of colloidal gold[J].Phys Che m,1999,103:4212-4217.
[6] 冯娟,陈义平,王志亮.胶体金的应用研究新进展[J].中国动物检疫,2005(7):23-25.
[7] Chap man H N,Fu J,Jacobsen C,et al.Dar k-field X-ray microscopy of i mmunogold-labeled cells[J].Micr oscopy Society of Amercian,1996,2(2):53-62.
[8] Slot J W,Geuze H J.Sizing of protein a-colloidal gold probes for i mmunoelectr on micr oscopy[J].The Jour nal of Cell Biology 2005,90(2):533-536.
[9] Hillyer J F,Albrechty R M.Correlative instru mental neutron activation analysis,light microscopy,transmission electron microscopy,and X-ray microanalysis for qualitative and quantitative detection of colloidal gold spheres in biological speci mens[J].Microscopy and Microanalysis,1999,4:481-490.
[10]Liu Xueping,Wu Hui wang,Zheng Yue,et al.A sensitive electrochemical i mmunosensor for a-fetoprotein detection with colloidal gold-based dentritical enzy me complex amplification[J].Electro Analysis,2010,22(2):244-250.
[11]Tanaka R,Yuhi T,Nagatani N,et al.A novel enhancement assay for i mmunochr o matographic test strips using gold nanoparticles[J].Anal Bioanal Chem,2006,385:1414-1420.
[12]Peng Dapeng,Hu Sishun,Hua Yan,et al.Co mparison of a new gold-i mmunochro matographic assay for the detection of antibodies against avian influenza vir us with hemaggl utination inhibition and agar gel i mmunodiff usion assays[J].Veterinary Immunology and Immunopat hology,2007,117(1-2):17-25.
[13]Kolosova A Y,Du moulin F,Lewis J,et al.Lateral-flow colloidal gold-based i mmunoassay for the rapid detection of deoxynivalenol with t wo indicator ranges[J].Analytica Chi mica Acta,2008,616(2):235-244.
[14]Girotti S,Eremin S,Montoya A,et al.Develop mentof a chemilu minescent ELISA and a colloidal gold-based LFIA for TNT detection[J].Anal Bioanal Chem,2010,396(2):687-695.
[15]Zhang,M Z,Wang M Z,Chen Z L,et al.Develop mentof a colloidal gold-based lateral-flow i mmunoassay for the rapid si multaneous detection of clenbuterol and ractopamine in swine urine[J].Anal Bioanal Che m,2009,395:2591-2599.
[16]Guo Yir ong,Liu Shaoying,Gui Wenjun,et al.Gold i mmunochr o matographic assay for si multaneous detection of car bof uran and triazophos in water samples[J].Analytical Biochemistry,2009,389:32-39.
[17]Krant hi K R,Davis M,Mayee C D,et al.Develop mentof a colloidal-gold based lateral-flow i mmunoassay kit for‘qualitycontrol’assess mentof pyret hr oid and endosulfan for mulations in a novel single strip for mat[J].Crop Pr otection,2009,28(5):428-434.
[18]Ju Y,Hao H J,Xiong G H,et al.Develop mentof colloidal gold-based i mmunochro matographic assay for rapid detection of Streptococcus suis ser otype2[J].Veterinary Immunology and Immunopat hology,2010,133:207-211.
[19]李红叶,周雪平,洪健,等.葡萄扇叶病毒移动蛋白在寄主体内的动态检测和免疫金标记[J].微生物学报,2002,42(5):550-554.
[20]林福呈,李德葆.稻瘟病菌单克隆抗体2B4的研究[J].菌物系统,2002,21(2):215-222.
[21]刘云霞,张青文,周明.电镜免疫胶体金定位水稻内生细菌的研究[J].农业生物技术学报,1996(4):354-358.
[22]张景宁,刘仲健,何平,等.单抗胶体金法及PCR技术诊断柑桔黄龙病[J].中国农业科学,1997,30(5):94-96.
[23]魏梅生,李桂芬,张周军,等.胶体金免疫层析法快速检测烟草环斑病毒[J].植物检疫,2002,16(2):81-83.
[24]魏梅生.斑点免疫金和免疫金银染色法检测烟草环斑病毒[J].植物检疫,2000,14(1):1-2.
[25]李平.利用胶体金免疫层析技术快速检测柑橘溃疡病菌[D].重庆:西南大学,2006.
[26]袁青,年四季,殷幼平,等.抗柑桔溃疡病菌可溶性单链抗体的表达及鉴定[J].应用与环境生物学报,2009,15(5):626-629.
[27]陈刚,殷幼平,袁青,等.柑桔溃疡病菌重组单链抗体的高效表达及活性检测[J].微生物学报,2007,47(6):34-35.
[28]王中康,李泮志,袁青,等.柑桔溃疡病菌二硫键稳定Fv抗体基因的构建及表达产物的生物学活性分析[J].中国农业科学,2009,42(9):3123-3130.
[29]Yuan Qing,Xia Yuxian,Nian Siji,et al.Selection of single chain fragments against the phytopat hogen Xanthomonas axonopodis pv.citri by ribosome display[J].Enzy me and Microbial Technology,2007,41:383-389.
[30]Sithigorngul P,Rukpratanporn S,Pecharaburanin N,et al.A si mple and rapid i mmunochromatographic test strip for detection of pat hogenic isolates of Vibrio har veyi[J].Micr obiological Met hods,2007,71:256-264.
