运动、EGCG和肉碱对肥胖大鼠体重、内脏脂肪及肝脏CPT1表达的影响
2012-02-27魏冰白厚增靳一哲杨则宜
魏冰 白厚增 靳一哲 杨则宜
北京康比特运动营养研究所(北京100029)
近十年来,预防和控制肥胖成为全球性研究热点。目前较一致的观点是,增加体力活动与限制热量摄入的行为疗法可有效减轻体重,改善肥胖引发的代谢障碍,特别是有氧运动可以促进脂肪酸氧化供能,提高胰岛素敏感性,改善糖脂代谢,调控多种肥胖相关基因表达。但行为疗法不易长期坚持,因此需广泛探寻其他辅助减肥方法。表没食子儿茶素没食子酸酯(EGCG)作为茶多酚的主要活性物质,具有强抗氧化活性,能够有效抗肿瘤和降低心血管疾病风险[1,2],有研究表明EGCG能改善肥胖及相关代谢异常[3,4]。虽然针对EGCG单体的研究增多,但大部分关于减肥的研究仍是针对绿茶提取物或总儿茶素,绿茶提取物或总儿茶素表现出的具体效果并不能完全说明EGCG的作用[5]。左旋肉碱(LC)作为已经投放市场的“明星”减肥产品,其减肥效果有争议[6]。有研究显示,与单独使用相比,联合LC和其他天然提取物,如异黄酮、荷叶提取物等,能较好地改善肥胖机体代谢状态[7]。
肉毒碱棕榈酰转移酶1(CPT1)是脂肪酸β-氧化的关键酶,它对脂肪酸氧化的整个过程都有重要的调控作用。研究亦表明CPT1与机体脂肪沉积有一定关系[8,9],其表达水平升高有助于增加脂肪酸分解,并降低体脂肪的含量。本研究从整体水平验证运动和EGCG、LC联合对肥胖大鼠的干预效果,为肥胖的治疗和开发新型减肥产品提供依据。
1 材料与方法
1.1 实验动物与建立大鼠肥胖模型
4周龄 SPF级 Sprange-Dawley雄性大鼠 174只,体重90~110 g,由中国人民解放军军事医学科学院实验动物中心提供,许可证编号:SCXK-(军)2007-004。
大鼠适应性饲养1周后,随机选取20只为对照组,饲喂普通饲料;剩余154只为造模组,饲喂高脂饲料,周期8周。饲养环境:温度19~23℃,湿度40~60%,12h/12h昼夜交替。造模期间每周一称量体重,8周后比较两组大鼠重量变化,将高脂饲料喂养组中体重大于对照组平均体重20%的大鼠选出,作为造模成功的大鼠。
饲料由北京华阜康生物科技股份有限公司提供,辐照灭菌,许可证编号:SCXK京2009-0008。普通饲料中各营养素供能比例为20%蛋白质、70%碳水化合物、10%脂肪;高脂饲料中各营养素供能比例为20%蛋白质、35%碳水化合物、45%脂肪。
1.2 实验方法
1.2.1 动物分组
从造模成功的大鼠中随机选取50只肥胖大鼠,将其随机分为5组,每组10只,仍饲喂高脂饲料,进行减肥治疗实验。饲料配方和饲养环境同造模期。具体分组如下:肥胖对照组(F):饲喂高脂饲料,灌蒸馏水;单纯运动组(S):饲喂高脂饲料,跑台运动,灌蒸馏水;运动联合EGCG组(E):饲喂高脂饲料,跑台运动,灌EGCG;运动联合LC组(L):饲喂高脂饲料,跑台运动,每天灌LC;运动联合EGCG和LC组(EL):饲喂高脂饲料,跑台运动,灌EGCG+LC。7周后处死,检测指标。本实验在北京联合大学完成。
1.2.2 运动和EGCG、LC干预方法
(1)运动负荷方案:选择中低强度跑台训练,参照Bedford方法[10],负荷设定为16 m/min,60 min/ day,强度大约相当于58%最大摄氧量。每周运动5天,休息2天,共训练7周。第1周为适应性训练,从6 m/min、10 min开始,以2 m/min、10 min的速度递增至设定负荷。筛除不适应跑台和受伤停训过久的大鼠,每组最终保留6只。从第2周开始为正式实验阶段。
(2)给药方案:EGCG,纯度≥95%,购自浙江乾盛康药业有限公司,生产批号:EG95-00110314H。左旋肉碱酒石酸盐购自广州日康食用化工有限公司,生产批号:D030-1102010。
EGCG和LC补充量均按80 mg/kg体重计算。实验期间每日上午同一时间段内灌胃,灌胃容量为1 ml/100g体重 (体重超过500 g的大鼠灌胃容量均按5 ml配比),F组、S组的大鼠则按照1 ml/100g体重灌胃蒸馏水。
1.2.3 试剂与仪器设备
组织甘油三酯试剂盒购自南京建成公司;CPT1兔多抗购自Santa公司;TFJzol Reagent购自Invitrogen公司;SuperScriptTM III逆转录酶购自Invitrogen公司;5×RT缓冲液购自 Invitrogen公司;2.5 mM dNTP混合液购自HyTest有限公司;2X PCR master mix购自Superarray公司。
Fresco低温冷冻离心机:Thermo公司;Multi-Skan3酶标仪:Thermo公司;Mini P-4电泳槽:Cavoy公司;电泳仪:Bio-Rad公司;水平脱色摇床:其林贝尔公司;酸度计pH211:Hanna公司;电动组织匀浆器:Fluka公司;DK-8D型电热恒温水槽:上海森信实验仪器有限公司。
1.2.4 检测指标及方法
实验结束后,于最后1天训练后禁食12 h,以2%戊巴比妥钠腹腔注射麻醉,称量体重,解剖腹腔,迅速分离肝脏大叶,将取下的组织剪成小块分装入冻存管中,投入液氮冷冻,随后放入-80℃冰箱冻存待测。
内脏脂肪系数测定:分离附着于胃肠道的大网膜、肠系膜及肾周脂肪,清洗三处脂肪后用滤纸吸干,称重,内脏脂肪系数=脂肪重量(g)/体重(g)× 100。
肝脏甘油三酯(TG)水平测定:首先剪取约100 mg组织块,称重。将酶剂用10 ml缓冲液溶解,配置成工作液,静止10 min待用;根据FOLCH方法并加以改进,将甲醇、氯仿、生理盐水按6∶7∶14混合配置为抽提液。按照1 mg组织∶900 μl抽提液加入抽提液,于冰水中匀浆;将匀浆液于4度冰箱中静止12 h以上后,4000 r/min离心10 min,用移液枪小心抽取下层抽提液;在1 ml工作液中加入10 μl下层抽提液,于37度孵育10 min;孵育后3000 r/min离心10 min,取上清液迅速倒入比色杯中,于500 nm处比色,测吸光度值;根据标准曲线计算甘油三酯含量。
实时定量PCR法检测肝脏CPT1 mRNA表达:参照Trizol试剂盒(购自Invitrogen公司)说明书抽提RNA,采用琼脂糖凝胶电泳和紫外分光光度计测定总RNA的浓度和纯度,确认OD260/OD280比值范围在1.8到2.1之间。取RNA 2μg以0.5 μg/μl Oligo(dT)18为随机引物合成CDNA。采用Primer 5.0引物设计软件设计引物,PCR引物长度为278 bp,序列为:CPT1上游 5’GTGGGAGCGACTCTTCAATACT3’,下游5’CAAAATAGGTCTGCCGACACTT3’。Realtime PCR反应体系为10 μl,向前引物和反向引物(10 μM)各0.5 μl,模板2 μl,其余用无RNase水补足。反应条件为:Stage1:(1×)95℃,10 min;Stage2:(40×)Step1:95℃,10 s,Step2:60℃,60 s;Stage3:(1×)95℃,10 s,60℃,60 s,95℃,15 s;缓慢加热到99℃。以管家基因GAPDH作为内参,用样品待测基因值除以此样品内参的值,所得比值为样品待测基因的相对含量。
Western Blot法检测肝脏CPT1蛋白表达:提取NP-40法提取蛋白,在垂直电泳仪(BIO-RAD)上用相同体积的20 μg蛋白质样品经12%SDS-PAGE分离后,转移于NC膜(Millipore)上。用抗体稀释液按1∶5000稀释一抗 (Santa Cruz,Rabbit anti-mouse CPT1)。4℃孵育一抗过夜,洗涤5次,用抗体稀释液按照 1∶10000稀释二抗 (Jackson,HRP conjugated Goat anti-Rabbit IgG;HRP conjugated Rabbit anti-Goat IgG),室温孵育二抗40分钟,1×TBST充分洗涤后,使用ECL试剂盒(Santa Cruz)发光显影,X线胶片压片曝光,扫描定量各条带的相对灰度值。Total-Lab Quant软件读取IOD(积分光密度值),结果用目的蛋白积分光密度值与内参积分光密度值的比值表示。
1.3 统计学分析
采用SPSS19.0统计学软件进行检验,以平均数±标准差表示。各实验组数据采用单因素方差分析进行多个样本均数间的比较,在满足方差齐性条件下,使用LSD法进行多重比较。显著性水平为P< 0.05。非常显著水平为P<0.01。
2 结果
2.1 体重、内脏脂肪系数、肝脏TG
表1显示:S组、S+E组、S+L组、S+E+L组大鼠体重显著低于F组(P<0.05,P<0.01),S+E+L组显著低于S组(P<0.05)。S+E+L组大鼠内脏脂肪系数显著低于F组大鼠(P<0.01)。S+L组和S+E+L组肝脏TG水平显著低于F组、S组、S+E组 (P<0.05,P <0.01)。

表1 各组大鼠体重、内脏脂肪系数、肝脏TG含量比较
2.2 肝脏CPT1基因、蛋白表达
如表2所示:S组CPT1 mRNA表达与F组比较无显著差异(P>0.05),S+E组、S+L组、S+E+L组CPT1 mRNA表达均显著高于F组和S组 (P<0.05,P< 0.01)。S组CPT1蛋白量与F组比较无显著差异(P> 0.05),S+L组、S+E+L组CPT1蛋白表达较F组显著增加(P<0.05)。
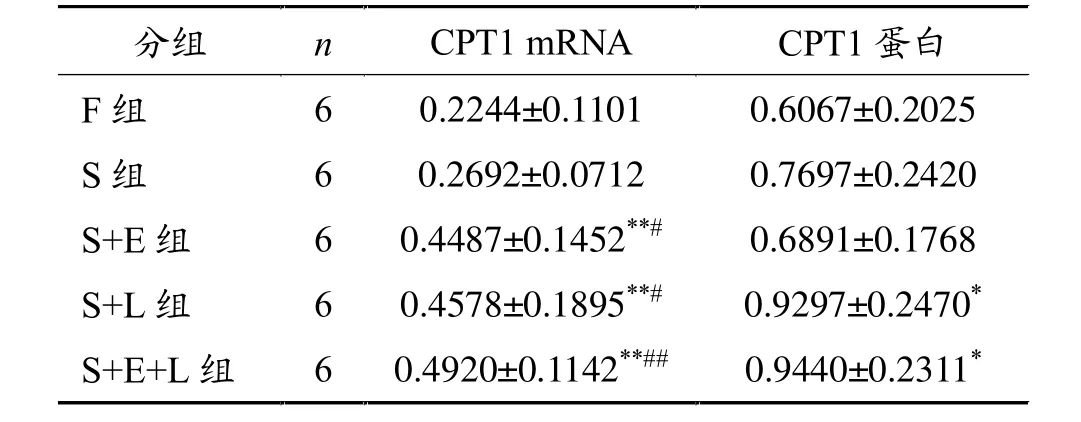
表2 不同组别大鼠肝脏CPT1 mRNA、蛋白表达水平
图1 不同组别肝脏组织CPT1蛋白表达
3 讨论
以往研究表明[11],运动训练,特别是有氧运动促进体内脂肪含量下降。另有研究证实,有氧运动可以抑制脂肪合成过程,促进异化作用[12];此外,有氧运动可以促进骨骼肌线粒体对FFA的摄入,提高线粒体β氧化相关酶表达和活性,促进脂肪分解[13]。
EGCG是绿茶茶多酚的主要组成成分。近年来的研究证明了EGCG能改善高脂饮食诱导的肥胖。EGCG能够通过刺激生热作用、促进能量消耗和促进脂肪酸氧化、减少食物的摄取,抑制3T3-L1前脂肪细胞分化等途径起到一定的减肥作用[14,15]。EGCG与运动联合对体重影响的研究较少,且存在争议[16]。
LC是体内长链脂肪酸进入细胞线粒体进行氧化的必需因子,补充LC能促进脂肪的利用,具有减肥作用。LC与运动联合对体重影响的研究比较多,国内外多项实验证明,LC在减肥过程中有良好的辅助作用[17,18]。周斅激[19]将16名肥胖女性随机分为对照组与实验组进行为期12周的减脂实验,两组每星期进行5次有氧健身操练习,每次1小时,实验组每天补充2g LC,对照组服用安慰剂。12周后,实验组与对照组相比,体重、体脂含量、血脂水平、呼吸商(RQ)等均显著下降 (呼吸商越低,燃烧的脂肪越多),说明LC能有效提高有氧运动促进肥胖女性脂肪代谢的作用,增强减肥效果。
本研究中,S组、S+E组和S+L组大鼠体重均较F组显著降低,表明有氧运动及有氧运动联合营养干预是有效的减肥手段。但S+E组、S+L组与S组相比无显著差异,S+E+L组体重较F组及S组均显著下降,各组减体重程度呈S组 本研究结果也显示,S+E+L组大鼠内脏脂肪系数较F组显著下降,说明有氧运动、EGCG、LC三者联合使用对减少内脏脂肪蓄积有明显效果。 本研究中:S+L组和S+E+L组肝脏TG含量明显低于F组、S组、S+E组,提示可以通过添加LC消除肝脏存积过多的脂肪。肝脏是脂类和脂肪的重要代谢器官,当体内缺乏LC时,会引起长链脂肪酸氧化发生障碍,也会导致脂肪在肝中过量存积而发生脂肪肝。增加LC的摄入量,可调节脂肪代谢,促进脂肪的氧化,消除体内或脏器内多余的或存积的脂肪。 CPT1是脂肪酸β-氧化的关键酶,它对脂肪酸氧化的整个过程都有重要的调控作用。有研究表明,在乳清酸引起的非酒精性脂肪肝模型中,大鼠肝脏线粒体CPT的活性明显受到抑制,且CPT1、CPT2 mRNA表达量也显著降低[20]。同时有研究表明,CPT1表达水平与体脂含量相关,表达水平升高有助于增加脂肪酸分解,降低体脂肪含量[21]。 本研究中,S组CPT1基因及蛋白与F组相比呈增加趋势,但均无显著差异,提示本研究的运动强度在一定程度提高了线粒体β氧化相关酶表达和活性。S+E组、S+L组、S+E+L组大鼠CPT1 mRNA水平显著高于F组和S组,S+L组、S+E+L组大鼠CPT1蛋白表达显著高于F组,说明EGCG、肉碱和两者合用可增强运动减肥的效果。此外,运动联合EGCG对肥胖大鼠CPT1蛋白无明显影响,因此S+L组和S+ E+L组CPT1蛋白水平改变更多依赖LC对CPT1蛋白的作用。 运动、EGCG、LC联合使用有减重、减少内脏脂肪和改善肝脏甘油三酯水平的作用,改变肝脏CPT1表达可能是其机制之一。 [1]Amin AR,Wang D,Zhang H,et al.Enhanced anti-tumor activity by the combination of the natural compounds(-)-epigallocatechin-3-gallate and luteolin:potential role of p53.J Biol Chem.2010,285(45):34557-34565. [2]Zheng J,Lee HC,Bin Sattar MM,et al.Cardioprotective effects of epigallocatechin-3-gallate against doxorubicin-induced cardiomyocyte injury.Eur J Pharmacol,2011,652(1-3):82-88. [3]Boschmann M,Thielecke F.The effects of epigallocatechin-3-gallate on thermogenesis and fat oxidation in obese men:a pilot study.J Am Coll Nutr,2007,26(4):389S-395S. [4]Lee MS,Kim CT,and Kim Y.Green tea(-)-epigallocatechin-3-gallate reduces body weight with regulation of multiple genes expression in adipose tissue of diet-induced obese mice.Ann Nutr Metab,2009,54(2):151-157. [5]Ikeda I,Hamamoto R,Uzu K,et al.Dietary gallate esters of tea catechins reduce deposition of visceral fat,hepatic triacylglycerol,and activities of hepatic enzymes related to fatty acid synthesis in rats.Biosci Biotechnol Biochem,2005,69(5):1049-1053. [6]Villani RG,Gannon J,Self M.Rich PA:L-carnitine supplementation combined with aerobic training does not promote weight loss in moderately obese women.Int J Sports Nutr Exerc Metab,2000,10:199-207. [7]Yun Jung Kim,Keun-Young Kim,Min Sun Kim.A mixture of the aqueous extract of Garcinia cambogia,soy peptide and L-carnitine reduces the accumulation of visceral fat mass in rats rendered obese by a high fat diet.Genes Nutr,2008,2:353-358. [8]Morash AJ,McClelland GB.Regulation of carnitine palmitoyltransferase(CPT)I during fasting in rainbow trout(Oncorhynchus mykiss)promotes increased mitochondrial fatty acid oxidation.Physiol Biochem Zool,2011,84(6):625-633. [9]Zhao SM,Ren LJ,Chen L,et al.Differential expression of lipid metabolism related genes in porcine muscle tissue leading to different intramuscular fat deposition.Lipids,2009,44(11):1029-1037. [10]Bedford TG,Tipton CM,Wilson NC,et al.Maximum oxygen consumption of rats and its changes with various experimentalprocedures.JApplPhysiol,1979,47(6):1278-1283. [11]张媛,漆正堂,丁树哲.运动性骨骼肌线粒体脂肪酸氧化对脂肪代谢的影响.武汉体育学院学报,2008,42(2):56-61. [12]Aoi W,Naito Y,Hang LP,et al.Regular exercise prevents high-sucrose diet-induced fatty liver via improvement of hepatic lipid metabolism.Biochem Biophys Res Commun,2011,413(2):330-335. [13]Bradley NS,Snook LA,Jain SS,et al.Acute endurance exercise increases plasma membrane fatty acid transport proteins in rat and human skeletal muscle.Am J Physiol Endocrinol Metab,2012,302(2):E183-189. [14]韩超,范小兵,王少康,等.表没食子儿茶素没食子酸酯对肥胖模型大鼠减肥作用的实验研究.现代医学,2008,36(3):197-199. [15]Bose M,Lambert JD,Ju J,et al.The major green tea polyphenol,(-)-epigallocatechin-3-gallate,inhibits obesity,metabolic syndrome,and fatty liver disease in highfat-fed mice.J Nutr,2008,138(9):1677-1683. [16]Hill AM,Coates AM,Buckley JD,et al.Can EGCG reduce abdominal fat in obese subjects?J Am Coll,2007,26(4):396S-402S. [17]张宝花.左旋肉碱对肥胖青少年体重综合性控制的影响.山西大同大学学报(自然科学版),2010,26(4):83-84. [18]Cha YS.Effects of L-carnitine on obesity,diabetes,and as an ergogenic aid.Asia Pac J Clin Nutr,2008,17(Suppl 1):306-308. [19]周斅激.L-肉碱配合有氧运动对肥胖女性脂肪代谢的影响.天津体育学院学报,2004,19(4):60-62. [20]Miyazawa S,Furuta S,Hashimoto T.Reduction of beta-oxidation capacity of rat liver mitochondria by feeding orotic acid.Biochim Biophys Acta,1982,711(3):494-502. [21]Takeuchi H,Matsuo T,Tokuyama K,et al.Effect of dietary fat type on beta-oxidation of brown adipose tissue and Na+channel density of brain nerve membrane in rats.J Nutr Sci Vitaminol(Tokyo),1996,42(2):161-166.4 总结
