2周跑台训练对大鼠空间学习和记忆能力及海马组蛋白乙酰转移酶和组蛋白去乙酰化酶活性的影响
2012-02-27单小忠李爱春
单小忠李爱春
1浙江工业大学体育军训部(杭州310014) 2浙江体育职业技术学院
规律的中等强度运动对神经系统有积极的保护作用,运动训练对改善神经系统功能和促进学习记忆的能力有显著效果[1]。海马是在学习记忆中神经系统的关键部位。运动可诱导海马多种基因表达,其中有些与学习和记忆有关,如脑源性神经营养因子(BDNF)等。但目前对于运动的神经保护作用的分子机制仍知之甚少。
近年来,表观遗传学研究发现,在基因组中除了DNA和RNA序列以外,还有许多调控基因的信息,即这些调控因素可在不改变DNA序列的情况下改变基因表达,这种现象已经出现在多种发育和精神疾病中,其机制主要是染色质的构型重建,进而改变了基因的转录[2]。在表观遗传学研究的诸多形式中,组蛋白的共价修饰占重要地位,与基因的表达调控密切关联,包括磷酸化、乙酰化、甲基化修饰等。组蛋白乙酰化及去乙酰化修饰是最重要的方式,是调控基因表达最主要的驱动力,组蛋白乙酰化是迄今研究最广泛的翻译后修饰行为,且已被证明与转录活性的增强有关[3],而去乙酰作用具有转录抑制作用[4]。上述可逆的动态修饰由组蛋白乙酰基转移酶(HAT)和组蛋白去乙酰化酶(HDAC)共同催化,共同控制染色质各区域核心组蛋白的乙酰化程度。HAT将乙酰基结合于组蛋白的氨基末端,促使染色体解聚,激活转录;而HDAC可分离组蛋白氨基末端的这些乙酰基,封闭DNA,进而抑制转录过程。研究显示,组蛋白的乙酰化程度与学习记忆和神经系统的保护作用密切相关,其主要机制为HAT促进组蛋白乙酰化和相关基因的转录,进而促进学习记忆和神经保护作用;而HDAC促进组蛋白去乙酰化,抑制相关基因转录,进而降低神经系统的功能[5]。
运动训练明显增加组蛋白乙酰化水平。Collins等[6]研究发现,表观遗传学研究在心理应激和运动激活大鼠脑中相关基因转录的过程中也有重要作用,运动训练增加海马组蛋白H3乙酰化水平。目前认为,运动训练诱导海马齿状回组蛋白H3乙酰化水平与c-Fos基因表达有关[7]。本实验观察了跑台训练对大鼠空间学习和记忆能力的作用,以及运动前后海马HAT和HDAC活性的变化。
1 材料和方法
1.1 实验动物及分组
3周龄清结级SD雄性大鼠48只,购自浙江省医学科学院,体重(65.30±7.26)g,采用普通饲料和自由饮水条件下适应性饲养5天,然后随机分为安静组(n=24)和训练组(n=24)。两组大鼠每日提供足够食物,自由饮水,环境温度(20±2)℃,每天明暗周期各12小时。每周记录大鼠体重。本实验在浙江省医学科学院完成。
1.2 运动方案
本实验跑台训练方案以Arida等[8]和Brooks等[9]关于大鼠最大摄氧量的测定结果为依据,稍作改进,跑速采用先增再保持而后递减的方式,以减小大鼠对跑步的不适应。具体方案如下:训练组大鼠每天晚上在跑台上运动30 min,速度和时间依次为8 m/ min×3 min、10 m/min×3 min、15 m/min×18 min、10 m/ min×3 min、8 m/min×3 min,共2周。安静组大鼠每天同一时间段放在跑台上30 min,不开动跑台。
1.3 空间学习和记忆行为检测
在训练的最后三天检测大鼠学习和记忆行为,利用Morris水迷宫对大鼠进行定位航行实验,分别测试各组大鼠找到平台的时间,即潜伏期;利用Morris水迷宫对大鼠进行空间探索实验,分别测试各组大鼠在各象限游泳时间百分比和穿过原平台位置的次数。
Morris水迷宫及其附件由上海倍曼生物科技公司生产,直径120 cm,高50 cm,水深40 cm,水温保持(25±1)℃。池壁上标有4个入水点,将水池等分为A、B、C及D共4个象限,在D象限正中放一个直径9 cm、高38 cm的圆形平台,平台顶低于水面2 cm。水池中倒入墨汁以掩盖圆形平台。摄像机同步记录大鼠运动轨迹,训练期间水迷宫外参照物保持不变。
(1)定位航行实验:实验前1天,将大鼠放入水中自由游泳5 min,使其熟悉实验环境。实验共进行5次,前4次训练历时2天完成,每天上、下午两个时间段分别对每只大鼠从4个位于不同象限的入水点放入水池训练各1次,记录大鼠找到平台的时间,即潜伏期。若一只大鼠在120 s找不到平台,即将其引上平台,潜伏期记为120 s。每次训练每只大鼠从4个不同入水点训练的潜伏期的算术平均值作为该次的学习成绩。
(2)空间探索实验:在第3天的第5次训练时,撤除圆形平台,然后任选一个入水点将大鼠放入水中,记录其在120 s内在各象限的游泳时间百分比及120 s内穿越原平台相应位置的次数。
1.4 海马HAT与HDAC活性检测
1.4.1 测试样本的制备
分别于运动组大鼠最后一次训练结束后即刻、1 h和6 h,断颈椎处死安静组和运动组各8只大鼠,迅速取出海马并放于液氮中速冻,然后放于-80℃冰箱保存。测试时,将海马和裂解液以1∶3的体积匀浆,缓冲液的成分为:250mM蔗糖、20mM pH 7.4的Tris-HCl、1 mM EDTA、1 mM EGTA、10 mM KCL、1 mM二硫苏糖醇、0.1 mM苯甲磺酰氟和0.1 mM冈田酸。将组织匀浆后以16000 g的速度4℃条件下离心5 min,取上清进行测试。各样本蛋白质浓度测试采用考马斯亮蓝法,以牛血清白蛋白作为标准溶液。
1.4.2 海马HAT活性的检测
组蛋白包括5种类型,分别为H1、H2A、H2B、H3和H4,组蛋白乙酰化主要发生在H3、H4的N端比较保守的赖氨酸位置上,由组蛋白乙酰转移酶和组蛋白去乙酰化酶协调进行。H3和H4的乙酰化可打开一个开放的染色质结构,增加基因表达。本研究测试组蛋白H3和H4的乙酰化程度以反映组蛋白乙酰转移酶 (HAT)活性。严格按照ELISA试剂盒(Upstate Biotechnology,Temecula,CA,USA公司)说明书进行检测。在酶标板中加入抗生蛋白链菌素和生物素化的组蛋白H3和H4,将免疫沉淀物加入适量缓冲液,清洗酶标板,加入α-乙酰-赖氨酸抗体作为组蛋白乙酰化探针,1.5 h后,再次清洗酶标板,向酶标板中加入TMB酶作用底物混合液,避光孵育10 min,加入硫酸终止反应。全自动定量绘图酶标仪测HAT活性,激发波长为450 nm,发射波长为570 nm,HAT活性以每毫克蛋白中含有乙酰化的组蛋白H3和H4的量表示,单位为ng acetylated histone/mg protein。
1.4.3 海马HDAC活性检测
采用试剂盒 (Upstate Biotechnology,Temecula,CA,USA)检测HDAC活性,严格按照说明书操作。将样本与分析液混合,在30℃条件下孵育45 min,然后加入活化剂,室温孵育10 min,全自动定量绘图酶标仪检测HDAC活性,激发波长为360 nm,发射波长为450 nm,HDAC活性以每毫克蛋白中含有HDAC的量表示,单位为pmol/mg protein。
1.5 统计学分析
2 结果
2.1 大鼠空间学习和记忆能力
表1显示,在定位航行实验中,随着测验次数增加,安静组和训练组大鼠潜伏期逐渐缩短。每次训练,训练组大鼠潜伏期显著短于安静组(P<0.05,P<0.01)。

表1 各组大鼠找到平台的潜伏期(s)
表2显示,在空间探索实验中,安静组和训练组大鼠在D象限的游泳时间百分比长于在其他象限;其中,训练组大鼠在D象限的游泳时间百分比显著长于安静组(P<0.01)。安静组在120秒时间内穿越原平台位置的次数为 (11.52±1.19)次,训练组为(18.79±2.33)次,显著高于安静组(P<0.01)。

表2 各组大鼠在各象限的游泳时间百分比(%)
2.2 大鼠海马组织HAT和HDAC活性
由表3可知,训练组大鼠海马HDAC活性在最后一次跑台训练后即刻和1 h显著低于安静组(P< 0.01),训练后6 h与安静组无显著性差异。训练组大鼠海马乙酰化组蛋白H4在最后一次跑台训练后即刻和1 h显著高于安静组(P<0.01),训练后6 h与安静组无显著性差异。各时段训练组海马组蛋白H3乙酰化水平与安静组无显著性差异(P>0.05)。
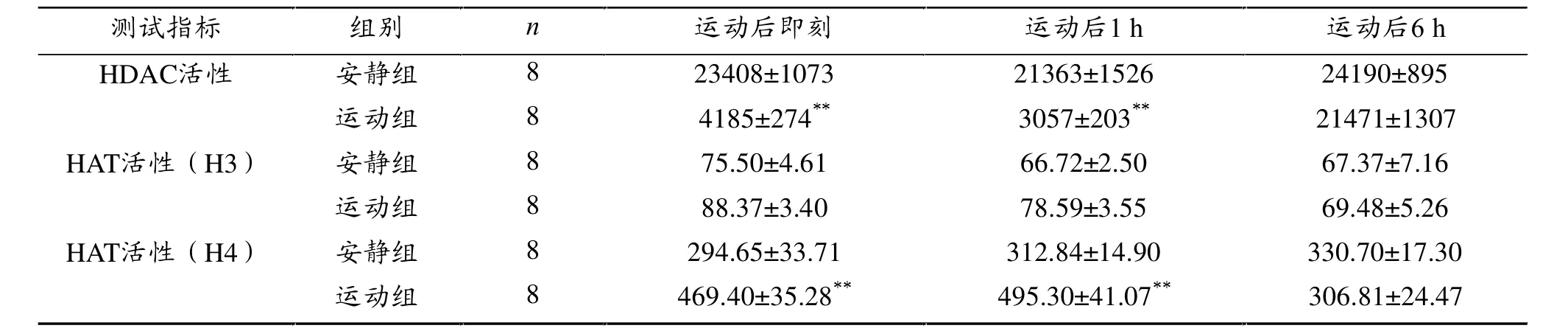
表3 两组大鼠海马HDAC和HAT活性比较
3 讨论
3.1 跑台运动对大鼠空间学习和记忆能力的影响
规律的运动训练可有效阻止神经退行性疾病的发生并促进其恢复。并且,运动显著降低中风的发病危险。流行病学研究表明,中等强度体育运动有明显的神经保护作用,且对实验模型的研究表明,运动可以减少局部和全脑缺血诱导的神经元损伤[10]。近来,Scopel等[11]的研究表明,连续2周中等强度运动可以显著减少Wistar大鼠由于局部缺血造成的海马损伤。学习和记忆是脑的高级神经活动,既是认知活动的组成部分,也是重要的智力因素。运动可以在某种程度上增进或改善脑的学习和记忆功能。海马神经元是维持学习、记忆功能的物质基础。多项试验结果表明[12],运动训练可促进海马神经元再生和神经营养性细胞因子表达等,有关运动促进海马神经元的功能及其分子机制已成为运动和生物学领域研究的热点。
本研究结果显示,随着测验次数的增加,通过学习大鼠找到平台的速度越来越快,训练组大鼠学习能力表现比安静组更好;两组大鼠对于先前学习的原平台位置均有良好的记忆,训练组大鼠记忆能力优于安静组。这与以往有关运动促进学习记忆和神经保护的多项研究结果相吻合[12,13]。
3.2 跑台训练对大鼠海马HAT和HDAC活性的影响
通常情况下,HAT/HDAC比值相对稳定,但在一些退行性神经疾病中,HAT/HDAC比值下降导致组蛋白去乙酰化,影响相关基因的转录。因此,HAT活性增强和HDAC活性降低可通过增强组蛋白乙酰化程度而提高学习与记忆能力。目前关于运动训练对神经组织中组蛋白乙酰化程度影响的研究较少,其研究结果也不太一致。部分研究结果显示,运动训练可以提高神经组织中组蛋白的乙酰化水平以及神经营养因子的表达,如Tajiri等[14]的研究结果表明,随意运动通过表观遗传学机制增加BDNF表达水平,并增加组蛋白H3乙酰化水平和BDNF第五启动子区域的DNA甲基化水平。Scopel等[11]的研究也表明,跑台训练可以保护大鼠局部缺血的海马的完整性。但也有研究结果和上述矛盾,如Gomez-Pinilla等[15]研究显示,运动训练后大鼠海马HDAC5 mRNA表达水平显著下降,从而降低海马组织中组蛋白的乙酰化水平。本研究结果显示,跑台运动后即刻和运动后1小时,大鼠海马组织HAT活性显著升高而HDAC活性显著降低,这说明急性运动可增强组蛋白乙酰化。而本研究未发现跑台训练增加海马组蛋白H3乙酰化水平,这可能与动物训练周期、运动强度等因素有关,具体机制有待更多的研究数据证实。
值得注意的是,本研究中,运动诱导的组蛋白乙酰化的增强作用,即HAT活性增强和HDAC活性降低,仅表现在运动后较短的时间内,这种组蛋白乙酰化效应在运动后6 h则消失。这和以往的某些研究结果一致。Chandramohan等[16]研究表明,游泳运动的增加组蛋白乙酰化效应在运动后4 h可被明显检测到,但在运动后24 h则消失。McGee等[17]研究发现,人类骨骼肌在急性运动后即刻组蛋白乙酰化作用显著增强,而随后则逐渐减弱。Federman等[18]研究发现,螃蟹脑中组蛋白磷酸化水平在训练后1 h显著升高,而在训练后6 h恢复到基础水平。另外,利用HDAC抑制剂产生的组蛋白乙酰化效应也在干预后1 h达到峰值,之后逐渐减弱[19]。综合以上研究结果,虽然急性运动可导致大鼠海马组织短时HAT活性升高和HDAC活性降低,而2周的跑台训练并未导致大鼠海马组织HAT和HDAC活性显著变化。这提示,急性运动诱导的大鼠海马组织HAT和HDAC活性的短时变化和2周跑台训练造成的大鼠空间学习和记忆能力的提高不能构成直接的因果关系,运动训练促进空间学习和记忆能力的提高还涉及到其他更多的分子机制。另外,本研究中,大鼠跑台训练的周期为2周,而更长周期的跑台训练能否引起大鼠在安静状态时海马组织HAT和HDAC活性显著变化,仍需要进一步实验证实。
4 总结
2周跑台训练显著提高大鼠空间学习和记忆能力。急性运动后大鼠海马组织短时HAT活性升高和HDAC活性降低,而2周跑台训练未导致安静时大鼠海马组织HAT和HDAC活性显著变化。
[1]Cassilhas RC,Lee KS,Fernandes J,et al.Spatial memory is improved by aerobic and resistance exercise through divergent molecular mechanisms.Neuroscience,2012,202:309-317.
[2]MacDonald JL,Roskams AJ.Epigenetic regulation of nervous system development by DNA methylation and histone deacetylation.Prog Neurobiol,2009,88(3):170-183.
[3]Choi JK,Howe LJ.Histone acetylation:truth of consequences?Biochem Cell Biol,2009,87(1):139–150.
[4]Kouzarides T.Chromatin modifications and their function. Cell,2007,128(4):693-705.
[5]Sleiman SF,Basso M,Mahishi L,et al.Putting the'HAT' back on survival signalling:the promises and challenges of HDAC inhibition in the treatment of neurological conditions.Expert Opin Investig Drugs,2009,18(5):573-584.
[6]Collins A,Hill LE,Chandramohan Y,et al.Exercise improves cognitive responses to psychological stress through enhancement of epigenetic mechanisms and gene expression in the dentate gyrus.Pub Lib Sci,2009,4(1):11-16.
[7]Sng JC,Taniura H,Yoneda Y.Histone modifications in kainate-induced statusepilepticus.EurJNeurosci,2006,23(5):1269-1282.
[8]Arida RM,Scorza FA,dos Santos NF,et al.Effect of physical exercise on seizure occurrence in a model of temporal lobe epilepsy in rats.Epilepsy Res,1999,37(1):45-52.
[9]Brooks GA,White TP.Determination of metabolic and heart rate responses of rats to treadmill exercise.J Appl Physiol,1978,45(6):1009-1015.
[10]Ahlskog JE.Does vigorous exercise have a neuroprotective effect in Parkinson disease?Neurology,2011,77(3):288-294.
[11]Scopel D,Fochesatto C,Cimarosti H,et al.Exercise intensity influences cell injury in rat hippocampal slices exposed to oxygen and glucose deprivation.Brain Res Bull,2006,71(1-3):155-159.
[12]Ericksona KI,Michelle W.Voss MW,Prakashd RS,et al. Exercise training increases size of hippocampus and improves memory.PANS,2011,108(7):3017-3022.
[13]Alaei H,Moloudi R,Sarkaki AR,et al.Daily running promotes spatial learning and memory in rats.Pathophysiology,2007,14(2):105-108.
[14]Tajiri N,Yasuhara T,Shingo T,et al.Exercise exerts neuroprotective effects on Parkinson's disease model of rats. Brain Res,2010,1310(1):200-207.
[15]Gomez-Pinilla F,Zhuang Y,Feng J,et al.Exercise impacts brain-derived neurotrophic factor plasticity by engaging mechanisms of epigenetic regulation.Eur J Neurosci,2011,33(3):383-390.
[16]Chandramohan Y,Droste SK,Arthur JS,et al.The forced swimming-induced behavioural immobility response involves histone H3 phospho-acetylation and c-Fos induction in dentate gyrus granule neurons via activation of the N-methyl-D-aspartate/extracellular signal-regulated kinase/mitogen-and stress-activated kinase signalling pathway.Eur J Neurosci,2008,27(10):2701–2713.
[17]McGee SL,Fairlie E,Garnham AP,et al.Exerciseinduced histone modifications in human skeletal muscle.J Physiol,2009,587(Pt 24):5951–5958.
[18]Federman N,Fustinana MS,Romano A.Histone acetylation is recruited in consolidation as a molecular feature of stronger memories.Learn Mem,2009,16(10):600–606.
[19]Vigushin DM,Coombes RC.Histone deacetylase inhibitors in cancer treatment.Anticancer Drugs,2002,13(1):1-13.
