山奈酚对2型糖尿病大鼠糖脂代谢及胰岛素抵抗的影响
2012-02-26刘贵波刘跃光包海花于建渤
刘贵波,刘跃光,孙 成,包海花,于建渤
(牡丹江医学院,1.解剖教研室;2.病理教研室,黑龙江牡丹江,157011)
2型糖尿病也称为成人发病型糖尿病,多在35~40岁之后发病,病患体内产生胰岛素的能力并非完全丧失,但胰岛素的作用效果却大打折扣,因此患者体内的胰岛素处于一种相对缺乏的状态[1]。2型糖尿病是一种内分泌代谢紊乱疾病,可通过口服降糖药或药物刺激胰岛素分泌进行治疗。过氧化物酶体增殖物激活受体γ(PPARγ)能提高胰岛素敏感性、增强脂肪组织及骨骼肌葡萄糖储运的作用,被广泛地应用于糖尿病治疗。本研究通过对2型糖尿病大鼠给予PPARγ激动剂山奈酚干预,检测血脂生化指标的变化,探讨山奈酚对胰岛素抵抗和糖脂代谢的影响,为2型糖尿病的治疗提供新思路。
1 材料与方法
1.1 材料
实验用清洁级雄性SD大鼠50只,体质量(200±20)g,购自牡丹江医学院实验动物中心;山奈酚(Kaempferol,KA)、链脲佐菌素(STZ)由美国Sigma公司生产;总胆固醇、甘油三酯测定试剂盒、尿素氮试剂盒和肌酐测试盒购自南京建成生物工程研究所;胰岛素放免分析试剂盒购自中国人民解放军总医院科技开发中心放免研究所。
1.2 实验方法
1.2.1 2型糖尿病大鼠模型的建立:随机取10只SD大鼠作为正常对照组给予标准饲料,其余40只给予高糖高脂饲料(在标准饲料基础上添加蔗糖、炼猪油和蛋黄),喂养4周后,高脂组腹腔注射STZ(临用前溶解在pH 4.0的0.1 mmol/L柠檬酸缓冲液内)25 mg/kg,每天1次,连续2 d,正常对照组注射等量柠檬酸缓冲液,注射药物2 d后间隔1 d检测大鼠空腹血糖(测试前禁食12 h),以血糖含量高于16.7 mmol/L为2型糖尿病大鼠模型[2],成模后各组喂以普通饲料。
1.2.2 分组给药:将高脂大鼠分为山奈酚低剂量
组(50 mg/kg)、中剂量组(100 mg/kg)、高剂量组(200 mg/kg),连续灌胃10周,每天1次,使用前,山奈酚用植物油配制成相应的浓度;正常对照组和模型组给予等剂量的植物油。因在灌胃期间少量大鼠死亡,最后统计为每组8只。
1.2.3 检测指标及方法:实验结束后大鼠禁食12 h,尾静脉取血,采用葡萄糖氧化酶法进行空腹血糖(FBG)测定,放射免疫法进行血浆胰岛素水平(FINS)测定,计算胰岛素抵抗指数(IRI),公式IRI=(FINS×FBG)/22.5;利用酶法测定血浆总胆固醇(TCHOL)、甘油三酯(TG)、尿素氮(BUN)和肌酐(Cr)含量。
2 结 果
2.1 各组大鼠血糖及胰岛素抵抗检测
采用链脲佐菌素腹腔注射加高脂高糖喂养的方法复制大鼠2型糖尿病模型,此模型具有高血糖、高胰岛素及胰岛素抵抗的特征。由表1得出,糖尿病大鼠模型组FBG、FINS和 IRI均有所增加;经KA给药治疗后,与糖尿病模型组相比,KA治疗组均可使糖尿病大鼠血糖明显降低,胰岛素抵抗指数也有所下降。
表1 山奈酚对各组大鼠FBG、FINS和IRI的影响(±s,n=8)

表1 山奈酚对各组大鼠FBG、FINS和IRI的影响(±s,n=8)
与正常对照组比较,33P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 剂量(mg/Kg) FBG(mmol/L) FINS(m IU/L) IRI正常对照组 - 5.26±0.41 23.09±0.79 5.40±0.60模型组 - 24.12±1.7333 43.36±1.7433 46.50±4.1433 KA低剂量治疗组 50 19.09±2.18# 33.85±1.25## 28.64±2.23## KA中剂量治疗组 100 13.87±1.53## 26.49±1.30## 16.35±2.22## KA高剂量治疗组 200 10.26±1.07## 24.62±0.85## 11.20±0.96##
2.2 各组大鼠血脂水平比较
各组大鼠 TCHOL和TG含量如图1所示,与正常对照组相比,模型组大鼠 TCHOL和 TG含量均显著升高,经 KA干预10周后,KA治疗组TCHOL和TG含量有所下降,且与模型组存在显著性差异。
2.3 各组大鼠血生化指标测定
对各组大鼠血尿素氮和肌酐含量进行检测,如表2所示,与正常对照组比较,模型组大鼠BUN和Cr含量均有所升高,且与对照组存在显著性差异;与模型组相比,KA治疗组BUN、Cr显著降低,肾功能明显改善。
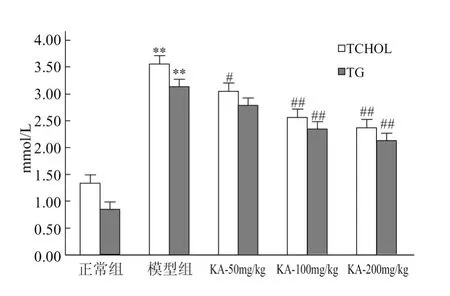
图1 山奈酚对各组大鼠TCHOL和TG的影响(±s,n=8),与正常对照组比较,33P<0.01;与模型组比较,#P<0.05,##P<0.01
表2 山奈酚对各组大鼠BUN和Cr的影响(±s,n=8)
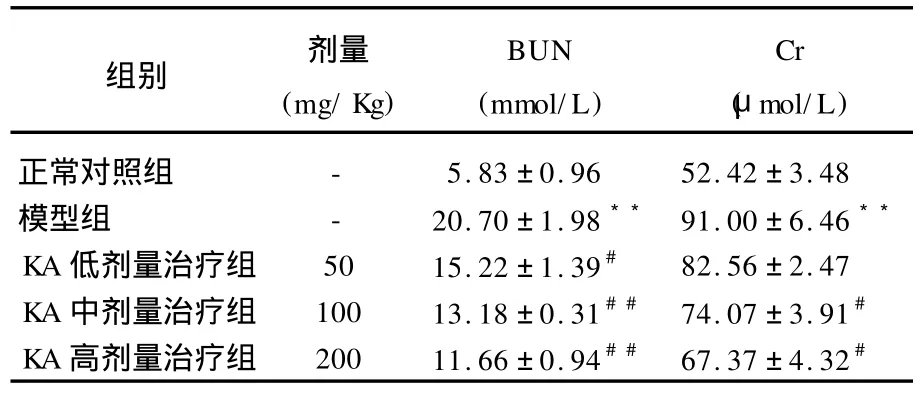
表2 山奈酚对各组大鼠BUN和Cr的影响(±s,n=8)
与正常对照组比较,33P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 剂量(mg/Kg) BUN (mmol/L) Cr (μmol/L)正常对照组 - 5.83±0.96 52.42±3.48模型组 - 20.70±1.9833 91.00±6.4633 KA低剂量治疗组 50 15.22±1.39# 82.56±2.47 KA中剂量治疗组 100 13.18±0.31## 74.07±3.91# KA高剂量治疗组 200 11.66±0.94## 67.37±4.32#
3 讨 论
2型糖尿病是一个由遗传和环境因素共同决定的多因子疾病,目前认为其病因主要是胰岛素抵抗;胰岛素抵抗是指正常数量的胰岛素不足以产生对脂肪细胞、肌肉细胞和肝细胞的正常的胰岛素响应的状况,胰岛素抵抗使肌肉、脂肪组织摄取葡萄糖能力减弱,糖原合成减少,机体对胰岛素敏感性降低,造成糖耐量异常、高血压、高胰岛素血症和脂质异常[3],因此,改善胰岛素抵抗对2型糖尿病的治疗具有重要意义。
过氧化物酶体增殖物激活受体(PPAR)作为脂肪素的感受器,在2型糖尿病中发挥重要作用,近年来,PPAR激动剂已成为脂代谢异常和2型糖尿病治疗领域中的常用药物[4-5]。PPAR是核受体家族中的成员,属于配体诱导的转录因子,目前发现 3种异形体,即 PPARα、PPARγ和PPARδ,3种异形体均可被脂肪酸和其代谢物活化,提示PPAR在调节能量平衡、糖脂代谢中起有重要作用[6-7],同时,PPARγ与其配体结合后抑制炎性介质基因转录启动,抑制STZs导致的NO等炎症分子的表达,去除NO对β细胞的损害,有利于胰岛β细胞功能恢复[8-9]。有报道表明,脂肪组织的PPARγ基因敲除导致脂肪细胞减少和肥大、血 TG升高,同时出现肝糖输出增加、肝脏 IR和脂肪肝的发生增加,而无肌肉 IR的发生[10];PPARγ激动剂人参皂苷Rb1可通过上调PPARγ2、C/EBPα的表达促进小鼠3T3 L1脂肪细胞的脂肪形成与分化,同时增加葡萄糖转运蛋白表达和胰岛素刺激的葡萄糖转运,对胰岛素有增敏作用[11]。山奈酚属于黄酮类,为中草药来源的PPARγ激动剂[12],山奈酚可明显降低非肥胖型糖尿病小鼠血糖值,对糖尿病具有治疗作用[13],同时山奈酚具有与降糖药罗格列酮作为PPARγ激动剂的功效,但其不良反应远比罗格列酮弱[14]。
本研究结果表明,经山奈酚给药处理后,各组大鼠血糖含量、胰岛素抵抗均有所降低,同时,血浆总胆固醇、甘油三酯及尿素氮、肌酐等血脂生化指标均存在下降趋势,说明山奈酚有糖尿病治疗功效,预示其有望成为新一代的胰岛素增敏剂用于2型糖尿病治疗。
[1] 迟家敏.实用糖尿病学[M].第3版北京:人民卫生出版社,2009:14.
[2] 燕 娟,郭巍伟,梁执群,等.2型糖尿病大鼠模型的建立及其验证[J].临床和实验医学杂志,2009,8(4):5.
[3] Boden G,Laakso M.Lipids and glucose in type 2 diabetes: what is the cause and effect[J].Diabetes Care,2004,27 (9):2253.
[4] Bermudez V,Finol F,Parra N,et al.PPAR-gamma ago2 nists and their role in type 2 diabetes mellitus management [J].Am J Ther,2010,17(3):274.
[5] 靳 广,魏 枫.PPARγ激动剂罗格列酮钠对2型糖尿病大鼠肾保护作用的实验研究[J].中国临床研究,2010, 23(10):845.
[6] 白秀平,李宏亮,杨文英.PPAR及其激动剂与脂肪酸代谢及胰岛素抵抗[J].国际药学研究杂志,2008,35(2): 111.
[7] 常 虹,叶山东.过氧化物酶体增殖物活化受体与糖脂代谢[J].中国临床保健杂志,2008,11(6):569.
[8] Yu J,Zhang Z,Li Z,et al.Peroxisome proliferator-acti2 vated receptor-gamma(PPAR gamma)agonist improves coronary artery endothelial function in diabetic patients with coronary artery disease[J].J Int Med Res,2010,38(1): 86.
[9] 李 霞,王安平,颜 湘,等.格列酮类药物通过PPARγ依赖性机制保护胰岛β细胞免受致病性炎症因子的破坏[J].南方医科大学学报,2010,30(7):1530.
[10] He W,Barak Y,Hevener A,et al.Adipose-specific perox2 isome proliferator-activated receptorγknockout causes in2 sulin resistance in fat and liver but not in muscle[J].Proc Natl Acad Sci USA,2003,100(26):15712.
[11] Shang W,Yang Y,Jiang B,et al.Ginsenoside Rb1 pro2 motes adipogenesis in 3T3 L1 cells by enhancing PPARγ2 and C/EBPαgene expression[J].Life Sci,2007,80(7): 618.
[12] 邱龙新,洪燕萍,张婷婷.中药来源过氧化物酶体增殖物激活受体激动剂在治疗糖尿病方面的研究进展[J].中草药,2010,41(8):1394.
[13] 梁光荣,唐 静,李国娟,等.山奈酚对非肥胖型糖尿病小鼠的治疗作用[J].中国医院药学杂志,2011,11:907.
[14] 陈育华,周克元,袁汉尧.山奈酚药效的研究进展[J].广东医学,2010,31(8):1064.
