改良脑出血评分标准在基底节出血预后评估和手术指征中的应用
2012-02-24鲁春鹤唐海涛肖玉强
鲁春鹤,赵 江,唐海涛,肖玉强,李 明,陈 刚
(大庆油田总医院 神经外科,黑龙江 大庆 163001)
中风是世界上引起老年人死亡的第二大常见原因,常常导致永久性的的残疾。在我国,约22%的老年中风是由于颅内出血(ICH)引起的。基底节脑内出血占脑内出血的50%-70%。这种深层出血比起皮质层出血更容易引起预后不良。我们对一组基底节出血的老年患者进行了前瞻性的研究,随机地把他们分为外科手术治疗组和保守治疗组,根据相关因素建立了一个新的评分标准(MICH),指导颅内出血的治疗并对预后作出判断,现报告如下。
1 对象与方法
1.1 研究对象和分组 2008年7月到2011年5月因基底节出血入住我院脑外科治疗的老年患者226名。入选标准:(1)基底节出血诊断明确,入院时间不得超过出血后的24 h。(2)出血量在10-100 ml之间。(3)年龄大于60岁。排除标准:(1)由于动脉瘤,动静脉畸形,肿瘤,脑外伤而引起的出血。(2)患者同时患有尿毒症,肝硬化,凝血障碍或者因其他原因正在进行抗凝治疗。(3)不愿意加入试验的患者。),按随机数字法将患者分为保守治疗组和手术治疗组,每组患者各113名,研究前,家属均签署了知情同意书,同时也经过了我院的伦理委员会批准。
1.2 治疗方法 保守治疗措施包括甘露醇治疗和血压监测。甘露醇脱水(3-5 ml/kg,每6 h一次),监测血压,如果动脉压大于130 mm Hg使用降压药物保持血压稳定,如果收缩压小于90 mm Hg给予升压药物。对紧张焦虑患者予小剂量安定,同时予抑酸药物防止应激性溃疡。手术治疗是在保守治疗的基础上采用内镜下血肿清除术,如果有脑室内出血或者脑积水则同时进行脑室引流术。内镜手术的入路为额部4 mm的小孔,使用内镜品牌为Karl Storz(德国Tuttlingen公司)。
1.3 观察指标 在急诊科完成GCS评分,出血量及血肿体积(计算方法为ABC/2,A为血肿最大层面的最大径,B为其垂线,C为血肿在 轴位相上的层数),结果判断包括患者6个月后的死亡率,格拉斯哥预后评分(GOS)和Barthel指数。一年后的GOS评分和Barthel指数,GOS分为5个标准:5.正常,4.轻度残疾,3.中度残疾2.重度残疾,1.死亡。Barthel指数共100分,完全残疾为0分,能完成日常生活31-32分。预后良好定义为GOS大于等于4或Barthel指数大于等于55。根据临床经验,当血肿体积大于20 ml时,颅内压会增加,建议清除血肿,而一些医生建议当血肿大于50 ml时再进行手术,因此我们把血肿体积分为3个等级:小于等于20 ml,21-50 ml和大于51 ml。根据Hemphill的研究[1],昏迷的评分标准也被分为3个等级:GCS15-13,GCS12-5和 GCS4-3。MICH 评分标准含有3个方面的内容:GCS,血肿体积和脑室内出血或者脑积水(表1),分数范围0-5分。
1.4 统计方法和评分标准建立 使用卡方测验和t检验对二组资料进行统计学测验,与预后有关的因素分析采用单因素和逐步的多因素logistic回归分析,运用受试者曲线(ROC)检验MICH对死亡率和预后判断并确定阀值。颅内出血每种治疗方式的比值比(OR)通过多重线性回归得出。比值比越大,手术治疗的优势也就越明显。

表1 一种新的颅内出血评判标准
2 结果
2.1 患者的一般临床资料(表2)。手术治疗组:平均年龄为61.5岁,平均GCS为10,IVH率为35%,保守治疗组:平均年龄为64.4岁,平均GCS为11,IVH率为28%。二组资料临床一般情况没有明显差别。
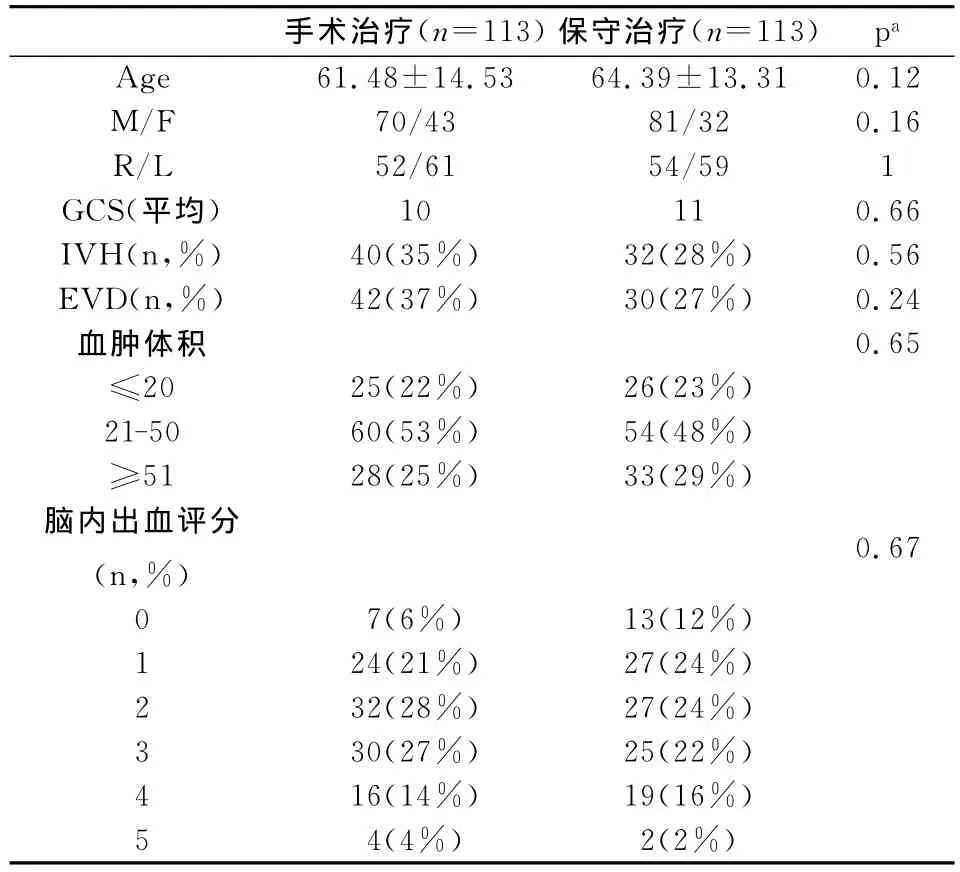
表2 患者临床资料分析
2.2 与预后有关的多因素分析及MICH评分的建立 通过对226名患者基底节颅内出血的特征进行单因素分析,来评估死亡率和预后效果,只有GCS,血肿体积和IVH这些因素与之密切相关,而年龄,性别和血肿位置与其关系并不大。同时,我们也对死亡率和预后效果进行了多因素分析,发现GCS,颅内出血量,脑室内出血或脑积水对预后和治疗具备重要意义(表3),利用这3种因素建立了一种新的MICH评分(表1)。
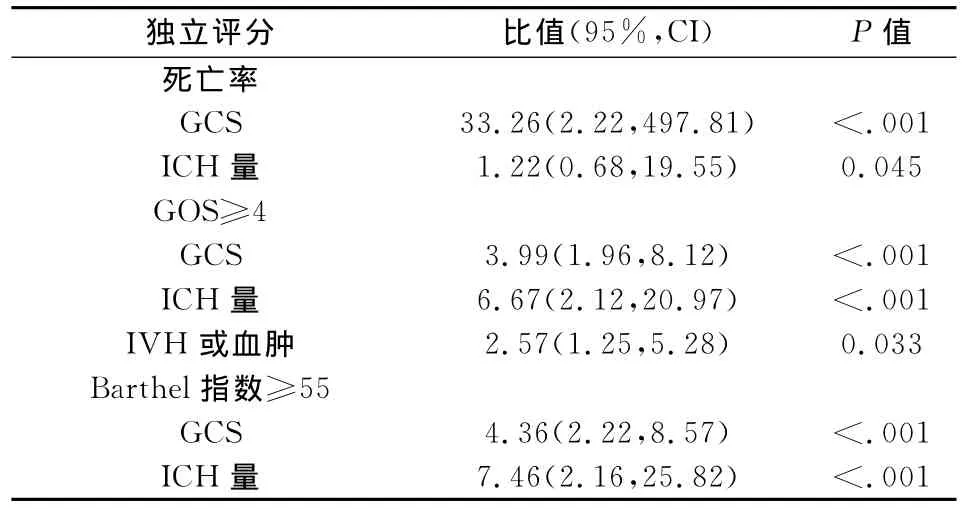
表3 与预后相关的独立多因素分析
2.3 MICH对患者预后的判断和对治疗方法的选择(表4):手术治疗组6个月的总死亡率为15.3%,保守治疗组的为22.4%。当MICH评分=0,1或2时,保守治疗和手术治疗的6个月的死亡率并没有显著差异;当MICH评分=3或4时,保守治疗的6个月死亡率明显高于手术治疗的;当MICH评分=5时,两种治疗方式下的患者均死亡。当MICH评分=3时,敏感性为76.3%,特异性为89.1%,阳性预测值为81.8%,阴性预测值为86.3%,正确指数(Youden)最高为0.66,因此 MICH预测颅内基底节出血死亡率的最佳分界点为3,此时手术治疗的比值比为6.87。MICH=2时GOS<4的Youden指数为0.78,Barthel指数<55的Youden指数为0.70,说明当MICH小于等于2时预后较好。死亡率的最域值是MICH=3,而预后效果良好的域值是MICH=2时,综合判断,当MICH位于2—4之间时适于手术治疗。
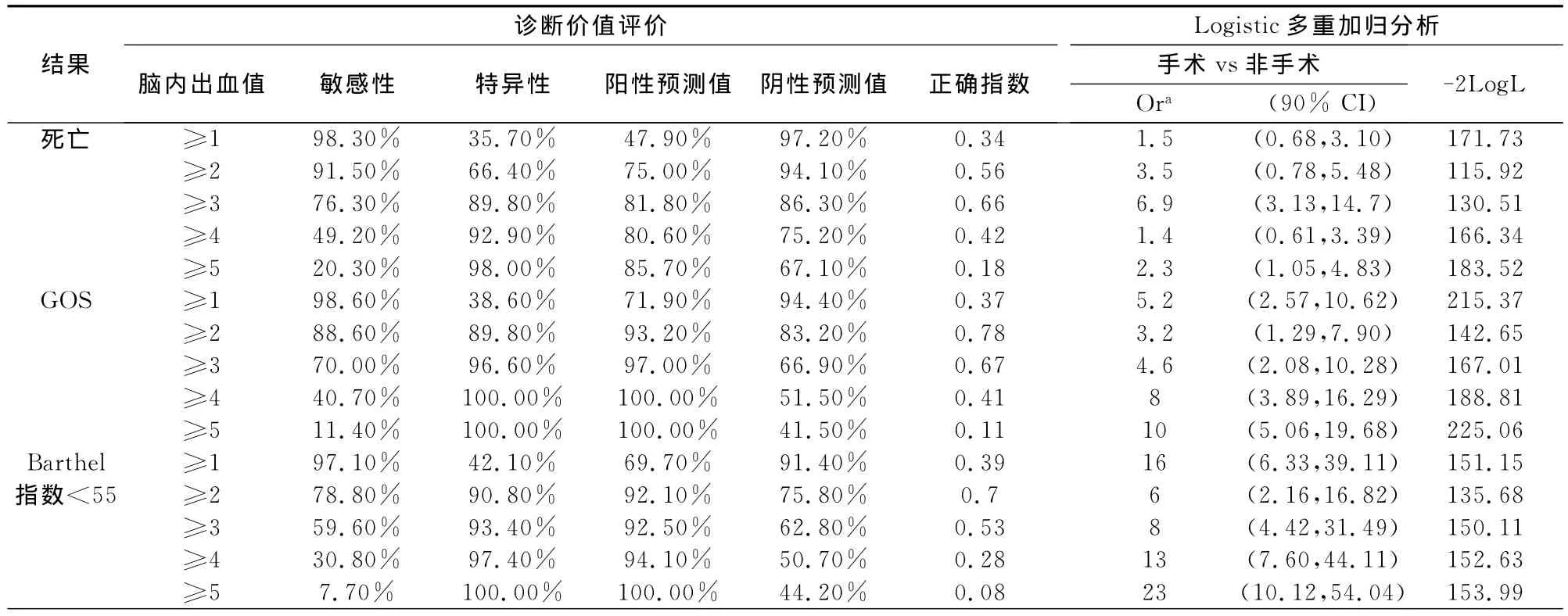
表4 MICH评分的敏感性,特异性,阳性预测值,阴性预测值,Youden指数,预后的比值
3 讨论
3.1 脑出血的评分目前临床上有很多标准,常用的有脑外伤的GCS,蛛网膜下腔出血的Hunt and Hess评分及世界神经外科医师协会评分,缺血性脑卒中的 NIHSS,动静脉畸形的Spezler-Martin评分[2]。这些标准在一定程度上预测了疾病的转归,但这些标准有的过于复杂,特别是普通缺少对临床治疗的指导意义。手术治疗特别是内镜下的血肿清除术,尤其适合于深部脑出血患者。该方法挽救了大量脑出血患者的生命,但其手术指征、操作程序需进一步规范,尤其是手术指征,目前临床上分歧较大。因此我们认为对临床有价值的评分需要达到以下目的:1、提供评价和预测标准;2、为医务工作者提供临床治疗策略选择的风险分级。通过多因素分析我们排除了年龄,性别和血肿位置等与预后相关性不大的因素,确立了GCS,颅内出血量,脑室内出血这3个和预后及治疗有意义的因素。先前的许多研究也表明[3,4]:出血量、GCS评分是脑出血预后强有力的预测因子,对判断脑出血疗效或预后具有高度准确性,被用于筛选外科手术病例。这和我们的研究结果是一致的,同时我们还发现室内出血和水肿也是影响预后听一个重要指标,特别是和手术相关,这在以前的评分标准中是缺失的[5]。在此基础上,我们通过ROC曲线分析发现,当MICH评分=3时,敏感性为76.3%,特异性为89.1%,阳性预测值为81.8%,阴性预测值为86.3%,说明当 MICH评分超过3时,颅内基底节出血死亡率会明显升高。MICH=2时GOS<4的Youden指数为0.78,Barthel指数<55的 Youden指数为0.70,说明当MICH小于等于2时说明患者预后较好。同时还可以发现,随着MICH评分增高时,采用手术治疗的优势越明显,而当MICH大于5时患者基本上全部死亡,此时不能进行手术。所以对于预后来说,特别是手术来说,最好的切入点是MICH≥2。
3.2 需要说明的是MICH评分可被重复使用,基底神经节ICH病程通常是动态的。26%的患者在24小时之内经历了再出血和血肿扩张[6]。因此,反复的头部CT和临床评估对于再次评估MICH值是必不可少的。我们的MICH评分是否还适合除了基底结出血外的其他定位,例如小脑ICH或是自发的皮质ICH;还需要其它的相关研究。我们研究的研究对象排除了<10和>100的血肿。因此我们建议MICH评分最佳使用于ICH流量从10 ml到100 ml之间的病人。我们的手术结果来自于损伤较小的内窥镜手术。手术结果可能稍稍好于传统的颅骨切开术[7,8]。尤其在手术的并发症方面。
4 结论
通过我们创建的新的MICH评分系统,MICH为0或1时的基底神经节ICH病人建议使用保守治疗。MICH≥2时建议使用手术治疗来达到良好预后效果。MICH值在3到4之间建议使用手术治疗来降低死亡率。在MICH值=5的病人中,无论使用那种治疗,病人都会死亡。因此当MICH=5时,没有手术指征。
[1]Hemphill JC,Bonovich DC,Besmertis L,et al:The ICH score:A simple,reliable grading scale for intracerebral hemorrhage[J].Stroke,2001,32(4):891.
[2]Ariesen MJ,Algra A,van der Worp HB,et al:Applicability and relevance of models that predict short term outcome after intracerebral hemorrhag[J].J Neurol Neurosurg Psychiatry,2005,76(11):839.
[3]Cho DY,Chen CC,Hesi PC,et al:Endoscopic surgery for spontaneous basal ganglia hemorrhage:Comparisons of endoscopic surgery and stereotactic aspiration and craniotomy in non-comatose patients[J].Surg Neurol,2006,65(4):547.
[4]Weimar C,Roth M,Willig V,et al:Development and validation of a prognostic model to predict recovery following intracerebral hemorrhage[J].J N eurol,2006,253:788.
[5]Delgado Almandoz JE,Yoo AJ,Stone MJ,et al.Systematic characterization of the computed tomography angiography spot sign in primary intracerehral hemorrhage identifies patients at highest risk for hematoma expansion:the spot sign score[J].Stroke,2009,40(2):2994.
[6]Hanley DF.An age old question:does size really matter?Stroke,2010,41(6)199.
[7]van Asch CJ,Luitse MJ,Rinkel GJ,et al.Incidence,case fatality,and functional outcome of intracerehral haemorrhage over time,according toage,sex,and ethnic origin:a systematic review and metaanalysis[J].Lancet Neurol,2010,9(6):167.
[8]Delgado Almandoz JE,Yoo AJ,et al.The spot sign score primary intracerehral hemorrhage identifies patients highest risk of in-hospital mortality and poor outcome among survivors[J].Stroke,2010,41(5):54.
