α硫辛酸对肥胖大鼠糖脂代谢的影响
2012-02-24闫国超秦小霞
闫国超,邵 云,秦小霞
(1.河北医科大学第一医院 检验科,河北 石家庄 050031;2.河北医科大学第一医院 超声科,河北 石家庄 050031)
随着社会的发展和生活水平的提高,尤其是饮食结构和生活方式的改变,越来越多的人正加入肥胖的行列[1],肥胖已经成为最常见的营养失衡性疾病。肥胖是糖尿病、冠心病、脑血管疾病、高血压、高脂血症等多种疾病的危险因子,在上述疾病发病中起着病因、诱因、加重或兼而有之的作用。本研究拟观察高脂饮食诱导肥胖大鼠糖脂代谢的变化及强抗氧化剂 α-硫辛酸(alpha-lipoic acid,ALA)对 其影响。
1 材料和方法
1.1 实验动物
清洁级8周龄雄性Wistar大鼠50只[购自河北医科大学实验动物中心,合格证号:1108090,许可证号SCXK(冀)2008-1-003],体重为170~190 g。大鼠同室分笼饲养,每笼5只,自然光照,自由进食和饮水。环境温度控制在(23±2)℃,湿度60%。适应性喂养1周后按体重随机分为正常对照组(NC,n=10),高脂饮食组(n=40)。正常对照组给予基础饲料(购自河北医科大学,热量组成:碳水化合物占65.5%,脂肪占10.3%,蛋白质占24.2%),高脂饮食组喂以纯合高脂饲料(购自北京博泰宏达生物技术有限公司,饲料配方主要成分:酪蛋白麦芽糊精(Maltodextrin)、蔗糖(Sucrose)、纤维素(Cellulose BW200)、豆油(Soybean Oil)、猪油(Lard)、矿物质混合物(Mineral Mix)、磷酸氢二钙(DiCalcium Phosphate)、碳酸钙(Calcium Carbonate)、柠檬酸钾(Potassium Citrate,1 H2O)、复合维生素(Vitamin Mix)、酒石酸氢胆碱(Choline Bitartrate),热量组成及具体配方参见(D12492:60%of kcal as fat;Research Diets,New Brunswick,NJ)。
1.2 实验组动物处理
高脂喂养大鼠10周后,采用Dobrian的标准,OP大鼠(obesity-prone)定义为大于对照组最重大鼠:以普通饲料喂养的正常对照组中最重的大鼠为判断标准,高于其体重的高脂饮食组大鼠有32只,将其再随机分为两组:HFD组(n=16)和实验组(HFD+ALA组,n=16)。实验组大鼠给予ALA(30 mg/kg)腹腔注射2周,硫辛酸注射液购自亚宝药业太原制药有限公司,批号:110702。HFD组、正常对照组给予等量的生理盐水注射,干预期间继续按原方法喂养。(8只肥胖抵抗大鼠亦分组处理,另文分析)。
1.3 检测指标
1.3.1 实验期间每周测体重,处死前测定体重和身长。断头处死取血后,留取大鼠脑组织、肝脏、肾脏、胰腺、血管及骨骼肌,部分取病理,其余液氮冷冻后备用;内脏脂肪(肾周脂肪+附睾脂肪)称重后留取部分组织液氮冷冻保存。
1.3.2 空腹血糖(FBG)、血脂、Hcy和FIns的测定大鼠禁食8~10hr,断头取血,静置血液15 min,离心(4000 r/min,5 min)分离血清,贮存在-40℃冰箱中备用。血糖试剂为美国贝克曼公司生产,甘油三酯(TG)、总胆固醇(TC)高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)试剂盒购自上海德赛公司;游离脂肪酸(NEFA)购自北京九强公司,仪器为美国贝克曼DXC800全自动生化分析仪。血清胰岛素(大鼠胰岛素放免试剂盒)购自美国LINCO公司,为RIA法,所用仪器为北京核海高科技有限公司生产的H6003C型放免分析仪。HOMA-IR法计算胰岛素抵抗指数(insulin resistance index,IRI),计算公式为:IRI=胰岛素(μU/m L)×葡萄糖(mmol/L)÷22.5。

表1 动物饲料配方
1.4 统计学处理方法
采用SPSS 12.0统计学软件进行数据处理。组间差异采用t检验,P<0.05为有统计学意义。
2 结果
2.1 各组大鼠一般情况
见表2。分组喂养后正常对照组、高脂组Wistar大鼠前10w的体重变化见图1。采用Dobrian的标准,成模大鼠共32只,成模率80%,平均体重为440.2±14.6 g。分组处理后,HFD组体重继续缓慢增加,12周后的末期体重为457.6±12.5 g;HFD+ALA组体重下降,末期体重为426.5±13.7 g,正常对照组末期体重为423.0±12.0 g。HFD组的体重、内脏脂肪、内脏脂肪/体重明显高于正常对照组 和HFD+ALA组。

表2 Wistar大鼠的一般情况
2.2 血清学检测结果
FBG、FIns、血脂结果见表3。从表3可知,3组大鼠FBG结果无明显差异,HFD组与正常对照组NEFA水平无明显差异(P>0.05)。HFD+ ALA组NEFA水平明显低于HFD组及正常对照组(P<0.05)。HFD组与正常对照组相比,FIns、IRI、TC、TG、HDL-C、LDL-C等明显升高(P<0.05)。HFD+ALA 组与 HFD 组 比较,FIns、IRI、TC、TG、HDL-C、LDL-C明显下降。
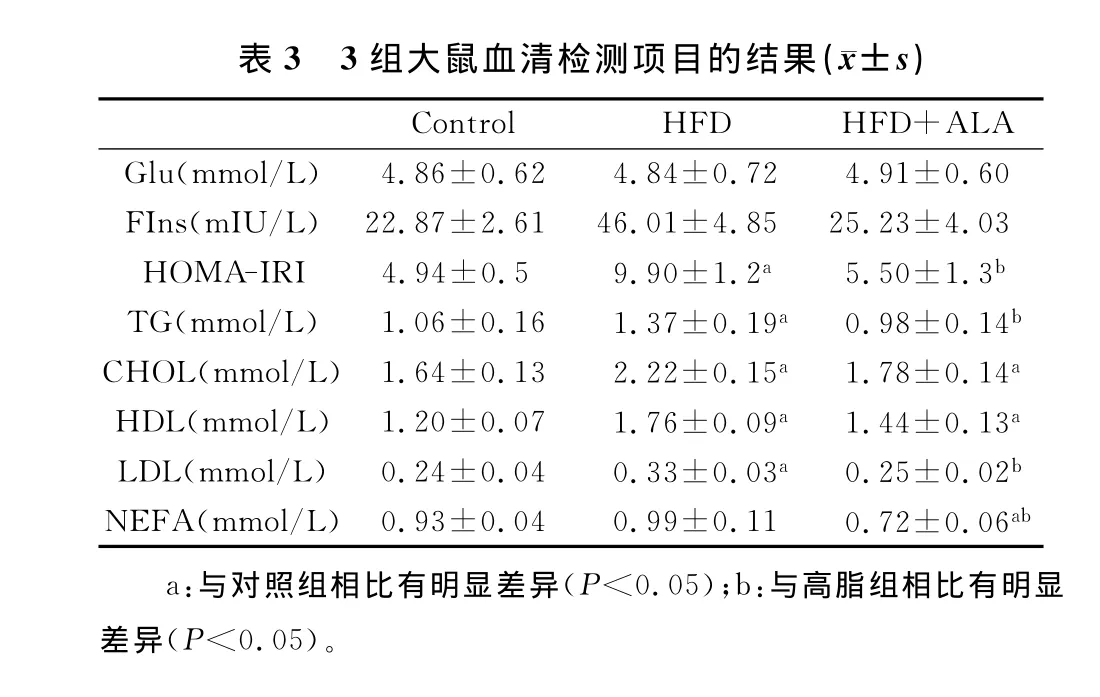
表3 3组大鼠血清检测项目的结果(±s)Control HFD HFD+ALA Glu(mmol/L)4.86±0.62 4.84±0.72 4.91±0.60 FIns(mIU/L) 22.87±2.61 46.01±4.85 25.23±4.03 HOMA-IRI 4.94±0.5 9.90±1.2a 5.50±1.3b TG(mmol/L) 1.06±0.16 1.37±0.19a 0.98±0.14b CHOL(mmol/L) 1.64±0.13 2.22±0.15a 1.78±0.14a HDL(mmol/L) 1.20±0.07 1.76±0.09a 1.44±0.13a LDL(mmol/L) 0.24±0.04 0.33±0.03a 0.25±0.02b NEFA(mmol/L) 0.93±0.04 0.99±0.11 0.72±0.06ab a:与对照组相比有明显差异(P<0.05);b:与高脂组相比有明显差异(P<0.05)。
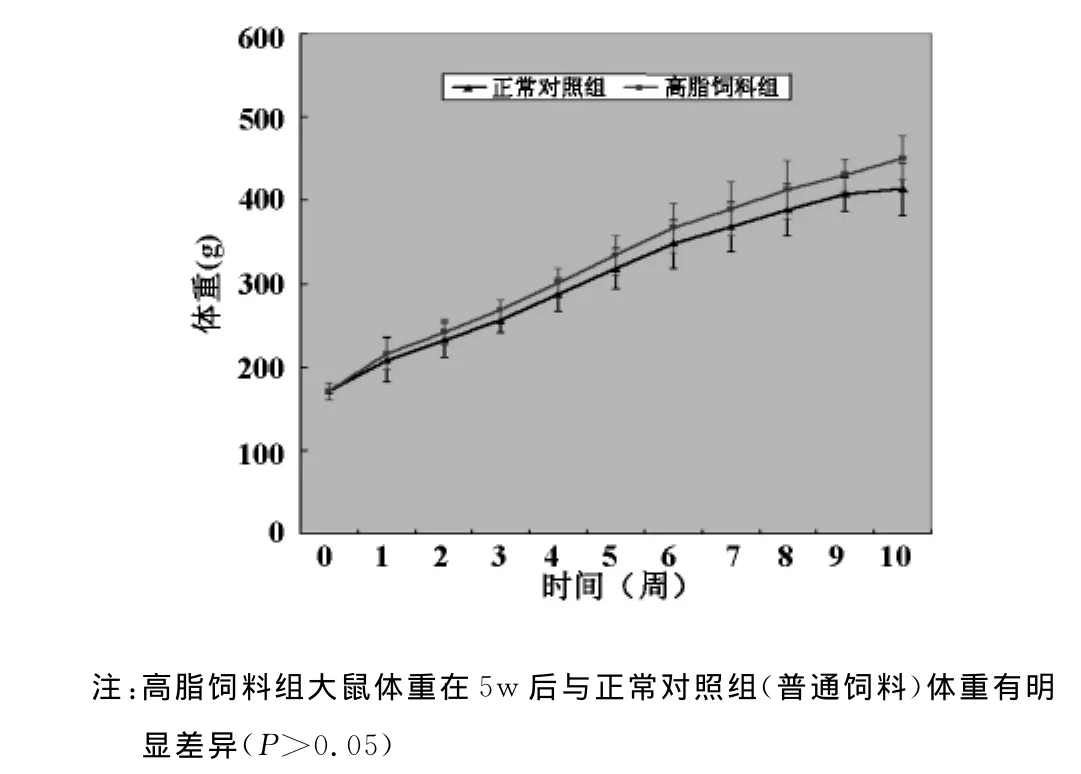
图1 高脂饲料(实验组)和普通饲料(正常对照组)喂养对大鼠体重的影响
3 讨论
氧化应激是过度饮食导致肥胖,进而发生胰岛素抵抗的代谢基础[2]。体内氧化/抗氧化系统的不平衡可使生物大分子氧化损伤增加,即氧化应激;其影响胰岛素的信号传导,导致胰岛素抵抗发生[3]。最近的研究数据支持:哺乳类骨骼肌直接暴露于氧化应激后,激活了丝氨酸激酶p38 MAPK信号传导通路,减弱了胰岛素对胰岛素依赖的信号单元刺激和葡萄糖转运[4]。氧化应激与糖尿病、肥胖、肿瘤、衰老、神经变性性疾病、高血压、凋亡、心血管疾病、心衰的发病机制有关,被认为是上述疾病的“最后共同通路”[5]。富含水果、蔬菜的饮食、补充抗氧化剂对氧化应激和胰岛素抵抗的改善有利。α-硫辛酸是丙酮酸脱氢酶复合体、酮戊二酸脱氢酶的必需辅基,均参与能量代谢。ALA和其还原形式DHLA均为强抗氧化剂,通过三方面起作用:自由基清除活力;再生其它抗氧化剂:如VitC、Vit E、谷胱甘肽;金属螯合作用。硫辛酸通过抗氧化应激、抗炎作用改善脂代谢异常,并具有胰岛素增敏作用。
本研究用高脂纯化饲料喂养没有遗传背景的Wistar大鼠,成功诱导了肥胖大鼠模型,表现为体重增加(肥胖)、内脏脂肪显著升高、存在胰岛素抵抗和血脂异常,是与人类肥胖最为接近的食物性肥胖模型,并更具可比性和良好的重复性,可很好的模拟人类不健康的生活方式[6,7]。本研究发现腹腔注射ALA(30mg/kg)后,Wistar大鼠的进食量明显减少,体重缓慢下降,而腹腔注射生理盐水的正常对照组及HFD组大鼠体重继续增加。Kim的研究认为ALA显著降低啮齿类动物体重的原因主要是由于减少了动物的进食,其机制是ALA下调了下丘脑内AMP-激活的蛋白激酶(AMPK)的活力[8]。
从本研究结果还可以看出:与HFD组相比,HFD+ALA组血脂各项指标均有下降。值得关注的是,HFD+ALA组的游离脂肪酸水平较正常对照组及HFD组均低,这可能与ALA增强脂肪酸的氧化供能有关。与HFD组相比,HFD+ALA组FBG无显著性差异,但HFD组胰岛素水平明显升高,两组HOMA–IR也有明显差异,表明高脂饮食组大鼠存在胰岛素抵抗,而ALA明显改善了大鼠机体的胰岛素抵抗状态。
实验证实抗氧化剂补充治疗可明显改善氧化应激、促进糖脂代谢、阻止或延缓组织损伤;但临床研究仍存在很多争议。最新研究表明抗氧化治疗单独或与其它药物联用,可为患者带来益处。Zhang等研究了22名肥胖伴葡萄糖耐量受损(IGT)患者,其中13名患者接受了2周的 ALA(600 mg.iv.d-1)治疗;结果治疗前后胰岛素敏感性明显提高41%,血脂(FFAs、TG、TC、LDL、sd-LDL、ox-LDL、VLDL)均显著下降;氧化应激产物(MDA、8-iso-prostaglandin)、慢性炎症因子肿瘤坏死因子α、IL-6显著下降,脂联素上升[9]。临床研究(QUALITY)[10]表明奎那普利可改善糖尿病伴一期高血压患者的内皮功能,并对肥胖因子好转有益;硫辛酸能显著增强奎那普利的以上作用,延缓代谢综合征各种病理生理学改变的发生。奎那普利40 mg/d,8周后24小时尿微量白蛋白下降27%,奎那普利+硫辛酸组(600 mg/d)使尿微量白蛋白下降48%。奎那普利组患者脂联素增加17%,瘦素下降19%,而奎那普利+硫辛酸组患者脂联素增加33%,瘦素减少40%。奎那普利组FMD结果增加22%,奎那普利+硫辛酸组增加40%。另一临床研究(ISLAND)结果表明:依贝沙坦(血管紧张素受体阻滞剂)和ALA可改善内皮功能、降低代谢综合征的炎性标志物IL-6、纤溶酶原激活物-1[11]。实验研究证实口服硫辛酸可抑制APOE缺陷、APOE/低密度脂蛋白受体缺陷小鼠动脉粥样硬化损害发展,其机制可能是由于抗肥胖、抗高甘油三酯血症和抗炎作用[12]。
总之,本研究通过动物实验研究发现腹腔注射ALA后大鼠食欲降低,体重、内脏脂肪减少;ALA以其独特的抗氧化应激、降血脂、明显改善胰岛素抵抗等多个层面影响实验动物的基础代谢,其详细机制尚待进一步探讨。
作者简简:闫国超,40岁,男,硕士,副主任技师,主要从事临床生物化学检验研究。
[1]Kastorini CM,Milionis HJ,Ioannidi A,et al.Adherence to the Mediterranean diet in relation to acute coronary syndrome or stroke nonfatal events:a comparative analysis of a case/case-control study[J].Am Heart J,2011,162(4):717.
[2]Dobrian AD,Davies MJ,Prewitt RL,et al.Development of hypertension in rat model of diet-induced obesity[J].Hypertension,2000,35(4):1009.
[3]Bisbal C,Lambert K,Avignon A.Antioxidants and glucose metabolism disorders[J].Curr Opin Clin Nutr Metab Care,2010,13(4):439.
[4]Henriksen EJ,Diamond-Stanic MK,Marchionne EM.Oxidative stress and the etiology of insulin resistance and type2 diabets[J].Hypertension,2000,35(4):1009.
[5]Dario P,Francesco Z,Enrico D S,et al.Oxidative Stress,Nitric Oxide,and Diabetes[J].Rev Diabet Stud,2010,7(1):15.
[6]杨丽霞,黄宗涛,刘铜华.代谢性疾病实验动物模型的建立与评价[J].中国实验动物学报,2009,17(4):318.
[7]龙惠东,林云恩,曾昭华.一种新的代谢综合征大鼠模型的建立[J].中国临床药理学与治疗学,2010,15(12):1326.
[8]Kim MS,Park JY,Namkoong C,et al.Anti-obesity effects of alpha-lipoic acid mediated by suppression of hypothalamic AMP-activated protein kinase[J].Nat Med,2004,10:727.
[9]Zhang Y,Han P,Wu N,et al.Amelioration of lipid abnormalities by α-lipoic acid through antioxidative and anti-inflammatory effects[J].Obesity(Silver Spring),2011,19(8):1647.
[10]Bobby V Khan,Syed T Rahman,Tahir Haque,et al.Quinapril and lipoic acid improve endothelial function and reduce markers of inflammation:results of quinapril and lipoic acid in the metabolic acid in the metabolic syndrome(quality)study[J].J Am Coll Cardiol,2010,55:A54.E510.
[11]Sola S,Mir MQ,Cheema FA,et al.Irbesartan and lipoic acid improve endothelial function and reduce markers of inflammation in the metabolic syndrome:results of the Irbesartan and Lipoic Acid in Endothelial Dysfunction (ISLAND)study[J].Circulation,2005,111(3):343.
[12]Zhang WJ,Bird KE,Mc Millen TS,et al.Dietary alpha-lipoic acid supplementation inhibits atherosclerotic lesion development in apolipoprotein E-deficient and apolipoprotein E/low-density lipoprotein receptor-deficient mice[J].Circulation,2008,117(3):421.
