山东寿光地区番茄黄化曲叶病毒外壳蛋白基因克隆及其在大肠杆菌中的表达
2012-02-23李美芹郭宝太刘永光裴华丽竺晓平
乔 宁 李美芹* 郭宝太 刘永光 裴华丽 竺晓平
(1 潍坊科技学院蔬菜花卉研究所,山东寿光 262700;2 青岛农业大学生命科学学院,山东青岛266109;3 山东农业大学植物保护学院,山东泰安 271018)
番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)属于双生病毒科(Geminiviridae)菜豆金色花叶病毒属(Begomovirus),主要通过烟粉虱(Bemisia tabaci)传播,可以侵染茄科、豆科等多种植物(Harrison et a1.,1977;Harrison & Robinson,1999),是分布广泛的世界性番茄病毒之一。由TYLCV 引起的番茄黄化曲叶病毒病是一种毁灭性病害,自1964年发现以来,已给许多国家和地区造成了严重危害(Hanley-Bowdoin et a1.,1999;Moriones & Navas-Castillo,2000)。
番茄(Lycopersicon esculentumMill.)是山东省寿光市种植面积最大的蔬菜品种之一,常年种植面积达1.3 万hm2。自2009年起在寿光主要番茄种植区相继发现疑似番茄黄化曲叶病毒病的病害,该病害传播速度快,危害程度高,致使受灾面积达7 000~8 000 hm2,给番茄生产带来了巨大的经济损失(龚一帆,2009;刘国霞 等,2009)。因此,应尽快建立快速有效的TYLCV检测方法。张玉满等(2001)对番茄黄化曲叶病毒(TYLCV-CHI)外壳蛋白基因在大肠杆菌中的表达进行研究,证实了以病毒外壳蛋白基因的原核表达产物为抗原制备抗血清是一条行之有效的途径。本试验克隆了寿光地区TYLCV 分离物的外壳蛋白(CP)基因,并构建其原核表达载体,实现了目的基因的高效表达,为抗血清的制备奠定了基础。
1 材料与方法
1.1 病株采集
2009~2011年在山东省寿光市蔬菜研究院番茄种植基地及寿光市稻田镇、田柳镇的番茄种植区进行调查,采集番茄植株顶部卷曲黄化及矮缩等具有典型症状的叶片样本10 份;阳性对照由浙江大学生物技术研究所谢艳老师惠赠;健康植株是由山东农业大学植物保护学院竺晓平老师提供的番茄组培苗。试验在潍坊科技学院蔬菜花卉研究所植物生理生化实验室完成。
1.2 工具酶及化学试剂
pEASY-T1 Simple 克隆试剂盒、T4-DNA 连接酶均购自北京全式金生物技术有限公司;XhoI和EcoR I 限制性内切酶、DNA Marker、中等分子量标准蛋白均购自MBI 公司;植物基因组DNA提取试剂盒、2xTaqMasterMix、Ni2+-NTA 亲和层析柱、碱性磷酸酶标记二抗、BCIP(5-溴-4-氯-3-吲哚基-磷酸盐)/NBT(四唑硝基蓝)底物显色试剂盒均购自北京康为世纪生物科技有限公司;硝酸纤维素膜、抗His 标签单克隆抗体和IPTG 均购自Sigma 公司,其余试剂均为国产分析纯。
1.3 载体及宿主菌
原核表达载体pET-32a 由山东农业大学植物保护学院竺晓平老师惠赠,E.coliDH5α(用于克隆载体的转化)、E.coliBL21(DE3)(用于表达载体的转化)感受态细胞均购自北京全式金生物技术有限公司。
1.4 试验方法
1.4.1 DNA 提取 取番茄病叶,按照试剂盒说明书提取植物总DNA。
1.4.2 病原PCR 分子鉴定 根据双生病毒共同区及外壳蛋白基因保守序列设计简并引物PA 和PA:5′-TAATATTACCKGWKGVCCSC-3′;PB:5′-TGGACYTTRCAW GGBCCTTCACA-3′。PCR 反应体系:2xTaqMasterMix 12.5 μL;10 pmol·L-1PA 1.0 μL;10 pmol·L-1PB 1.0 μL;模板DNA 1.0 μL,加ddH2O 至终体积25.0 μL。PCR 反应条件为94 ℃变性45 s,53 ℃退火45 s,72 ℃延伸1 min,35 个循环,72 ℃继续延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测。
扩增产物经回收纯化后送上海生工生物工程技术服务有限公司测序,并用DNAMAN 及NCBI网站上的BLAST 程序进行比对分析。
1.4.3TYLCV-CP基因克隆 根据TYLCV-CP基因序列设计并合成引物TYCP1 和TYCP2,序列分别为 5′-GCGGAATTC ATGTCGAAGCGACCAGGCGAT-3′、5′-GCGCTCGAGATTTGATTTGAA TCATAG-3′,下划线部分为酶切位点。内切酶分别为EcoR I,XhoI。所有引物均由上海生工生物工程技术服务有限公司合成。
以提取的总DNA 为模板进行PCR 扩增,反应体系为:2xTaqMasterMix 12.5 μL,10 pmol·L-1TYCP1 1.0 μL,10 pmol·L-1TYCP2 1.0 μL,模板DNA 1.0 μL,加ddH2O 至终体积25.0 μL。PCR 反应条件为94 ℃变性1 min,55 ℃退火45 s,72 ℃延伸45 s,35 个循环,72 ℃继续延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测后,经纯化与pEASY-T1 Simple 载体连接,转入大肠杆菌DH5α,提取质粒,经PCR 和酶切鉴定获得的重组克隆pT1-CP。
1.4.4TYLCV-CP基因原核表达载体的构建 用EcoR I 和XhoI 将TYLCV-CP基因从克隆载体pT1-CP 上切下,定向插入到同样双酶切的pET-32a,经PCR 和酶切筛选阳性克隆,并将其命名为p32a-CP。提取该重组质粒送上海生工生物工程技术服务有限公司测序,根据测序结果分析重组表达载体中TYLCV-CP基因序列及读码框的正确性。
1.4.5TYLCV-CP基因在大肠杆菌中的诱导表达与纯化 将重组载体p32a-CP 和pET-32a 分别转入大肠杆菌BL21(DE3),挑取单菌落接种到LB 液体培养基〔含20 ug·mL-1Amp(氨苄青霉素)〕中,37 ℃培养过夜,将上述培养物接种于新鲜的LB 液体培养基(含20 ug·mL-1Amp)中,37 ℃培养至OD600为0.8 时,加入终浓度为0.1~1.0 mmol·L-1的IPTG,37 ℃诱导表达4 h,取1 mL 离心收集菌体,12% SDS-PAGE 电泳检测表达结果。将重组质粒p32a-CP 扩增培养至100 mL 后诱导表达,离心收集菌体,经超声破碎后用Ni2+-NTA 亲和层析柱纯化目的蛋白,具体操作按照亲和层析柱产品说明书进行。
1.4.6 Western blot 鉴定重组蛋白 表达产物经12%的SDS-PAGE 凝胶电泳后,经电转移到硝酸纤维膜上,转移结束后,用5%脱脂牛奶37 ℃封闭转移膜1 h;与1 000 倍稀释的6×His 标签单克隆抗体室温孵1 h;洗膜,用碱性磷酸酶标记二抗(1∶5 000)室温孵育1 h;洗膜,用BCIP/NBT底物进行显色反应,阳性条带出现后立即用蒸馏水漂洗中止反应,拍照保存。
2 结果与分析
2.1 病原PCR鉴定
从采集的10 份病样中任取3 份,分别提取番茄总DNA,并以此为模板利用双生病毒简并引物PA/PB 进行PCR 扩增,结果如图1所示,3 份样品均得到500 bp 左右的目的条带,与阳性对照的片段大小一致,而健康番茄样品中无此条带。BLAST 分析测序结果显示,该片段序列由 541 个碱基组成,与孙海霞等(2009)、褚栋等(2010)已发现的番茄黄化曲叶病毒具有极高的同源性(97%~99%),因此可以说明番茄病叶由TYLCV 寿光分离物侵染所致。
2.2 TYLCV-CP 基因克隆
以病叶总DNA 为模板进行PCR 扩增,电泳结果显示得到约770 bp 的特异性扩增条带,与预期结果一致。重组质粒pT1-CP 经EcoR I 和XhoI 双酶切以及以该重组质粒为模板,TYCP1/TYCP2 为引物进行PCR 扩增,均得到约770 bp 的目的条带(图2),说明克隆得到了TYLCV-CP基因的特异性DNA 片段。
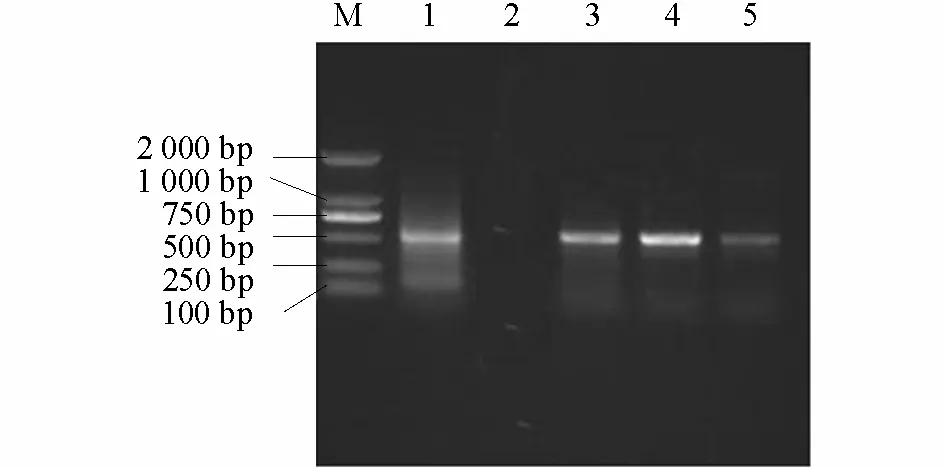
图1 感染TYLCV 番茄病叶DNA 的PCR 扩增结果
2.3 原核表达载体的构建及鉴定
经EcoR I 和XhoI 双酶切的TYLCV-CP基因正确插入到表达质粒pET-32a 中,获得了阳性克隆p32a-CP。重组质粒经PCR 扩增与EcoR I、XhoI 双酶切后,均可见约770 bp 的目的片段,而在EcoR I 和XhoI 单酶切图谱上都只有1 条约6.6 kb 的DNA 条带(图3)。测序结果表明(图4),该序列包含了TYLCV-CP基因的774 bp 编码序列,编码268 个氨基酸,与表达载体pET-32a连接正确,没有发生移码,碱基没有改变,同GenBank 中报道的相关序列完全一致,其登录号为FN256257(Zhang et al.,2009)。

图2 重组质粒pT1-CP 的酶切及PCR 鉴定结果

图3 原核表达载体p32a-CP的酶切及PCR鉴定结果

图4 TYLCV-CP 基因全序列及推导的氨基酸序列
2.4 重组蛋白的诱导表达与纯化
将鉴定正确的重组质粒 p32a-CP 转入E.coliBL21(DE3),经IPTG 诱导4 h 后,12%SDS-PAGE 分析可见明显的蛋白表达条带,其大小为50 kD,是19 kD 硫氧还蛋白与推测的31 kD 的外壳蛋白分子量之和(图5)。而未经诱导的含有重组表达质粒的菌株无此条带。通过分析全菌蛋白和超声波破碎后上清液的电泳图谱发现,TYLCV-CP基因的表达产物主要以包涵体的形式存在。通过凝胶扫描分析,目的蛋白的表达量约占细菌总蛋白的25%。经Ni2+-NTA 亲和层析柱纯化后,SDS-PAGE 电泳显示洗脱物中有清晰单一的特异性蛋白条带,获得了高纯度的目的蛋白(图6)。
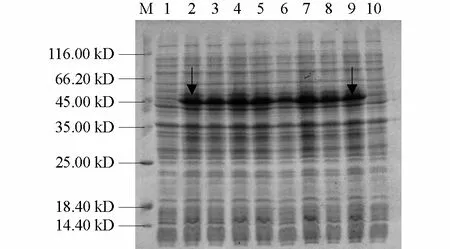
图5 TYLCV-CP 基因在大肠杆菌中的表达结果
2.5 重组蛋白的Western blot 分析
将表达产物转至硝酸纤维素膜上进行Western Blot 检测,通过图7 可以看出泳道2 和5 所表达的蛋白条带位置上有明显的杂交条带,而菌体蛋白条带的位置(泳道3 和4)没有出现杂交条带;另外,泳道 1 中的目的蛋白含量非常少,故未出现较明显的杂交条带。表明寿光地区TYLCV-CP基因在E.coliBL21(DE3)中得到了融合表达,具有良好的免疫原性。
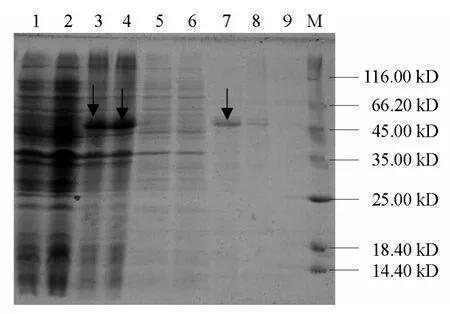
图6 TYLCV-CP 基因表达产物的纯化分析
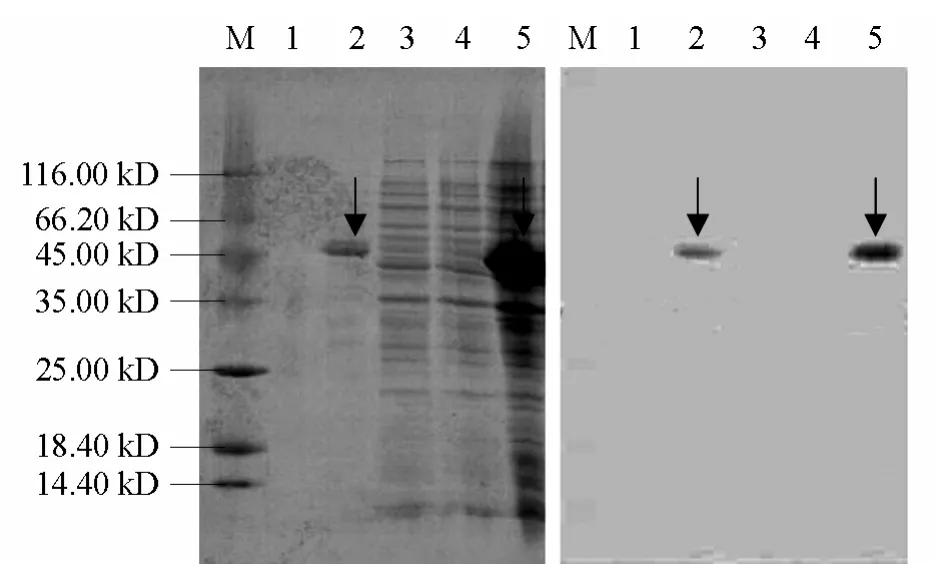
图7 重组蛋白的Western blot 分析
3 结论与讨论
通过田间调查发现番茄黄化曲叶病毒病已在山东寿光地区大面积发生,并有继续蔓延的趋势。纪文磊等(2010)发现,山东寿光地区的番茄黄化曲叶病毒与上海、安徽、日本登录的番茄黄化曲叶病毒的同源性达到了99%,属TYLCV-Israe l 株系的一个分离物。
本试验采用了超声波法提取细菌总蛋白,SDS-PAGE 电泳结果显示上清液中目的蛋白含量较少,而得到的沉淀经尿素溶解后能纯化出单一目的蛋白条带,说明表达的重组蛋白主要以包涵体的形式存在,这可能与表达量过高、表达条件不够完善等因素有关;尽管目的蛋白的N 端融合了硫氧还蛋白,但仍出现了不可溶现象,而安乃莉等(1999)发现硫氧还蛋白(TrxA)可促进外源蛋白在大肠杆菌中的可溶性表达,这就需要下一步通过优化表达条件来提高CP 蛋白的可溶性。
目前国内针对番茄黄化曲叶病毒的检测主要是何自福等(2004)、叶青静等(2008)应用的PCR 法,但该法技术含量高、设备昂贵,不适合进行大量样品的田间检测。在实际生产中对大量样品检测的方法主要是ELISA 法(薛朝阳 等,1999;谢艳 等,2002),而大量制备特异性的抗血清是应用该方法的前提。传统方法多采用提纯的病毒粒子为抗原制备抗血清,但存在一些弊端。据Neo 等(1993)报道,病毒外壳蛋白具有良好的抗原特异性。利用基因工程技术克隆病毒外壳蛋白,并以此为抗原制备抗血清,能够克服常规途径的诸多困难,已成为病毒抗血清制备的新途径,该途径现成功应用于烟草(朱常香 等,2005)、辣椒(吴育鹏 等,2010)、黄瓜(陈红运 等,2007)、甜菜(姚华建 等,1994)等多种植物病毒的血清学检测,但关于番茄黄化曲叶病毒的相关研究还比较少。本试验已成功构建了TYLCV-CP基因的原核表达载体,下一步将制备针对目的蛋白的特异性抗血清,为TYLCV 的ELISA 检测方法的建立奠定基础。
安乃莉,张智清,王嵩.1999.应用硫氧还蛋白促进外源蛋白在大肠杆菌的可溶性表达.病毒学报,15(2):130-135.
陈红运,赵文军,白静儿,李桂芬,朱水芳.2007.黄瓜绿斑驳花叶病毒cp基因的原核表达及抗血清制备.植物病理学报,37(5):467-471.
褚栋,侯丽霞,刘国霞,高长生,Brown J K.2010.山东省局部地区番茄黄化曲叶病毒的分子鉴定.山东农业科学,(2):13-15,19.
龚一帆.2009.威胁番茄生产的新病害—番茄黄化曲叶病毒病.中国蔬菜,(21):1-4.
何自福,虞皓,罗方芳.2004.番茄烟粉虱传双生病毒PCR 检测.中国病毒学,19(1):67-69.
纪文磊,李文丽,王富.2010.山东寿光地区番茄黄化曲叶病毒株系的分子鉴定.青岛农业大学学报:自然科学版,27(3):216-219.
刘国霞,禇栋,陶云荔.2009.山东省烟粉虱地理分布及部分地区种群动态调查.山东农业大学学报,40(2):205-208.
孙海霞,季英华,熊如意,赵统敏,余文贵,周益军.2009.2008年侵染江苏省番茄的粉虱传双生病毒发生分布.江苏农业学报,25(6):1278-1281.
吴育鹏,王健华,冯团诚,张雨良,王小明,刘志昕.2010.辣椒脉斑驳病毒cp基因的原核表达及其抗血清的制备.园艺学报,37(10):1598-1604.
薛朝阳,周雪平,青玲,李德葆,石银鹿,张琦.1999.利用DAS-ELISA 进行番茄花叶病毒的田间检测.植物病理学报,29(2):157-162.
谢艳,张仲凯,李正和,丁铭,周雪平.2002.粉虱传双生病毒的TAS-ELISA 及PCR 快速检测.植物病理学报,32(2):182-186.
姚华建,于嘉林,金元,刘仪.1994.甜菜坏死黄脉病毒外壳蛋白基因的表达及其表达产物抗血清的制备.病毒学报,10(1):39-43.
叶青静,杨悦俭,王荣青.2008.应用PCR 方法检测烟粉虱传双生病毒.植物保护,34(6):25-28.
张玉满,王寰宇,刘玉乐.2001.中国番茄黄化曲叶病毒(TYLCV-CHI)外壳蛋白基因在大肠杆菌中的表达及抗血清的制备.自然科学进展,11(2):142-146.
朱常香,宋云枝,王攻攻,王秀芳,温孚江.2005.烟草环斑病毒外壳蛋白基因的原核表达及抗血清的制备.中国病毒学,20(4):434-437.
Hanley-Bowdoin L,Settlage S B,Orozco B M,Nagar S,Robertson D.1999.Geminiviruses:models for plant DNA replication,transcription,and cell cycle regulation.Critical Reviews in Plant Sciences,18:71-106.
Harrison B D,Barker H,Bock K R,Guthrie E J,Meredith G,Atkinson M.1977.Plant viruses with circular single-stranded DNA.Nature,270:760-762.
Harrison B D,Robinson D J.1999.Natural genomic and antigenic variation in whiefly-transmitted geminiviruses(Begomoviruses).Annual Review of Phytopatho1ogy,37:369-398.
KÖklü G,Rojas A,Kvarnheden A.2006.Molecular identification and the complete nucleotide sequence of aTomato yellow leaf curl virusisolate from Turkey.Journal of Plant Pathology,88(1):61-66.
Moriones E,Navas-Castillo J.2000.Tomato yellow leaf curl virus,an emerging virus complex causing epidemics worldwide.Virus Research,71:123-134.
Neo K K,Wang S M,Wu M.1993.Nucleotide sequence and in vitrotranslation of the coat protein gene of cymbidium mosaic virus.Virus Gene,7(2):157-170.
Zhang H,Zhu W M,Zhou X P.2009.Tomato yellow leaf curl virus SDJN2 complete genome,isolate SDJN2.URL:http: //www.ncbi.nlm.nih.gov/nuccore/FN256257.1.
