苦参愈伤组织诱导及继代培养条件研究
2012-02-19齐香君
刘 瑶, 齐香君, 李 雅, 李 军
(1.陕西科技大学 生命科学与工程学院,陕西 西安 710021; 2.中国药科大学 国际医药商学院,江苏 南京 211198)
0 引言
中药苦参(SophoraflavescensAit.)为豆科槐属落叶灌木植物,具有清热燥湿、杀虫、利尿等功能.苦参中的苦参碱和氧化苦参碱具有良好的抗癌活性,对黑膀胱癌、色素瘤、胃癌等均有抑制作用[1].目前以苦参和其有效成分为原料开发了多种制剂并广泛用于临床[2].随着苦参制剂的开发,苦参药材的市场需求量在不断增加,2011年苦参市场价14元左右,在近几年内翻了4倍多.本研究旨在从中药资源可持续性发展考虑,对苦参愈伤组织诱导及继代培养条件进行研究,为药用植物苦参资源的可持续发展探索新的途径.
1 材料与方法
1.1 材料
1.1.1试剂
苦参种子购买于河北安国药材市场;乙腈(分析纯)、无水乙醇(分析纯)购于天津市红岩化学试剂厂;2,4-二氯苯氧乙酸(2,4-D)、6-苄氨基腺嘌呤(6-BA)、萘乙酸(NAA)植物激素均购于天津市科密欧化学试剂开发中心.MS培养基:Murashige and Skoog(1962)培养基.
1.1.2仪器设备
高效液相色谱仪:安捷伦高效液相色谱仪;培养箱:LRH-250-GSI智能人工气候箱.
1.2 方法
1.2.1苦参外植体制备
选颗粒饱满苦参种子,直接种植土壤中,室温发芽;或将种子做常规消毒处理[3]后接于MS培养基种,25±1℃,黑暗条件下发芽,培养一周左右后获得苦参幼芽;光照条件下继续生长两星期获得苦参幼苗.
1.2.2不同外植体对苦参愈伤组织诱导的影响
为了考察苦参愈伤组织诱导的最佳外植体,分别取苦参幼苗叶片、根、茎和苦参幼芽为外植体,叶片切成0.5~1.0cm2大小的方块,根、茎和幼芽切成1.0~1.5cm小段,接种于MS+1.0mg/L2,4-D+1.0mg/L6-BA+1.0mg/L NAA培养基中,25±1℃,暗条件下诱导培养.
1.2.3植物激素组合对苦参愈伤组织诱导的影响
激素组合对愈伤组织的诱导率、颜色、质地、生长状态等影响较大.本研究以苦参幼芽为外植体,将其接种于不同植物激素组合的MS固体培养基上,25±1℃,黑暗条件下诱导培养,观察不同激素组合下苦参愈伤组织诱导情况.
1.2.4苦参愈伤组织增殖继代培养研究
为了考察苦参愈伤组织增殖的最佳激素组合,以苦参愈伤组织生物量的增殖率为测定指标,将诱导出的颜色、质地、形态都相似的愈伤组织,设计L9(34)正交试验,25±1℃,黑暗条件下考察不同激素组合对苦参愈伤组织生长的影响,每组设3个平行(n=3).
1.2.5愈伤组织中苦参碱及氧化苦参碱的检测
HPLC检测苦参碱(MT)及氧化苦参碱(OMT)的色谱条件:色谱柱:氨基柱(Hypersil NH24.6mm×250mm,5μm,柱号:E2021505,批号:9347);流动相:乙腈-无水乙醇-3%磷酸(84∶8∶8);检测波长:220nm;流速:1mL/min;进样量:15μL;柱温:室温.
2 结果与分析
2.1 不同外植体对苦参愈伤组织诱导的影响
以苦参幼芽、幼苗的根、茎段、叶片为外植体,在MS+1.0mg/L2,4-D+1.0mg/L6-BA+1.0mg/L NAA培养基中,25±1℃,暗条件下苦参愈伤组织的诱导率分别为94.12%、74.19%、35.71%、23.08%.幼芽为其诱导的最佳外植体.以幼芽为外植体其愈伤组织的诱导率最高.诱导过程中,苦参幼芽在培养基上接种7d后,伤口开始膨大,待诱导至10d左右,伤口的膨大部位逐渐长出淡黄色的愈伤组织(如图1所示),继续培养,愈伤组织逐渐长大.

图1 以幼芽为外植体诱导的愈伤组织
2.2 植物激素组合对苦参愈伤组织诱导的影响
不同植物激素对苦参愈伤组织诱导的影响结果如表1所示.

表1 激素组合对苦参愈伤组织诱导的影响
从表1中可以看出,不同植物激素组合均能诱导出愈伤组织.在MS+1.0 mg/L 2,4-D+1.0 mg/L 6-BA+1.0 mg/L NAA组合下其诱导率最高,为94.12%.在不同激素组合下,苦参愈伤组织形态没有明显差异,呈淡黄色,质地松软.
2.3 愈伤组织的继代培养研究
不同植物激素组合下苦参愈伤组织的继代增殖结果如表2所示.
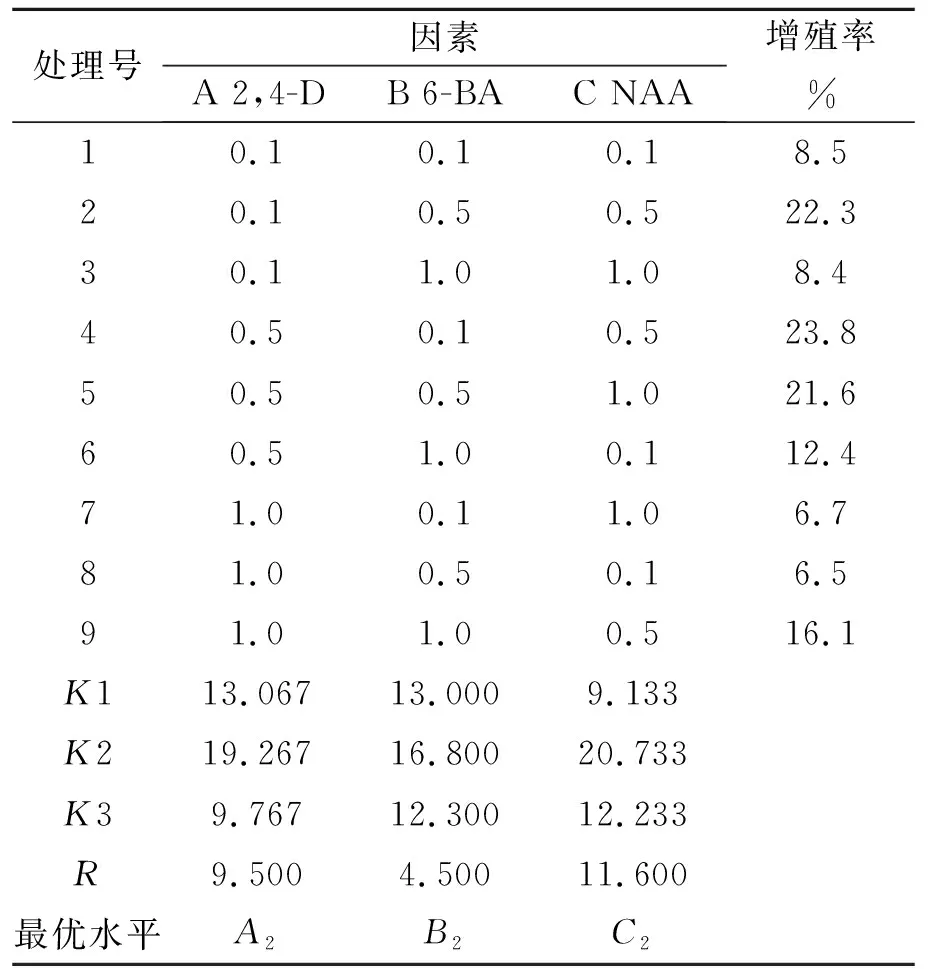
表2 正交试验结果
由直观分析可以看出,苦参愈伤组织增殖率的最优激素组合为A2B1C2,其增殖率为23.8%.所选3个因素对苦参愈伤组织增殖率影响的强弱顺序为C>A>B;其增殖的最佳激素组合为A2B2C2,组合不在正交表试验里,需做验证性试验.由试验结果看,A2B2C2组合下愈伤组织的增殖率为25.3%(大于23.8%),颜色透亮,呈淡黄色,质地松软,生长较快(如图2所示).
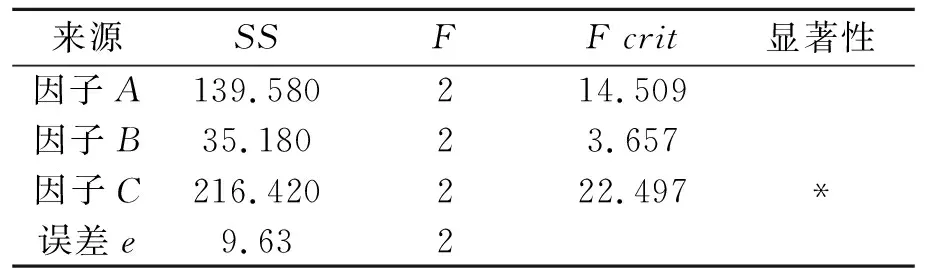
表3 方差分析结果
注:F0.95(2,2)=19.
由方差分析结果(如表3所示)可以看出:因子C(NAA)在α=0.05水平上对苦参愈伤组织增殖具有显著性影响.

图2 愈伤组织增殖前后对比
2.4 愈伤组织中苦参碱及氧化苦参碱的检测
本研究采用HPLC法对苦参愈伤组织中苦参碱及氧化苦参碱进行定量分析,其苦参碱(MT)及氧化苦参碱(OMT)的积累情况如表4所示.

表4 愈伤组织中苦参碱及氧化苦参碱的含量
由结果可知,苦参愈伤组织中氧化苦参碱的含量较高,苦参碱及氧化苦参碱的总含量为4.74%,是《中华人民共和国药典》2010版[4]中规定二者含量不低于1.2%的3.95倍.这可能与诱导苦参愈伤组织的外植体(幼芽)有关系,由检测结果可知,幼芽中氧化苦参碱的含量较高,使得愈伤组织中氧化苦参碱的含量也处于较高水平.
3 结束语
(1)不同外植体下,苦参愈伤组织诱导率不同.以苦参幼芽、幼苗的根、茎段、叶片为外植体,其愈伤组织的诱导率分别为94.12%、74.19%、35.71%、23.08%.幼芽为其诱导的最佳外植体.
(2)苦参愈伤组织诱导的最佳培养基为MS+1.0 mg/L 2,4-D+1.0 mg/L 6-BA +1.0 mg/LNAA,25±1℃,黑暗条件;增殖培养基的最佳激素组合:MS+0.5mg/L2,4-D+0.5mg/L6-BA+0.5mg/L NAA,25±1℃,黑暗条件;此条件下其增殖率为25.3%.
(3)苦参愈伤组织中苦参碱及氧化苦参碱的总含量为4.74%.
[1] 何 雄,韦星船,田裕昌,等.苦参碱及其衍生物合成及生物活性研究进展[J].中国现代应用药学,2011,28(9):816-823.
[2] 张凤玲,唐 永,张景梅.苦参碱、氧化苦参碱的药理作用及其制剂的研究进展[J].河南中医学院学报,2004(3):84-86.
[3] 齐香君,陈秀清,何恩铭.发根农杆菌诱导黄芩毛状根的研究[J].西北农业学报,2006,15(5):244-247.
[4] 中华人民共和国药典委员会.中国药典一部[M].北京:化学工业出版社,2010.
