TLR2胞外段特异性抗体对TLR2激动剂诱导的炎症和促过敏反应的抑制作用①
2012-02-05潘庆军侯晓睿刘艳君
潘庆军 刘 渊 朱 平 侯晓睿 刘艳君
(南方医科大学基础医学院免疫学教研室,广州510515)
TLR2胞外段特异性抗体对TLR2激动剂诱导的炎症和促过敏反应的抑制作用①
潘庆军②刘 渊 朱 平 侯晓睿 刘艳君
(南方医科大学基础医学院免疫学教研室,广州510515)
目的:观察小鼠TLR2胞外段抗原肽特异性抗体对TLR2激动剂诱导的炎症和促过敏反应的影响。方法:用小鼠TLR2胞外段单表位抗原肽(T20)免疫动物制备抗体(T20抗体);体外观察T20抗体对PGN和LTA刺激RAW264.7细胞生成TNF-α和IL-6的影响,用ELISA法检测各组TNF-α和IL-6量;体内观察T20抗体对OVA致敏小鼠PGN致死性攻击的影响,记录各组直肠温度变化和死亡率。结果:获得小鼠TLR2特异性T20抗体;该抗体可抑制TLR2激动剂(PGN和LTA)对相应靶细胞的刺激作用,使其生成的TNF-α和IL-6显著降低;体内实验证实T20抗体对PGN加剧的过敏反应具有抑制作用。结论:T20抗体可特异结合小鼠TLR2,抑制TLR2激动剂诱导的炎症及TLR2激动剂加剧的过敏反应。
TLR2;胞外段表位;抗体;炎症;过敏
Toll样受体 2(Toll like receptor 2,TLR2)是TLRs家族成员中表达范围最广、识别病原微生物及其产物种类最多的分子之一,广泛分布于单核-巨噬细胞、树突状细胞、肥大细胞和嗜碱性粒细胞等固有免疫细胞表面,可识别肽聚糖(PGN)、脂磷壁酸(LTA)、Pam3Cys、酵母多糖、HSP60、透明质酸、凋亡核小体和高迁移率族蛋白1(HMGB1)等多种配基[1-7]。上述配基与TLR2作用后,可引起性质相似的细胞信号转导活动,产生类似的炎性细胞因子。TLR2激动剂可介导产生抗感染、抗肿瘤等对机体有利的作用,也能诱到产生对机体不利的炎症和过敏反应[8,9]。因此,特异性阻断 TLR2介导的炎症和超敏反应信号通路,可能为感染、过敏及自身免疫等多种疾病机理研究和防治提供新的策略。
本实验拟用小鼠TLR2胞外段表位(20 mer合成肽)作为抗原获得相应单表位特异性抗体—抗T20,研究该抗体对TLR2激动剂诱导的过敏机体炎症表现的影响,分别在体外以小鼠巨噬细胞RAW264.7为模型,在体内以OVA主动过敏小鼠为模型进行相关研究。
1 材料与方法
1.1 材料
1.1.1 动物和细胞 新西兰大白兔和BALB/c小鼠由南方医科大学实验动物中心提供。RAW264.7细胞为本室保存。
1.1.2 主要试剂与仪器 卵白蛋白(OVA)、牛血清白蛋白(BSA)和弗氏佐剂购自Sigma公司;Bluecarrier蛋白(BC)、碳二亚胺(EDC)、BCA试剂盒和抗小鼠IgE-HRP购自Pierce公司;Sepharose 4B购自Amersham(Pharmacia)公司;小鼠商品化 TLR2抗体T2.5购自Biolegend公司;PGN购自Fluca公司;兔无关对照抗体,抗小鼠IgG、IgE-HRP,FITC-羊抗鼠和FITC-羊抗兔,TNF-α和IL-6 ELISA试剂盒购自武汉博士德生物工程有限公司。1.2 方法
1.2.1 抗原肽的设计与合成 以我们前期预测获得的小鼠TLR2胞外段编码氨基酸序列(DSQS LKSI RDIH HLTL HLSE)为模板,采用哈佛大学分子免疫基金会在线提供的抗原肽预测软件(http://bio.dfci.harvard.edu/Tools/antigenic.html#Directions)预测抗原表位,由深圳翰宇公司合成。
1.2.2 免疫原的制备 在EDC存在的条件下,分别按常规方法将抗原肽分别与BC、BSA和兔IgG交联,获得抗原肽-BC交联物、抗原肽-BSA交联物和兔IgG-抗原肽交联物(rIgG-T20交联物)。
1.2.3 动物免疫 以抗原肽-BC偶联物为免疫原对2只新西兰大白兔进行免疫,共免疫6次,每次抗原的用量为1 mg(按载体蛋白计),免疫过程按常规方法进行。
1.2.4 抗T20抗体检测和纯化 第6、8周采血,以抗原肽-BSA偶联物为包被抗原(10 μg/ml),以免疫前血清为阴性对照,采用间接ELISA方法检测IgG抗体滴度。
Sepharose 4B-rIgG-T20交联物制备:取已制备的 rIgG-T20 交联物 2.5 ml(1 mg/ml),于 0.1 mol/L NaHCO3(pH8.3)透析1小时。称取0.75 g溴化氢活化的 Sepharose 4B,以1 mmol/L冷 HCl使其膨胀,并加入G3砂心漏斗,15分钟内用150 ml冷1 mmol/L HCl冲洗凝胶,并用 0.1 mol/L NaHCO3快速抽干后与透析过的rIgG-T20交联物混合,室温翻转振荡孵育2小时。加入5 ml的0.2 mol/L甘氨酸(pH8.0,碳酸盐缓冲液)室温孵育2小时,以封闭未结合的基团。装入置层析柱中后用0.1 mol/L醋酸盐缓冲液 pH4.0(含 0.5 mol/L NaCl)和 0.1 mol/L NaHCO3pH8.3(含0.5 mol/L NaCl)交替反复洗柱5遍。用1个柱床体积3 mol/L KCNS洗柱,用含0.2%NaN3PBS(0.01 mol/L,含0.5 mol/L NaCl)洗柱5倍柱长,4℃保存备用。
抗血清纯化:每次取抗原肽-BC偶联物免疫的兔血清10 ml以10 mmol/L PBS(pH7.4)缓冲液稀释3倍,0.45 μm孔径滤膜过滤除杂质,加入层析柱,0.8 ml/min,重复上样 1 次,PBS(pH7.4)缓冲液洗涤10个床体积,然后用0.15 mol/L Gly-HCl pH2.5洗脱10个床体积,收集流出液1 ml/管,立即以1 mol/L Tris-HCl(pH9.0)中和至 pH7.2 ~7.4,以BCA试剂盒定量。
1.2.5 T20抗体鉴定 取正常培养的 RAW264.7细胞,胰酶消化收集,分别以1×106细胞与T2.5(1 μg/test),抗 T20(1 μg/test),抗 T20(1 μg/test)+ T20(1 μg/test)室温反应30分钟,兔无关抗体做对照,用含1%BSA的PBST洗涤3次,350 g/5分钟离心,再加入FITC-羊抗鼠或FITC-羊抗兔,室温避光30分钟,洗涤2次,重悬于200 μl洗涤液上机检测或涂片荧光显微镜检测,其他步骤按常规进行。
1.2.6 T20抗体对PGN和LTA刺激RAW264.7细胞炎症因子释放的影响 收集正常培养的RAW264.7细胞,106细胞/孔接种于六孔板,含 5%的牛血清的IMDM培养基,于37°C 5%CO2培养箱中培养。按 PGN(1 μg/ml),PGN(1 μg/ml)+T20抗体 (1 μg/ml)和 PGN(1 μg/ml)+T20 抗体(5 μg/ml)分组,共培养6和12小时后分别收集各组上清,冻存于-40℃待检测TNF-α和IL-6水平。
1.2.7 T20抗体对PGN诱导的过敏性炎症反应的影响 ①OVA过敏模型的建立和指标检测:6~8周BALB/c小鼠分别于第0、10、20天用Al(OH)3和OVA(100 μg/只)乳化后腹部皮下多点免疫,第21天分别检测抗OVA IgG和IgE抗体水平。尾静脉OVA攻击剂量为30 mg/kg。②T20抗体对PGN加剧OVA致敏小鼠过敏反应的影响:OVA致敏小鼠模型建立后,选择OVA抗体滴度一致的小鼠,分为以下4组:第一组,即OVA(30 mg/kg)激发组;第二组,即 OVA(30 mg/kg)+PGN(100 μg/只)加剧实验组;第三组,即 OVA(30 mg/kg)+PGN(100 μg/只)+T20抗体(100 μg/只)干预实验组;第四组,即同型抗体阴性对照组[OVA(30 mg/kg)+PGN(100 μg/只)+ 兔无关抗体(100 μg/只)]。分别记录直肠温度变化和死亡率。
2 结果
2.1 TLR2胞外段20肽的合成和抗原性预测 T20序列为:DSQS LKSI RDIH HLTL HLSE(TLR2′s extracellular domain),经软件预测T20仅含一个单表位抗原决定簇。
2.2 T20抗体鉴定 以小鼠TLR2胞外段抗原肽-BC交联物免疫家兔获得抗血清约80 ml。以抗原肽-BSA偶联物为包被抗原(10 μg/ml),T20抗体滴度约1∶100万。以Sepharose 4B-rIgG-20肽亲和纯化T20抗体,以BCA试剂盒(Pierce公司)定量,得到T20抗体为12.8 mg(共2 ml)。
流式细胞术结果显示T20抗体(r-anti-T20)可以和RAW264.7细胞结合,而且这种结合可以被TLR2胞外段T20肽阻断(图1)。荧光显微镜也显示T20抗体可以和RAW264.7细胞结合(图2)。
2.3 T20抗体抑制 PGN和 LTA刺激 RAW264.7细胞TNF-α和 IL-6的产生 PGN(1 μg/ml)刺激RAW264.7细胞6小时和12小时可诱导 TNF-α和 IL-6的产生,T20抗体 (1和5 μg/ml)可显著抑制由PGN刺激RAW264.7细胞产生的 TNF-α和IL-6。LTA(0.1 μg/ml)刺激 RAW264.7 细胞 6 小时和12小时同样可诱导TNF-α和 IL-6的产生,T20抗体(0.1 和 0.5 μg/ml)可显著抑制由 PGN刺激 RAW264.7细胞产生的 TNF-α和 IL-6 (图3)。
2.4 T20抗体抑制PGN诱导的致死性过敏性反应
2.4.1 OVA过敏模型参数 以OVA为包被抗原(10 μg/ml),其他按常规方法进行,检测OVA特异IgG抗体滴度约1∶50万;特异OVA IgE约1∶400。
2.4.2 T20抗体抑制PGN加剧的过敏反应 OVA攻击组小鼠发生过敏反应,但无一死亡(图4B),该组小鼠直肠温度注射后60分钟后降至最低点,180分钟后开始回升,390分钟后逐渐恢复至基础体温(图4A);而PGN加剧组(即OVA攻击+PGN加剧实验组)小鼠在注射后100分钟内100%死亡(图4B),该组小鼠直肠温度注射后60分钟后降至最低点后,未恢复(图4A);T20抗体干预组(即 OVA攻击+PGN+T20抗体干预抑制实验组),保护部分PGN促过敏小鼠免于死亡(保护率33.3%,n=12,图 4B),该组小鼠直肠温度注射后60分钟后降至最低点后,部分逐渐恢复至基础体温,部分未恢复(图4A);而同型抗体阴性对照组[OVA(30 mg/kg)+PGN(100 μg/只)+ 兔无关抗体(100 μg/只)]同PGN加剧组结果类似。
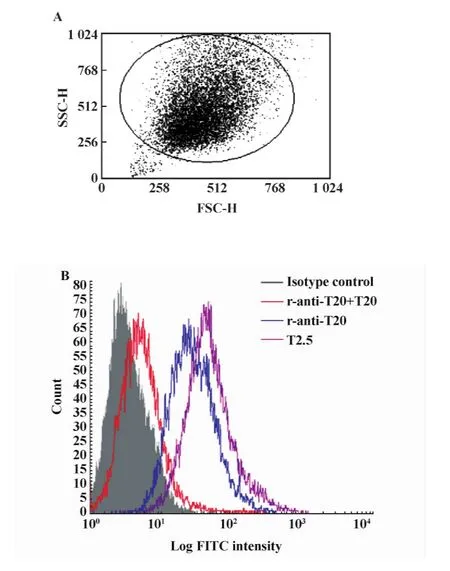
图1 用不同抗体流式检测RAW264.7细胞表面TLR2的表达Fig.1 The expression of TLR2 on RAW264.7 detected by flow cytometry with anti-T20 or T2.5
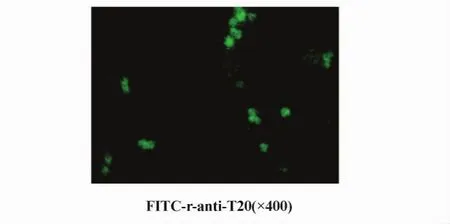
图2 FITC-T20抗体 荧光显微镜检测RAW264.7细胞表面TLR2(×400)Fig.2 The expression of TLR2 on RAW264.7 detected by fluorescence microscopy with FITC-anti-T20 (×400)
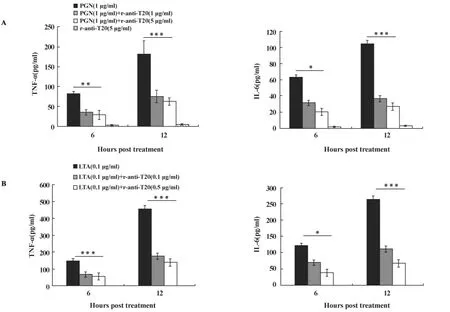
图3 T20抗体对 PGN和LTA刺激RAW264.7细胞产生的TNF-α和 IL-6的影响Fig.3 Effects of anti-T20 on the production of TNF-α and IL-6 by RAW264.7 stimulated with PGN or LTA
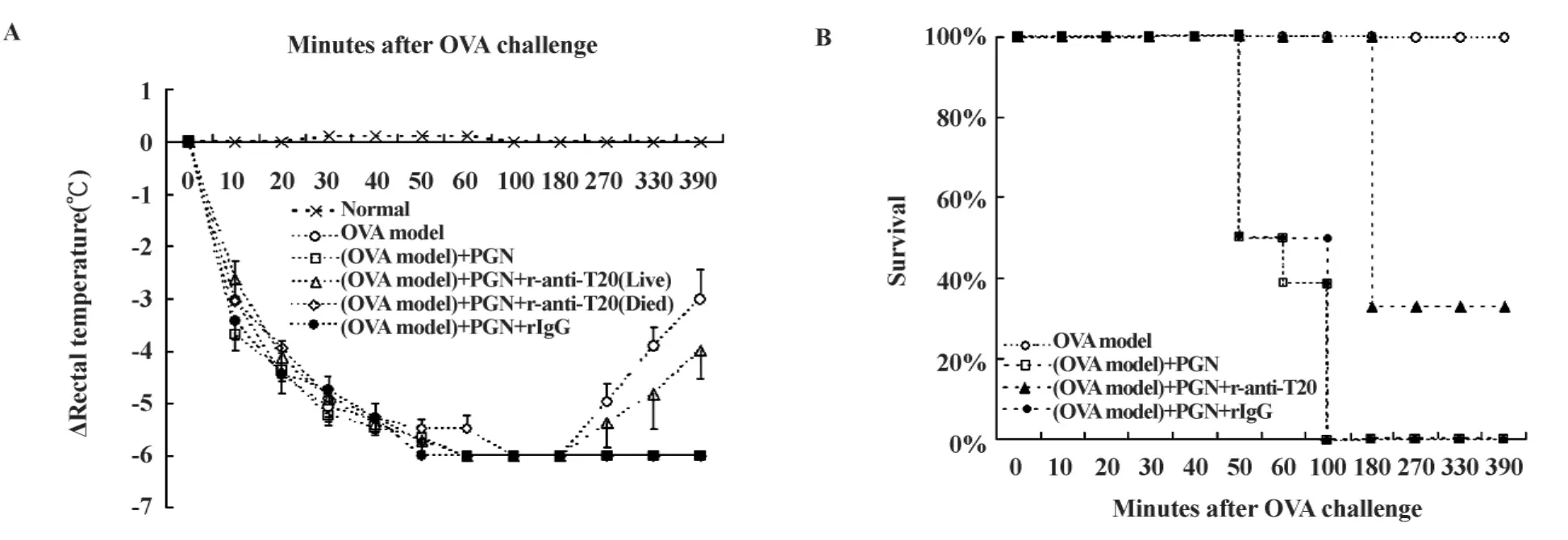
图4 T20抗体对PGN刺激过敏性炎症小鼠直肠温度和死亡率的影响Fig.4 Effects of anti-T20 on the rectal temperature and survival rate of OVA allergic mice stimulated by PGN
3 讨论
TLR2胞外段是识别和结合各种内/外源性配基的主要结构,胞内段则介导细胞内信号转导。TLR2胞外段与胞内段基因突变或缺失或阻断胞内信号转导通路可阻断 TLR2介导的生物学效应[10-13]。此外,TLR2胞外段的外源性干扰与封闭也可阻断或影响其介导的效应,如采用抗TLR2胞外段单抗或多抗也可阻断TLR2介导的生物学效应,包括对PGN、大肠杆菌脂蛋白、脂多糖及非感染因子的识别[14]。除了针对TLR2胞外段26肽(179L-204I)的多抗(Oncogen公司),其它商品化以及实验室制备的抗TLR2单抗、多抗所针对的TLR2胞外段位点尚不十分清楚,因而不利于TLR2胞外段与配基的相互识别机制的研究。本课题组采用蛋白质抗原表位预测及合成肽技术,选择TLR2胞外段的优势表位抗原,避免了小鼠全长及胞外段表达蛋白诱导的多位点抗体在活性鉴定方面的复杂性。
已知抗细胞膜受体分子的抗体结合相应的表位后,其作用可能是抑制或兴奋,这与抗体所针对的表位、应用途径、剂量及时相等因素有关[15],我们分别用了2种 TLR2的激动剂(PGN,LTA)刺激表达TLR2的RAW264.7细胞,抗T20均可抑制激动剂诱导的炎症反应。本文抗T20和TLR2激动剂同时作用于细胞,其炎症因子生成的阻断率达到约80%。同时,体外实验提示抗T20可能是抑制性(或封闭性)的。但作用机理的阐明则有待于进一步的研究。
鉴于发病率逐渐上升的过敏性疾病常合并感染,而感染又加重过敏反应。我们注意到TLR2信号通路在过敏性炎症中的作用及存在的争议,可能和TLR2激动剂或阻断剂的种类、剂量、靶细胞类型、产生炎症因子种类,以及采用的动物过敏模型不同有关。Jeffrey等发现金葡菌PGN通过结合肥大细胞表面的TLR2导致肥大细胞释放TNF-α、IL-4、IL-5、IL-6,脱颗粒和 Ca2+通道的开放,皮内注射PGN可增强血管扩张和TLR2依赖性的皮肤内肥大细胞活化以及炎症反应[1]。同时,TLR2的合成配基Pam3Cys和PGN作为佐剂诱导了显著的Th2型免疫反应,导致肥大细胞脱粒,能加剧实验性哮喘的炎性症状[2,16]。另外,PGN 结合嗜碱性粒细胞表面TLR2可选择性诱发IL-4和13的释放而不释放组胺和LTC4,但可增强由抗IgE抗体诱发的组胺和LTC4 的释放[4]。
我们所采用的OVA主动过敏模型为均一可控,即采用30 mg/kg OVA为非致死攻击剂量抗原,利于观察PGN刺激对模型的影响,也易于判断T20抗体对PGN加剧过敏反应炎症的保护作用。本文检测了过敏时的典型指标直肠温度变化和死亡率。在本文的OVA主动过敏模型体内实验中,发现制备的抗TLR2胞外段抗体可抑制TLR2激动剂PGN加剧的致死性过敏性反应,由此可认为,我们所研制抗体所识别的肽段是TLR2的干预靶点。
1 Mccurdy J D,Olynych T J,Maher L H et al.Cutting edge:distinct Toll-like receptor 2 activators selectively induce different classes of mediator production from human mast cells[J].J Immunol,2003; 170(4):1625-1629.
2 Redecke V,Hacker H,Datta S K et al.Cutting edge:activation of Toll-like receptor 2 induces a Th2 immune response and promotes experimental asthma[J].J Immunol,2004;172(5):2739-2743.
3 Takeda K,Akira S.Toll-like receptors in innate immunity[J].Int Immunol,2005;17(1):1-14.
4 Serhan C N,Ward P A,Gilroy D W.Fundamentals of Inflammation[M].Cambridge University Press,2010:74-79.
5 Bauer S,Hangel D,Yu P.Immunobiology of toll-like receptors in allergic disease[J].Immunobiology,2007;212(6):521-533.
6 Han J,Zhong J,Wei W et al.Extracellular high-mobility group box 1 acts as an innate immune mediator to enhance autoimmune progression and diabetes onset in NOD mice[J].Diabetes,2008;57(8): 2118-2127.
7 Urbonaviciute V,Furnrohr B G,Meister S et al.Induction of inflammatory and immune responses by HMGB1-nucleosome complexes:implications for the pathogenesis of SLE[J].J Exp Med,2008;205 (13):3007-3018.
8 Akdis C A,Kussebi F,Pulendran B et al.Inhibition of T helper 2-type responses,IgE production and eosinophilia by synthetic lipopeptides[J].Eur J Immunol,2003;33(10):2717-2726.
9 Kanzler H,Barrat F J,Hessel E M et al.Therapeutic targeting of innate immunity with Toll-like receptor agonists and antagonists[J].Nat Med,2007;13(5):552-559.
10 Iwaki D,Mitsuzawa H,Murakami S et al.The extracellular toll-like receptor 2 domain directly binds peptidoglycan derived from Staphylococcus aureus[J].J Biol Chem,2002;277(27):24315-24320.
11 Vasselon T,Detmers P A,Charron D et al.TLR2 recognizes a bacterial lipopeptide through direct binding [J].J Immunol,2004; 173(12):7401-7405.
12 Fujita M,Into T,Yasuda M et al.Involvement of leucine residues at positions 107,112,and 115 in a leucine-rich repeat motif of human Toll-like receptor 2 in the recognition of diacylated lipoproteins and lipopeptides and Staphylococcus aureus peptidoglycans[J].J Immunol,2003;171(7):3675-3683.
13 Vasselon T,Hanlon W A,Wright S D et al.Toll-like receptor 2 (TLR2)mediates activation of stress-activated MAP kinase p38[J].J Leukoc Biol,2002;71(3):503-510.
14 Ben-Ali M,Barbouche M R,Bousnina S et al.Toll-like receptor 2 Arg677Trp polymorphism is associated with susceptibility to tuberculosis in Tunisian patients[J].Clin Diagn Lab Immunol,2004;11 (3):625-626.
15 Meng G,Rutz M,Schiemann M et al.Antagonistic antibody prevents toll-like receptor 2-driven lethal shock-like syndromes[J].J Clin Invest,2004;113(10):1473-1481.
16 Chisholm D,Libet L,Hayashi T et al.Airway peptidoglycan and immunostimulatory DNA exposures have divergent effects on the development of airway allergen hypersensitivities[J].J Allergy Clin Immunol,2004;113(3):448-454.
[收稿2012-02-11 修回2012-05-14]
(编辑 张晓舟)
The inhibition of antibodies against mouse TLR2 extracellular domain on the inflammation and allergic response induced by agonists of TLR2
PAN Qing-Jun,LIU Yuan,ZHU Ping,HOU Xiao-Rui,LIU Yan-Jun.Department Immunology,School of Basic Medical Sciences,Southern Medical University,Guangzhou 510515,China
Objective:To study the inhibitory effects of antibodies against mouse TLR2 extracellular domain on the inflammation and allergic response induced by agonists of TLR2.MethodsThe specific antibodies(anti-T20)of 20mer peptide epitope of mouse TLR2 extracellular domain(T20)were prepared by immunized T20 in rabbits.Effects of anti-T20 on PGN and LTA-driven TNF-α and IL-6 production in vitro were studied and the production of TNF-α and IL-6 were tested by ELISA.Also,the effect of anti-T20 on PGN-driven death of OVA allergic mice in vitro was studied,and rectal temperature and mortality were recorded.ResultsAnti-T20 could specifically bind with mouse TLR2 and significantly inhibit PGN and LTA-driven TNF-α and IL-6 production by RAW264.7 cells.Also,anti-T20 could partially protect OVA allergic mice from PGN-induced death.ConclusionAnti-T20 can specifically bind to mouse TLR2 and inhibit TLR2 agonist-driven inflammation and TLR2 agonist-promoting allergic response.
TLR2;Extracellular epitope;Antibody;Inflammation;Allergy
R392.12
A
1000-484X(2012)08-0685-05
10.3969/j.issn.1000-484X.2012.08.003
①本文受国家自然科学基金项目资助(No.30671970)
②同时供职于广东医学院肾脏疾病研究所,湛江524001
潘庆军(1978年-),男,医学博士,讲师,主要从事过敏和自身免疫性疾病研究;
及指导教师:刘艳君(1972年-),女,副教授,主要从事天然免疫研究,E-mail:yanjun@fimmu.com。
·专题综述·
