稳心颗粒对去甲肾上腺素诱导的心肌细胞H9C2增殖及其Cx43 mRNA表达的影响
2012-02-02丁赛良王光辉王苏燕文格波
杨 军,邓 彪,丁赛良,王光辉,张 勇,王苏燕,邝 孛,文格波
(南华大学附属第一医院,湖南衡阳421001)
心室重构是心力衰竭发生发展过程中的关键环节,包括损伤因素或负荷增加所产生的心肌组织、结构和功能等一系列变化,如心肌细胞活性降低、心肌细胞肥大、凋亡基因和蛋白表达以及细胞胞外成分的改变。抑制心室重构不仅是当前治疗充血性心力衰竭的一个主要方向和目标[1],同时也是改善心力衰竭预后和减少恶性心律失常导致心源性猝死的重要干预靶点。去甲肾上腺素(NE)作为加速心室重构的主要交感神经递质,其对心脏的长期作用已被证明是导致心力衰竭和心源性猝死的重要机制之一[2]。心肌细胞间的缝隙连接(GJ)与细胞代谢分化、物质运输和电兴奋传导有密切关系[3],而心肌重构和电生理失稳态与心肌细胞间GJ的改变密切相关,其中主要表达在心室肌中的缝隙连接蛋白Cx43已经成为当前治疗心律失常的新靶点[4]。稳心颗粒(WXKL)由党参、黄精、三七、琥珀、甘松组成,具有宁心复脉、益气养阴、定悸安神、活血化瘀功效,兼有Ⅰ、Ⅲ、Ⅳ类抗心律失常药物的作用[5]。但WXKL对心肌细胞肥大及缝隙连接蛋白Cx43的影响尚不明确。2011年6月1日~2012年3月1日,我们观察了WXKL对NE诱导的H9C2细胞的增殖及缝隙连接蛋白Cx43表达的影响,初步探讨WXKL治疗心律失常和改善心肌电生理重构的机制。
1 材料与方法
1.1 仪器与试剂 WXKL(步长制药公司);高糖液体培养基;胎牛血清(四季青公司);胰酶细胞消化液(碧云天公司);Trizol RNA提取液(invitrogen,美国);RNA逆转录试剂盒(fermentas,美国);PCR引物(北京赛百特公司合成);PCR试剂(天根生化公司);其余常用生化试剂均为国产分析纯;PCR仪(Biometra,,德国),冷冻离心机(Eppendorf,德国);酶标仪(ELX-808,美国);电泳仪(DYY-7C,北京六一仪器厂);凝胶成像系统(AlphamagerTM3400,美国);倒置显微镜(日本Olympus公司)。
1.2 细胞培养及分组 H9C2细胞来源于大鼠胚胎期心脏组织(由南华大学医学院心血管病研究所提供),在37℃、5%CO2条件下,于含10%胎牛血清的高糖液体培养基中进行培养,细胞90%汇合后用于实验。胰酶消化液消化细胞后种入培养板进行培养。实验细胞分为4组:对照组用常规培养基培养;NE组用加入NE(终浓度为1×10-5mol/L)的常规培养基培养;WXKL组用加入WXKL(终浓度为1 ×5 mg/mL)的常规培养基培养;NE+WXKL组用加入NE(浓度同上)和WXKL(浓度同上)的培养基培养。
1.3 细胞直径及蛋白测定 将处于对数生长期的H9C2细胞以1×105/mL种植于6孔板,按以上分组进行相应处理,72 h后用胰蛋白酶消化使之脱落,在相差显微镜下用测微器测定细胞直径,观察5个视野,每个视野测10个细胞,取平均值(每组取5次样本进行分析)。培养的细胞用冷PBS冲洗2次,晾干。每孔加200 μL细胞裂解液,冰上裂解30 min。将裂解的细胞移至0.5 mL离心管并摇动,4℃、12 000 r/min离心20 min,取上清液,按照BCA试剂盒说明在酶标仪波长为490 nm处测定吸光度值(A值)。用标准蛋白溶液制作标准蛋白曲线。根据标准曲线计算出蛋白浓度(每组取5次样本进行分析)。
1.4 细胞活力测定 采用MTT法。将处于对数生长期的H9C2细胞以1×104/mL接种于96孔板中,每组5个孔(设实验孔和对照孔),每孔100 μL,培养24 h后,按以上实验分组分别加入各组对应的培养基100 μL进行培养,培养24 h后,加入10 μL的MTT溶液5 mg/mL,继续培养4 h后弃去培养液,用PBS洗涤2次后,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪490 nm处测量各孔的光密度值(OD值)。细胞增殖率=实验孔OD值/对照孔OD值× 100%。
1.5 细胞Cx43 mRNA检测 采用RT-PCR法。将处于对数生长期的H9C2细胞以1×105/mL接种于6孔板,培养24 h,待细胞均匀贴壁后按以上实验分组,分别加入相应的培养基2 mL进行培养,72 h后提取RNA,按照fermentas逆转录试剂盒进行两步法逆转录合成cDNA.参照Genebank资料设计并合成引物;内参照β-actin扩增片段400 bp;Cx43扩增片段588 bp。PCR反应条件:94℃2 min后,94℃ 30 s、55℃30 s、72℃45 s,顺序循环35次,最后72℃延伸5 min,操作按说明书进行。取适量PCR产物,以1.2%琼脂糖凝胶电泳,凝胶成像系统观察,根据各DNA条带的综合光密度值(IDV值)进行半定量分析。
1.6 统计学方法 采用SPSS17.0及EXCEL统计软件。计量资料比较用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组H9C2细胞直径、蛋白浓度和细胞活力比较 各组H9C2细胞直径、蛋白含量及OD值、细胞增殖率见表1。表1显示,WXKL能够明显抑制NE诱导的H9C2细胞直径的增大、蛋白含量的增加,能够明显增强NE诱导下心肌细胞的活力。
2.2 各组H9C2细胞Cx43 mRNA的表达比较 各组细胞Cx43、β-actin的RT-PCR产物电泳带位置与理论位置相符。对照组IDV值为89%±3.35%、NE组为59%±2.55%、WXKL组为88%±3.93%、NE+WXKL组为72%±3.12%,WXKL组与对照组相比,P<0.05;NE+WXKL组与NE组相比,P<0.05。表明WXKL能明显抑制NE诱导的H9C2细胞Cx43 mRNA的表达下降。
表1 各组H9C2细胞直径、蛋白浓度及OD值、细胞增殖率比较(±s)
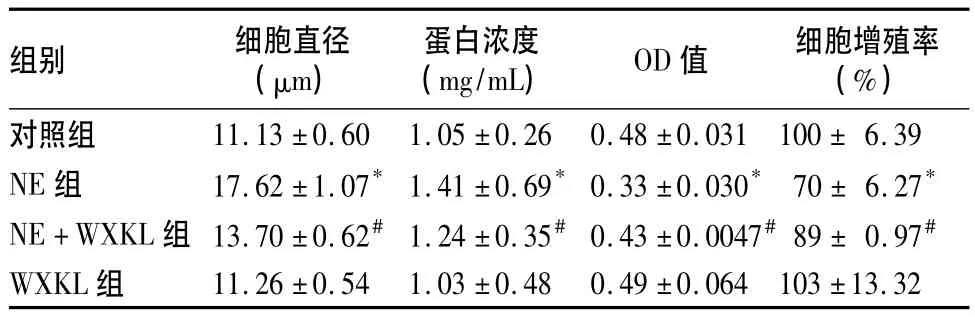
表1 各组H9C2细胞直径、蛋白浓度及OD值、细胞增殖率比较(±s)
注:与对照组相比,*P<0.05;与NE组相比,#P<0.05
?
3 讨论
NE作为主要的交感神经递质之一,在心衰早期活性增强有助于改善心血管功能,但长期持续增强就会对心肌细胞产生抑制作用并导致病理性心室重构,主要包括:心肌细胞肥大,细胞内超微结构的损失和破坏,心肌细胞外基质成分改变。心室重构后会导致心脏功能下降和心律失常的发生。因此,预防心室重构是治疗心力衰竭和心律失常的一个重要环节[6,7]。Cx43作为心肌细胞间隙的主要连接蛋白,在维持心肌细胞的通讯功能及电生理信号的传递中起着重要作用,它在心肌细胞中表达减少、结构异常、分布改变均可以引起心律失常[8]。
临床上已证明WXKL对心力衰竭、心律失常、病毒性心肌炎、扩张性心肌病及急性冠脉综合征等多种心血管疾病具有良好的治疗效果[9],其中以对心律失常的疗效最为显著。WXKL对多种离子通道有抑制作用,可以降低QT离散度,改善心率变异性,使心肌细胞电极均匀一致,可以通过减轻缺血缺氧对血管内皮细胞和心肌细胞的损伤而对心肌细胞微结构起到保护和修复作用[10]。但WXKL修复心肌细胞微结构的同时,是否能改善心肌细胞功能、抑制心肌细胞肥大及增加其Cx43的表达,目前未见相关研究报道。
本研究通过使用低浓度的(1×10-5mol/L)NE诱导H9C2细胞肥大,在体外模拟心室重构,发现H9C2细胞的活力较对照组明显下降,可能与NE诱导心肌细胞肥大有关。朱艳霞等[2]也发现,10 μmol的NE可以促进心肌细胞肥大,在一定程度上促进心肌细胞凋亡。本研究结果显示,WXKL可以明显抑制NE诱导的心肌细胞肥大,改善心肌细胞活力,这可能与其减少了NE诱导的心肌细胞凋亡有关[11]。同时,NE组H9C2细胞的Cx43 mRNA表达较对照组明显下降。表明WXKL可逆转NE诱导的心肌细胞Cx43 mRNA的表达下降。
NE诱导的心肌细胞肥大和Cx43 mRNA表达的下调,可能是心室重构后更易发生心律失常的机制,而WXKL改善心肌细胞肥大并增加其CX43的表达可能是其治疗心律失常的机制之一。
[1]Kaludercic N,Takimoto E,Nagayama T,et al.Monoamine oxidase A-mediated enhanced catabolism of norepinephrine contributes to adverse remodeling and pump failure in hearts with pressure overload[J].Circ Res,2010,106(1):193-202.
[2]朱艳霞,田宗文,朱红霞,等.去甲肾上腺素对培养心肌细胞肥大和凋亡的作用[J].解剖学杂志,2007,30(1):7-11.
[3]Gurreio PA,Schessler RB,Davis LM,et al.Slow ventricular conductionin mice heteroaygous for a connexin-43 null mutation[J].Clin Invest,1997,99(8):1991-1998.
[4]Gutstein DE,Morley GE,Fishman GI.Conditional gene targeting of connexin43:exploring the consequences of gap junction remodeling in the heart[J].Cell Commun Adhes,2001,8(4-6):345-348.
[5]郭继鸿.稳心颗粒在治疗心律失常中的优势[J].世界中医药,2007,(4):44.
[6]Guo R,Liu L,Barajas L.RT-PCR study of the distribution of connexin 43 mRNA in glomerulus and renal tubular segments[J].Am J Physiol,1998,27(5):439-447.
[7]Thandapilly SJ,Louis XL,Yang T,et al.Resveratrol prevents norepinephrine induced hypertrophy in adult rat cardiomyocytes,by activating NO-AMPK pathway[J].Eur J Pharmacol,2011,668 (1-2):217-224.
[8]Weng S,Lauven M,Schaefer T,et al.Pharmacological modification of gap junction coupling by an antiarrhythmic peptide via protein kinase C activation[J].FASEB J,2002,16(9):1114-1116.
[9]侯晓林,宋小林,杨喜耕,等.稳心颗粒对急性冠脉综合征患者心率变异性的影响[J].辽宁中医杂志,2011,38(9):1814-1815.
[10]刘爱东,代娜,王秀华.稳心颗粒对慢性心力衰竭大鼠血流动力学、血浆内皮素及心肌细胞结构的影响[J].中西医结合心脑血管病杂志,2006,(12):1069-1070.
[11]王瑜,李晓佳,樊官伟,等.中药有效组分抑制心肌细胞凋亡调控通路研究进展[J].辽宁中医杂志,2011,38(12):2487-2489.
