小肝癌患者外周免疫状态变化及手术、射频消融治疗的影响
2012-02-02朱玲燕庞雄昊
朱玲燕,庞雄昊,周 嘉
(1中山大学生命科学学院,广州510275;2中山大学肿瘤防治中心; 3南方医科大学免疫学教研室)
肿瘤发生后,机体固有的免疫细胞和适应性免疫细胞可以通过不同的方式识别肿瘤细胞,激发免疫效应机制,发挥抗肿瘤作用,而肿瘤则可以通过多种途径逃逸机体的免疫监视[1]。癌症患者机体免疫状态发生变化,局部免疫细胞如调节性T细胞(Treg细胞)[2]、NK细胞[3]的浸润分布甚至与患者预后相关。手术切除是原发性肝细胞肝癌(HCC)的首选治疗方法之一,射频消融逐渐成为其重要的治疗方式[4]。有报道[5]HCC患者外周免疫细胞群体比例发生变化,但各类细胞及其亚群的比例以及它们的功能分子表达是否同时发生改变则尚未明确,上述两种治疗方法对HCC的患者外周固有免疫和适应性免疫的影响也少有报道。为此,我们以小肝癌患者为研究对象,通过流式细胞术方法,检测了解其外周T细胞、NK细胞及其亚群在数量(群体比例)和质量(功能分子)方面的改变,并探讨手术切除和射频消融对小肝癌患者免疫状态的影响。
1 资料与方法
1.1 临床资料 2007年10月~2008年4月于中山大学肿瘤防治中心接受手术切除或射频消融治疗的、肿瘤直径≤6 cm的HCC(小肝癌)患者各13例(共26例),男25例,女1例;年龄38~75岁;均有乙型肝炎病史,血清AFP阳性(≥25 ng/mL)12例; TNM分期Ⅰ~Ⅱ期24例,Ⅲ~Ⅳ期2例。手术切除治疗者经病理学检查确诊;射频消融治疗者符合欧洲肝病研究学会(EASL)标准[6],经超声、CT或超声引导下获取活组织做病理检查确诊。所有患者术前未接受其他任何治疗,无自身免疫性疾病史及免疫治疗史。术前及术后1个月抽取其外周血进行流式细胞术检测。另设与小肝癌患者年龄、性别相近的健康人17例(均为男性,年龄平均46岁)作对照;经检测均无HCV、HBV、HIV和梅毒感染。
1.2 外周血NK细胞亚群、T淋巴细胞亚群及其CD25、perforin分子检测 采用流式细胞术。本实验涉及的抗体和化学试剂如下:荧光标记的 CD3、CD4、CD8、CD56、CD25抗体及perforin抗体;固定破膜试剂盒;淋巴细胞分离液。分别取健康人及小肝癌
患者的外周抗凝血3 mL,加至淋巴细胞分离液上面,密度梯度离心后取中间层细胞,即为外周血单个核细胞(PBMC)。取PBMC,按1×106/100 μL重悬至FACS管内,加入流式抗体后混匀,4℃染色孵育30 min,洗涤离心去除多余抗体。需同时标记perforin的样品则随后按固定破膜试剂盒进行胞内抗体染色。最后 FACS Vantage SE机器上样检测,Flowjo软件分析。流式细胞检测分析根据FSC/SSC点图,设定淋巴细胞门后读取/Lym(即NK细胞)、NK 细胞)(即辅助性T细胞:Th细胞)(即细胞毒性T细胞:Tc细胞)的比例;分析Th细胞)(即perforin+T细胞)、perforin+/(即perforin+NK细胞)比例。
1.3 统计学方法 采用SPSS13.0统计软件。数据比较用非参数检验方法。P≤0.05为差异有统计学意义。
2 结果
2.1 小肝癌患者及健康人外周NK细胞、T淋巴细胞亚群变化 小肝癌患者切除术前及射频术前NK细胞比例低于健康人(P均<0.05),低杀伤功能的NK细胞比例高于健康人(P均<0.05)。手术切除1个月后,小肝癌患者NK细胞比例较术前升高(P<0.05),细胞比例有降低趋势(13例中有8例降低);射频消融1个月后,小肝癌患者NK细胞比例有升高趋势(13例中有8例升高)细胞比例较术前降低(P<0.01)。小肝癌患者切除术、射频术前T细胞比例高于健康人(P<0.01);手术切除或射频消融术后1个月,T细胞比例呈降低趋势(分别有8例和7例降低),但与术前相近(P均>0.05)。详见表1。
2.2 小肝癌患者及健康人外周淋巴细胞CD25、perforin表达变化 小肝癌患者切除术、射频术前Th细胞比例高于健康人(P均<0.01),手术切除或射频消融术后下降(P均<0.05),但仍高于健康人(P均<0.01)。小肝癌患者perforin+NK细胞及perforin+T细胞的比例与健康人相近(P均 >0.05),手术切除或射频消融术后也没有发生明显变化(P均>0.05)。详见表1。
表1 小肝癌患者与健康人外周血NK细胞、T淋巴细胞亚群(%,±s)
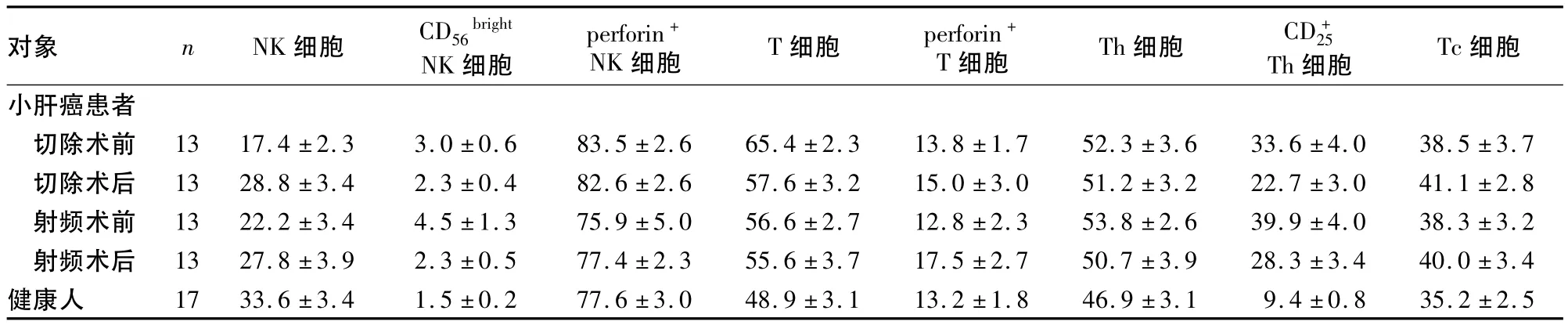
表1 小肝癌患者与健康人外周血NK细胞、T淋巴细胞亚群(%,±s)
?
3 讨论
本研究结果表明,与健康人相比,小肝癌患者外周NK细胞比例降低,低杀伤功能的NK 细胞比例则升高;手术切除肿瘤后前者增加,后者呈降低趋势;而经射频消融后前者呈增加趋势,后者显著减少。小肝癌患者Th细胞比例高于健康人,手术切除或射频消融后降低;小肝癌患者T细胞比例增加,而Th、Tc细胞群体及perforin+NK细胞或perforin+T细胞的比例无明显变化,手术切除或射频消融对它们也没有显著影响。由此可见,小肝癌患者外周固有免疫细胞及细胞免疫细胞比例发生明显改变,手术切除或射频消融后一定程度上得以恢复。
NK细胞具有强大的天然杀伤能力,在宿主抗癌机制中发挥重要作用,而细胞亚群则是高分泌细胞因子、低细胞毒杀伤的群体[7]。本研究发现,小肝癌患者NK细胞及NK细胞亚群的比例有明显变化,而perforin+NK细胞比例变化不大。提示荷瘤机体从两个侧面从数量方面影响NK细胞的抗肿瘤作用,而非NK细胞自身的杀伤潜能低下。这与我们之前的研究结果一致[3]。对于小肝癌患者,通常首选的治疗方法是手术切除,而射频消融是近年来被认为有良好疗效的治疗方法[8,9]。我们观察到,手术切除和射频消融对perforin+NK细胞的比例没有影响,能增加NK细胞的比例并减少K细胞比例。表明两种治疗方法都能在清除肿瘤后有效恢复机体的抗肿瘤固有免疫。然而,手术切除能更显著增加NK细胞的比例,射频消融则更显著减少细胞亚群的比例。提示两种治疗方法在恢复机体固有免疫方面有不同的优势。这可为小肝癌患者的进一步免疫治疗提供参考。
Th细胞主要通过活化后分泌多种细胞因子参与/调节抗肿瘤免疫[10]。CD25是IL-2受体的α链,表达于活化的T、B细胞等。本研究发现,小肝癌患者Th细胞比例高于健康人,手术切除或射频消融后下降。细胞中含有 Treg细胞[11]。研究[2]表明,Treg细胞在HCC免疫逃逸机制中发挥重要的作用,手术切除或射频消融治疗后Treg细胞水平的降低,提示这两种方法均可抑制Treg细胞介导的免疫逃逸。同时,细胞中也含有大量活化的Th细胞,本结果也提示小肝癌患者外周Th细胞活化程度偏高,经治疗后得以部分恢复。其中一个可能的原因是,机体由于存在肿瘤及相关的炎症,体内细胞免疫状态被激活,肿瘤被消除后,相应的细胞活化程度削弱。这也从另一个侧面说明手术切除与射频消融除了能清除机体内的肿瘤外,对恢复小肝癌患者细胞免疫状态也起着一定的作用。本研究还发现,经手术切除或射频消融后小肝癌患者Th细胞比例仍然高于健康人。肿瘤消除后机体仍存在较高水平的Treg细胞及免疫活化这一现象需进一步探讨,以便为患者的免疫治疗提供参考。
综上所述,与健康人相比,小肝癌患者外周NK细胞比例下降,其NK细胞的比例则上升,Th细胞比例也升高;手术切除或射频消融后上述变化明显恢复。提示小肝癌患者外周固有免疫及细胞免疫状态发生改变,手术切除或射频消融后获得一定改善。本研究还发现,两种治疗方法在恢复不同细胞的比例上各占优势,且未能恢复CD25的表达至健康人水平,它们之间的差异及消除肿瘤后的机体免疫状态仍需深入研究。本结果对于指导小肝癌综合治疗、观察疗效、判断预后具有参考价值。
[1]Vesely MD,Kershaw MH,Schreiber RD,et al.Natural innate and adaptive immunity to cancer[J].Annu Rev Immunol,2011,(29):235-271.
[2]Zhou J,Ding T,Pan W,et al.Increased intratumoral regulatory T cells are related to intratumoral macrophages and poor prognosis in hepatocellular carcinoma patients[J].Int J Cancer,2009,125 (7):1640-1648.
[3]朱玲燕,周嘉,刘彦章,等.自然杀伤细胞在原发性肝细胞肝癌中的浸润及其与预后的关系[J].癌症,2009,28(11):1198-1202.
[4]Bruix J,Sherman M.Management of hepatocellular carcinoma[J].Hepatology,2005,42(5):1208-1236.
[5] Chavan SS,Chiplunkar SV.Immunophenotypes and cytotoxic functions of lymphocytes in patients with hepatocellular carcinoma[J].Tumori,1997,83(4):762-767.
[6]Bruix J,Sherman M,Llovet JM,et al.Clinical management of hepatocellular carcinoma[J].J Hepatol,2001,35(3):421-430.
[7]Cooper MA,Fehniger TA,Caligiuri MA.The biology of human natural killer-cell subsets[J].Trends Immunol,2001,22(11): 633-640.
[8]Chen MS,Li JQ,Zheng Y,et al.A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma[J].Ann Surg,2006,243 (3):321-328.
[9]Khan MR,Poon RT,Ng KK,et al.Comparison of percutaneous and surgical approaches for radiofrequency ablation of small and medium hepatocellular carcinoma[J].Arch Surg,2007,142 (12):1136-1143.
[10]Zhu J,Yamane H,Paul WE.Differentiation of effector CD4T cell populations[J].Annu Rev Immunol,2010,(28):445-489.
[11]Ormandy LA,Hillemann T,Wedemeyer H,et al.Increased populations of regulatory T cells in peripheral blood of patients with hepatocellular carcinoma[J].Cancer Res,2005,65(6):2457-2464.
