常用大鼠发热模型研究
2012-02-01左泽平王志斌郭玉东王碧松
左泽平,王志斌,郭玉东,王碧松,高 阳
(北京市药品检验所,北京 100035)
发热是多种疾病常见的共有临床表现,大多发热性疾病患者的体温曲线变化往往反映病情变化和病变的特点。近年来各种大鼠发热模型的建立为解热药物的研究提供了重要依据。目前报道的常用大鼠发热模型有干酵母、LPS、2,4-二硝基酚、角叉菜胶等发热模型,其中最常用的是干酵母、LPS大鼠发热模型。由于动物自身特点和环境因素的综合影响,不同文献报道的同种发热模型的发热趋势,如发热高峰,峰值时间,发热时程等各不相同。
为提高各种大鼠发热模型的可利用度,深入研究不同发热模型大鼠的发热特点,本实验中,采用适应性较好、应激反应小的雄性SD大鼠在同一实验室环境中(温度22±2℃,湿度50% ±2%),对大鼠干酵母、2,4-二硝基酚、LPS、细菌内毒素(标准品)发热模型的发热过程,发热特点进行评价。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:雄性SD大鼠,级别:SPF级;许可证号:SCXK(京)2006-0009,购自北京维通利华实验动物技术有限公司。
1.1.2 实验试剂:氯化钠注射液,批号:
101217406,石家庄四药有限公司;高活性干酵母粉,批号:20110104W,安琪酵母股份有限公司;细菌内毒素国家标准品(9000EU),批号:981,中国药品生物制品检定所;脂多糖(LPS),批号:
L2880,Sigma公司。
1.1.3 实验仪器:TE2101-L电子天平(北京赛多利斯仪器系统有限公司);PB602-N电子天平(梅特勒-托利多仪器(上海)有限公司);MC-106B欧姆龙电子体温计(大连欧姆龙有限公司)。
1.2 实验方法
1.2.1 实验动物的准备:正式试验前,实验动物在实验环境(温度22℃ ±2℃,相对湿度50% ±2%)中适应3 d,每日早晚各一次对大鼠施行适应性测量肛温操作,实验前6 h禁食不禁水,测定肛温前让动物排空粪便[1]。每次测温前电子体温计探头涂凡士林,插入大鼠直肠3 cm(可在3 cm用橡胶或胶布等固定,确保每次插入深度一致),待读数稳定以后记录体温值。
1.2.2 皮下注射干酵母和2,4-二硝基苯酚复制大鼠发热模型:雄性 SD大鼠60只,体重(210 g~240 g,于实验当日在实验前测大鼠体温3次,取其平均值作为基础体温,其中若体温大于38.3℃或相邻两次体温差值大于0.5℃的动物淘汰。筛选出合格大鼠50只大鼠随机分为5组,每组10只:空白组皮下注射0.9%氯化钠注射液(10 m L/kg);干酵母A组皮下注射:20%现配的高活性干酵母混悬液(10 m L/kg);干酵母 B组皮下注射10%现配的高活性干酵母混悬液(10 m L/kg);2,4-二硝基苯酚A组皮下注射现配的2,4-二硝基苯酚30 mg/kg;2,4-二硝基苯酚 B组皮下注射现配的2,4-二硝基苯酚15 mg/kg,给药体积均为10 m L/kg。干酵母A、B组分别在皮下注射干酵母混悬液0.5 h后开始监测大鼠体温,此后每间隔1 h监测体温1次,供监测13 h,次日再测一次24 h体温;2,4-二硝基苯酚A、B组分别在皮下注射后,前1 h每20 m in测温1次,此后每0.5 h测温1次,监测7 h。计算各组各监测点升温值(实测体温与基础体温差值),绘制平均升温曲线;比较不同模型的发热过程和特点。
1.2.3 腹腔注射细菌内毒素和脂多糖复制大鼠发热模型:按1.2.2项下方法测大鼠基础体温并筛选,筛选出的50只合格大鼠随机分为5组,每组10只。空白组腹腔注射0.9%氯化钠注射液(10 mL/kg);内毒素A组腹腔注射细菌内毒素60 EU/kg;内毒素B组腹腔注射细菌内毒素120 EU/kg;脂多糖A组腹腔注射脂多糖20 ug/kg;脂多糖B组腹腔注射脂多糖100 ug/kg。细菌内毒素A、B组和脂多糖A、B组分别在腹腔注射后0.5 h开始测温,此后每0.5 h测温1次,共监测8 h;空白组在对应模型的各个体温监测点均平行监测。计算各模型各时间点升温值(实测体温与基础体温差值),绘制平均升温曲线;比较不同模型的发热过程和特点。各模型基础体温见表1。

表1 各模型大鼠基础体温值Tab.1 The value of basal body temperature in the rats
2 实验结果
2.1 干酵母发热模型
结果如图1所示:SD大鼠皮下注射干酵母后,开始时体温降低,A组(20%干酵母)最大降温幅度为0.04℃(ΔT=-0.04℃),B组(10%干酵母)为0.32℃(ΔT=-0.32℃)。注射2 h后,大鼠体温迅速上升,6~7 h达到峰值,A组峰值为2.25℃,B组峰值为2℃,此后升温曲线处于峰值平台期并能维持6 h。注射后12 h大鼠体温开始下降,直至24 h升温值才降至0.6℃以下。两组大鼠升温趋势一致。注射干酵母后,随体温变化大鼠出现开始时体温降低,足、唇苍白,后随体温逐渐升高,均出现蜷缩,足部、耳廓、嘴唇尾深红发烫,大部分大鼠有竖毛,趴伏,呼吸增快等现象。
2.2 2,4-二硝基苯酚发热模型
如图2所示:SD大鼠皮下注射2,4-二硝基苯酚后,体温立即迅速增高,20 min即升至0.6℃以上。注射后1~1.5 h达到峰值,A组(30 mg/kg)峰值达到3.09℃;B组(15 mg/kg)峰值为1.48℃。此后体温开始逐渐恢复,B组在注射后3h即监测到体温降至0.6℃以下,而A组则能维持到注射5h以后。两剂量组大鼠升温趋势一致。实验过程中,A组大鼠在注射2,4-二硝基苯酚后随体温增高都出现了仰卧、流涎、呼吸急促、瘫软无力等症状,后随着体温逐渐下降,症状减轻至消失。B组则未出现明显的以上症状。
2.2 LPS发热模型
如图3所示:腹腔注射 LPS(20μg/kg)30 min后,大鼠即出现体温显著升高,随即在约2 h和4 h时出现两个高峰,最大峰值为1.13℃。注射后6 h监测到体温降至 0.6℃以下。大鼠腹腔注射 LPS(100 μg/kg)30 min时开始出现体温显著升高,随后在2 h,4 h,6 h时出现3个高峰,呈现明显的三相热,最大发热峰值为1.58℃,注射后8 h监测到体温降至0.6℃以下。在腹腔注射LPS后,A组(100μg/kg)大鼠产生三相热过程中,出现竖毛、寒颤、精神萎靡,甚至伴有腹泻等症状。B组(20μg/kg)大鼠也出现精神萎靡,寒颤等症状,但只有个别出现轻微腹泻。
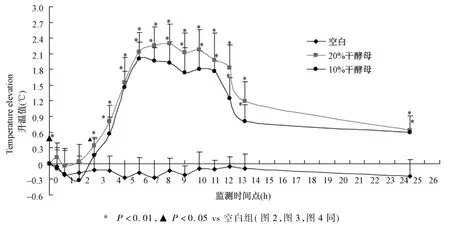
图1 SD大鼠干酵母发热模型升温曲线Fig.1 The elevated temperature curves in the dry yeast-induced rat feaver models
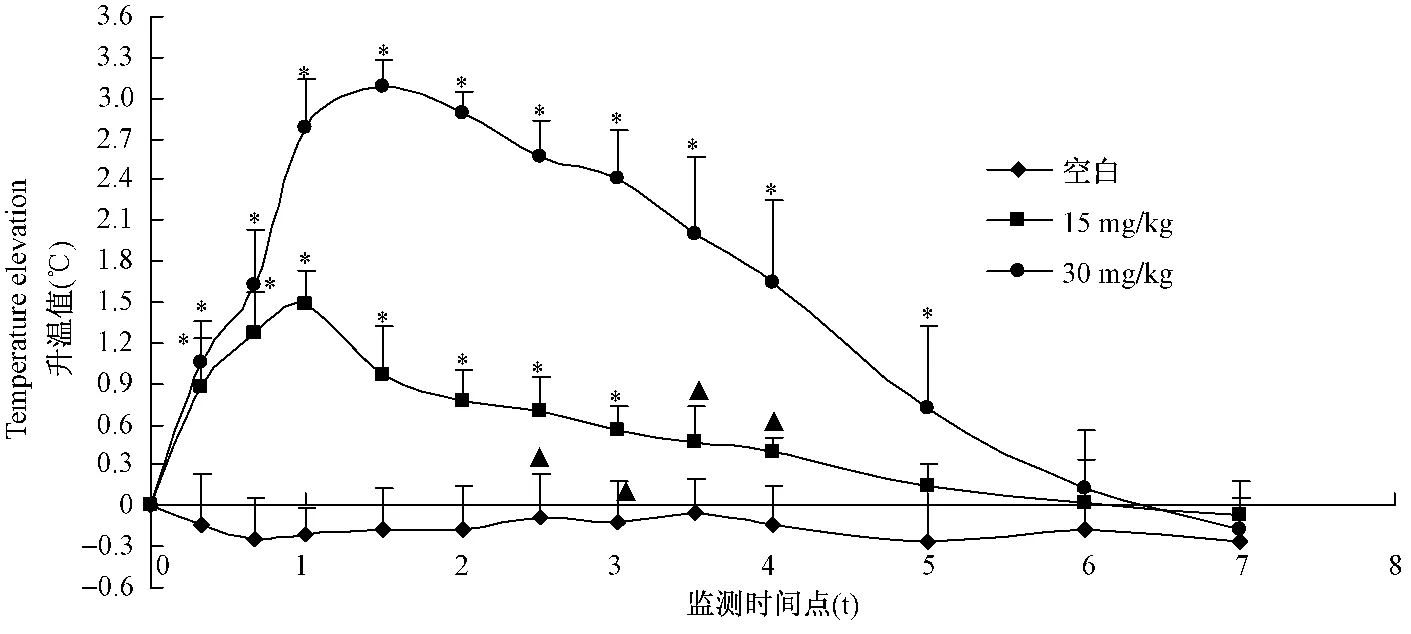
图2 SD大鼠2,4-二硝基苯酚发热模型升温曲线Fig.2 The elevated temperature curves in the 2,4-dinitrophenol-induced rat feavermodels

图3 SD大鼠脂多糖(LPS)发热模型升温曲线Fig.3 The elevated temperature curves in the lipopolysaccharide-induced rat feavermodels
2.3 细菌内毒素发热模型
如图4所示:腹腔注射细菌内毒素后,A、B组均在30 m in即能检测到体温显著升高,大鼠升温呈现明显的双相热,在1 h~1.5 h、3 h时出现高峰,最高峰值分别为0.99℃和0.93℃。注射后(4.5 h~5 h监测到大鼠体温降至0.6℃以下。注射细菌内毒素后,发热大鼠大部分出现寒颤、战栗、竖毛等症状。
2.4 各发热模型发热过程及特点
如表2,从升温起始时间看:2,4-二硝基苯酚发热模型致热最快,其次是LPS发热模型和细菌内毒素发热模型。大鼠干酵母发热模型开始时体温小幅度降低,注射后2~3 h体温开始迅速升高;从峰值出现时间看:干酵母发热模型峰值出现时间较晚,在注射后6~7 h。其他三种发热模型均在1 h~1.5 h即开始出现峰值。LPS和细菌内毒素发热模型呈现多项热,有2~3个高峰;从最大峰值看: 2,4-二硝基苯酚(30 mg/kg)发热模型峰值最高,干酵母发热模型也较高,其次是 LPS发热模型,而细菌内毒素峰值不超过1℃;从发热时程(以平均升温值大于0.6℃为发热标准看:发热时程最长的是干酵母模型,能持续20 h左右,发热时程最短为2,4-二硝基苯酚(15 mg/kg)发热模型,只能持续升温3 h左右,LPS和内毒素发热模型能维持升温5~8 h。
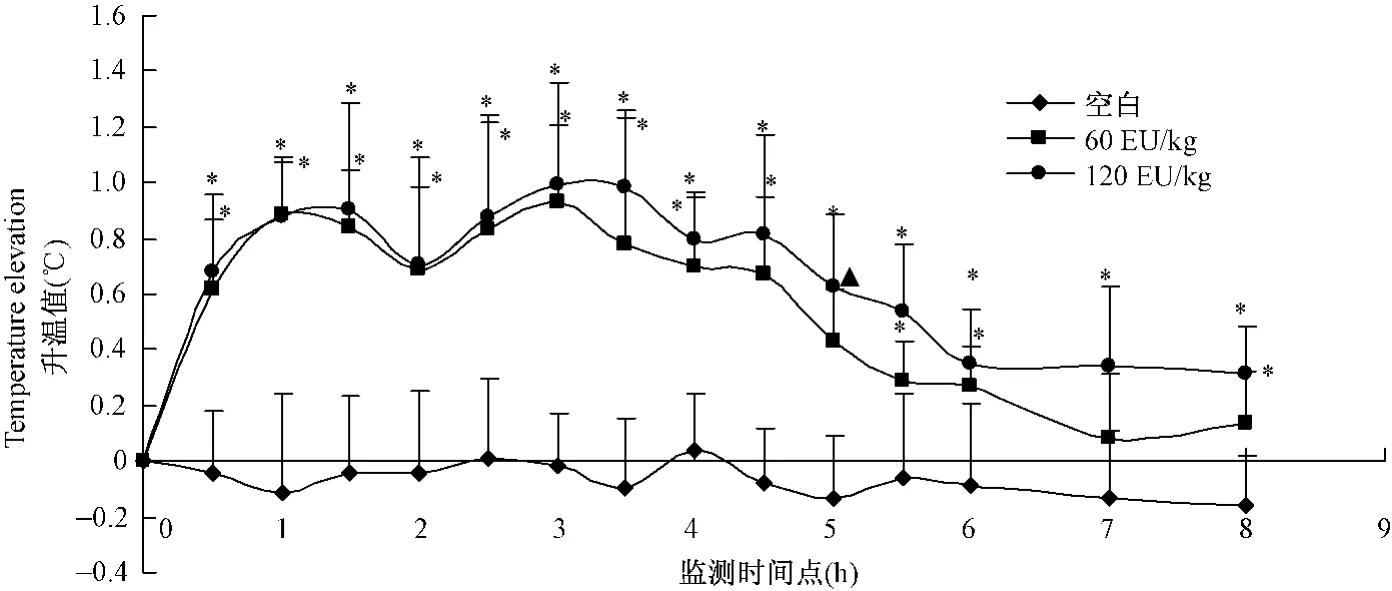
图4 SD大鼠细菌内毒素发热模型升温曲线Fig.4 The elevated temperature curves in the bacterial endotoxin-induced rat feaver models
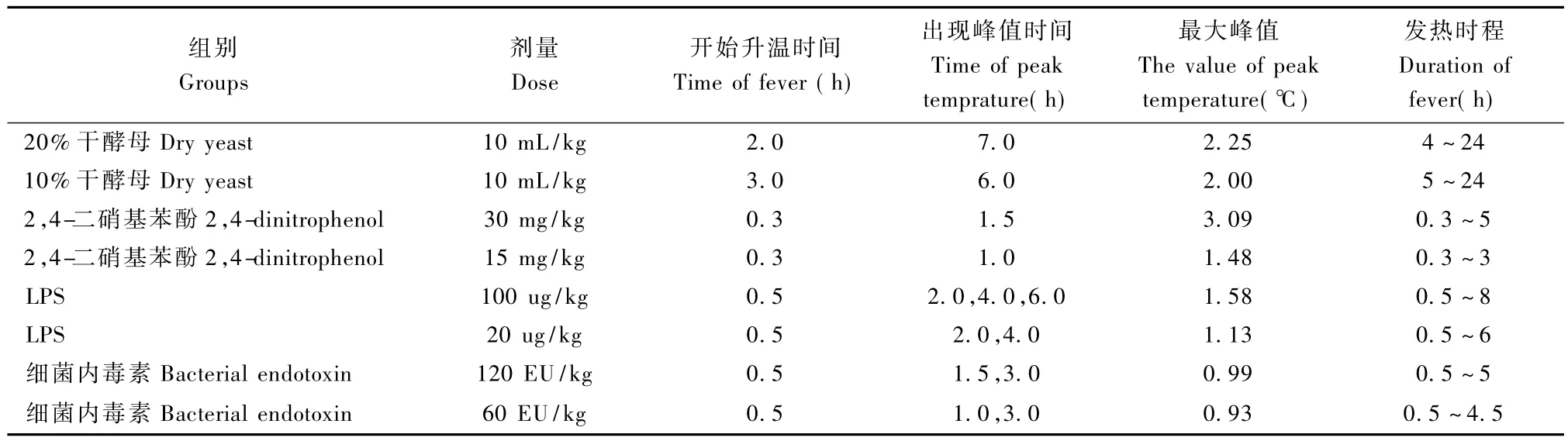
表2 大鼠发热模型体温升高趋势Tab.2 The trends of body temperature elevation in the ratmodels
3 讨论
大多数发热性疾病,体温升高与体内病变有着内在的依赖关系,可以说,发热常是疾病发生和发展的信号,必须引起重视[2]。研究证明,发热是由外致热原刺激机体的产内生致热原细胞释放内生致热原,后者作用于体温正调节调节中枢,释放中枢正调节介质,使体温调定点上移,同时作用于相关体温负调节中枢,释放负调节介质,抑制体温过高[3-5]。
干酵母所致的发热是由于注射部位的局部溃烂引发的剧烈炎症反应,是最常用的大鼠发热模型[6]。实验结果显示:干酵母发热模型大鼠经过短时间降温后体温迅速增高,并能在高峰维持一个高峰平台期,注射24 h后仍能观察到注射局部有明显的炎症症状。从实验结果可见两组动物发热趋势基本一致,且升温幅度与注射的干酵母浓度呈正比,说明干酵母致大鼠发热模型升温作用持久稳定。在具体实验中,可根据受试药物解热作用强弱选用合适的干酵母浓度。结合干酵母所致大鼠发热的原因及升温特点,该模型应适用于解热作用持久,药效较为显著的解热药物研究。
2,4-二硝基酚为一强的代谢刺激剂,皮下注射2,4-二硝基酚能刺激动物出现无菌性炎症,为非感染性发热模型[7]。从实验结果可以看出,2,4-二硝基酚所致大鼠发热程度与热程与其浓度呈正比。并且在发热过程中,该模型大鼠出现的仰卧、流涎、呼吸急促、瘫软无力等症状与其升温的幅度有直接关系,即升温值越高,出现症状越明显。2,4-二硝基苯酚作用迅速,短暂,升温幅度高,不适用于作用缓慢、持久的解热药物解热作用的考察,而适用于作用迅速,疗效显著,用于治疗非感染性发热的解热药物研究。
脂多糖(LPS)是革兰氏阴性细菌的内毒素(ET)的活性成分,因此细菌内毒素和LPS的致热原理是一致的,即作为致热原激活单核巨噬细胞产生内生致热原导致机体发热。研究证实微量的 LPS就能引起剂量依赖性发热,通常剂量(20~250μg/ kg)的LPS可引起双相或三相热,降低剂量则表现单相热,解热实验常用LPS剂量为20μg/kg和100 μg/kg[8,9]。本实验中 20μg/kg剂量致大鼠 0.5 h产生的发热高峰可能是应激性发热,因此不考虑为第一相热,即20μg/kg能致大鼠产生双相热,100 μg/kg能致大鼠产生三相热。发热整体趋势与文献报道一致,但最大峰值的时间不同,初步判断是由动物品系和实验室环境因素所导致。由于致热原理一致,探索性建立大鼠细菌内毒素标准品的发热模型,其发热特点为明显双相热,但从升温曲线看出细菌内毒素高低剂量的升温幅度差异很小,提示该模型的致热作用在一定范围内与剂量呈正比,但超过一定范围后加大剂量,大鼠升温值可能并无明显增幅,其原因有待进一步研究。LPS发热模型动物升温过程中,出现的症状的程度与发热程度呈正比,其症状与临床感染性炎症所致发热相似,因此该模型常用于解热药物筛选及炎性发热机制的探讨,可适用于抗炎抗病毒类解热药物解热作用及机制的研究。实验过程中,观察到的100μg/kgLPS引起大鼠出现竖毛、寒颤、精神萎靡并伴有腹泻等症状与升温幅度并没有直接关联,即升温高或低都出现了上述症状。20μg/kg组大鼠也出现精神萎靡,寒颤等症状,但只有个别出现轻微腹泻。
以上同种发热模型组间比较看出,同种外致热原所致发热模型中,所用外致热原浓度与升温起始时间没有明显联系,但可以明显看出外致热原浓度越高,发热峰值出现时间延迟,发热最大峰值越高,发热时程延长。解热药物研究中,选择大鼠发热模型应综合考虑药物和模型特点。这其中要考虑:解热药的起效时间是否在模型升温之后;解热药的作用时间是否在模型的热程内;解热药的药效强度是否能适用于模型;解热药的解热原理是否与模型的致热原理相符。对于疗效和作用特点不明确的药物,建议选用热程长,且发热稳定的干酵母模型,以确保能检测药物解热作用的全过程。
实验过程中发现,正式实验前的适应性测温非常重要。大鼠在未适应测温操作之前,测得的体温偏高,而在3~5 d,2~3次/d的适应性测温后,大鼠体温稳定,淘汰率很低。实验中测温操作频繁,加上造模后影响大鼠正常饮食,禁食时间过长会影响大鼠体温,以6 h为宜。为确保基础体温的准确性,最好在实验当天,先适应性测温一次,15~30 m in后再测基础体温。除温度和湿度外,噪声干扰会使大鼠体温应激性升高,因此在大鼠适应期和正式实验中,都应保持安静的环境。所有的外致热原,最好是现用现配,放置过久会影响其致热作用。在配置2,4-二硝基酚的过程中,因其在水中溶解度小,需要在配置过程中滴加少量5 mol/L NaOH震荡至全溶,加入NaOH量过多则会刺激动物而影响实验结果。
[1]章卓,万敬员,罗福玲,等.羟基积雪草苷与积雪草苷对LPS诱导大鼠发热模型的影响[J].时珍国医国药,2007,18(8):1799.
[2]黄启福.病理学[M].北京:科学出版社,2007:127.
[3]汤毅珊,王宁生,张银卿.雄黄及含雄黄复方对炎症介质IL-1β、IL-6、TNF-α和NO的影响[J].中药药理与临床,2007,23(5):107.
[4]顾学红,任爱农,彭蕴茹,等.清气凉营注射液的解热作用[J].中成药,2010,32(2):200.
[5]叶红,朱丽娜,冯甲棣,等.丁香酚对酵母菌发热大鼠血浆及脑脊液中精氨酸加压素含量的影响.中国医科大学学报[J],2006,35(3):260-264.
[6]徐叔云,卞如濂,陈修.药理学实验方法[M].北京:人民卫生出版社,2002:993.
[7]黄志桓,柳长凤,刘树民,等.基于代谢组学技术的2,4-二硝基苯酚和干酵母致热病证候模型的对比研究[J].中药药理与临床,2010,26(3):61.
[8]孙明瑜,高琳,谢鸣,等.小柴胡汤合煎液与分煎合液对LPS诱导大鼠发热模型的影响[J].中国中医药信息杂志,2003,10(12):17-19.
[9]张福利,冯俏,马伯艳,等.脂多糖对寒体、热体、常体大鼠攻毒发热后体温曲线、IL-1β的影响[J].江苏中医药,2009,41(1):76-77.
