运动联合福善美对去卵巢大鼠骨密度和神经传导的影响*
2012-01-30邝志强张荣华
邝志强, 张荣华
(暨南大学附属第一医院1康复科,2中医科,广东广州510632)
骨质疏松症(osteoporosis,OP)是以骨量减少、骨组织的微细结构破坏为特征,最终导致骨强度下降、骨脆性增高及骨折危险性增加的一种全身骨骼代谢障碍的疾病。骨痛和易骨折为其主要症状[1-3],严重影响患者生活质量和预期寿命。人体骨骼每年约10%的骨量由骨形成(bone formation)和骨吸收(bone absorption)不断偶联更新,以维持骨质量和适应性的强度。绝经后,机体卵巢功能低下,血清雌激素水平下降致骨吸收大于骨形成,导致骨量的丢失和骨矿物质含量变化,继而形成骨质疏松,称为绝经后骨质疏松(postmenopausal osteoporosis,PMOP)。PMOP患者的发病年龄在50~70岁之间,骨吸收与骨形成均活跃,但以骨吸收为主[4],表现为骨量迅速丢失,易发生骨折,且骨折多发生在以骨松质为主的椎体、股骨上端及桡骨远端。据2000年统计资料显示,全世界共有7.4亿绝经期妇女,骨质疏松症是其常见病之一[5]。因此,研究绝经后骨质疏松的发病机制及其治疗和防治仍然是医学界面临的重大难题,具有重要的临床意义。
福善美,又名阿仑膦酸钠,是强效骨吸收抑制剂,已广泛应用于临床,用于预防和治疗原发性骨质疏松症。运动增加肌肉对骨的牵拉,修复骨结构和骨量,刺激成骨细胞(osteoblast,OB)的作用[6-7]。运动作为一种最经济和基本的有效方法,其与二膦酸盐联合运用在绝经后骨质疏松症的疗效尚缺乏研究。本实验通过大鼠卵巢切除来复制绝经后骨质疏松这一经典模型,研究运动和福善美联合应用对去卵巢切除大鼠骨密度、神经传导及骨代谢的影响,观察运动是否可增强福善美对去卵巢骨质疏松大鼠的治疗作用及可能机制,为临床绝经后骨质疏松病人的治疗提供理论依据。
材料和方法
1 动物
6月龄雌性 SD 大鼠,体重为(248.2±12.0)g,购自广东省动物中心,合格证号为SCXK(粤)2008-0002。实验大鼠自由饮水进食,分笼饲养,实验前置于环境中适应3 d,相对湿度控制在60%~80%,温度控制在(24±2)℃。大鼠处理符合暨南大学实验动物管理的相关规定。
2 主要试剂、器材与仪器
2.1 主要试剂 阿仑膦酸钠片,又名福善美(fosamax,FOX),70 mg/粒,购自暨南大学附属第一医院。大鼠血清雌二醇(estradiol,E2)、Ⅰ型前胶原羧基端前肽(type I procollagen carboxy-terminal propeptide,PICP)和Ⅰ型胶原羧基端交联端肽(typeⅠcollagen carboxy- terminal cross- linked telopeptide,ICTP)ELISA检测试剂盒购自R&D。
2.2 器械 固定板、无菌洞巾、持针器、缝针、缝线、有(无)齿镊、直(弯)剪、眼科剪、眼科镊、输液装置、注射器、手术刀、刀片等均由暨南大学附属第一医院提供。
2.3 主要仪器 Model 550型酶标仪(Bio-Rad);双能X线骨密度仪(Lunar,Prodigy型);肌电图仪(Dantec)。
3 方法
3.1 实验分组及模型建立 90只6月龄雌性 SD大鼠,随机分为假手术组(sham)18只和去卵巢模型组(ovariectomized rats,OVX)72只。去卵巢模型组大鼠腹腔注射0.2%戊巴比妥钠(1 mL/kg)全身麻醉,仰卧位固定,备皮、消毒,无菌操作行双侧卵巢切除术,假手术组除不切除卵巢外,其余操作均与去卵巢模型组操相同。术后8周,双能X线骨密度仪在第4腰椎测量假手术组和去卵巢模型组大鼠骨密度(bone mineral density,BMD)并记录(BMD8w)。尾静脉采血,室温静置2 h,3 000 r/min离心10 min,分离血清,ELISA检测血清E2含量(ng/L)。将存活去卵巢模型组大鼠分为4组:模型组(OVX)、福善美治疗组(OVX+FOX)、运动治疗组(OVX+EX)和福善美与运动联合治疗组(OVX+FOX+EX),分别给予1 mg·kg-1·d-1福善美灌胃和(或)跑台运动干预治疗12周。
3.2 大鼠骨密度检测 各组大鼠干预治疗12周后,0.2%戊巴比妥钠溶液(1 mL/kg)腹腔注射麻醉,双能X线骨密度仪在第4腰椎测量各组大鼠BMD并记录(BMD20w)。
3.3 大鼠左侧股神经传导速度、运动末端潜伏期、复合肌肉动作电位检测 各组大鼠干预治疗12周后用肌电图机检测大鼠左侧股神经传导速度(motor nerve conduction velocity,MCV,m/s)、运动末端潜伏期(motor distal latency,ML,ms)和复合肌肉动作电位(compound muscle action potential,CMAP,mV)。
3.4 ELISA检测大鼠血清骨代谢指标变化 去卵巢骨质疏松大鼠干预治疗12周后,腹腔注射0.2%戊巴比妥钠溶液(1 mL/kg)麻醉,仰卧位固定,胸部正中切口开胸暴露心脏,心脏采血,室温静置2 h,3 000 r/min离心10 min,取上层血清,-80℃保存备用。按ELISA试剂盒操作说明测定血清PICP、ICTP含量。
4 统计学处理
采用SPSS 16.0统计软件,计量资料以均数±标准误(±sE)表示,两组间比较用t检验,多组间比较用单因素方差分析(ANOVA),各组方差齐时,采用LSD法进行两两比较;各组方差不齐时,用Tamhane's T2法两两比较。2×2析因设计的方差分析检测各处理组间有无交互作用。以P<0.05为差异有统计学意义。
结 果
1 大鼠卵巢切除8周后血清雌二醇及骨密度的变化
大鼠卵巢切除8周后,模型组血清雌二醇含量为(9.27 ±0.70)ng/L,较假手术组(42.47 ±0.51)ng/L明显降低(P<0.05),见表1;模型组 BMD为(0.252 ±0.002)g/cm2,与假手术组相比明显降低(P<0.05),见表1。
表1 大鼠卵巢切除后8周血清雌二醇及骨密度水平变化Table 1.Changes of serum estradiol(E2)and bone mineral density(BMD)of lumbar vertebra 8 weeks after the ovariectomy of rats(±sE)

表1 大鼠卵巢切除后8周血清雌二醇及骨密度水平变化Table 1.Changes of serum estradiol(E2)and bone mineral density(BMD)of lumbar vertebra 8 weeks after the ovariectomy of rats(±sE)
▲P <0.05 vs sham group.
Group n E2(ng/L) BMD(g/cm2)Sham 18 42.47 ±0.51 0.304 ±0.006 OVX 64 9.27 ±0.70▲ 0.252 ±0.002▲
2 各组大鼠卵巢切除干预治疗12周后骨密度的变化
如图1所示,大鼠卵巢切除干预治疗12周后,各组大鼠第4腰椎骨密度与假手术组相比显著降低(P<0.05),福善美、运动及运动联合福善美均可明显增加其骨密度(P<0.05),且联用效果较福善美、运动单用显著,但两单用组之间未见明显差别(P>0.05)。2×2析因设计的方差分析显示,福善美与运动2种处理方式之间不存在交互作用(P>0.05),即福善美与运动在治疗骨质疏松大鼠时单独发挥作用,见表2。

Figure 1.Changes of BMD of Lumbar verterbra.±sE.n=14~18,▲P < 0.05 vs sham group;*P < 0.05 vs OVX group;△P <0.05 vs OVX+FOX+EX group.图1 大鼠卵巢切除干预治疗12周后各组骨密度变化
3 运动和(或)福善美对骨质疏松大鼠左侧股神经传导的影响
如表3所示,卵巢切除骨质疏松大鼠干预治疗12周后,各组间左侧股神经MCV和CMAP未见明显改变(P>0.05)。模型组与假手术组相比,左侧股神经ML未见明显差别(P>0.05);福善美治疗组与模型组相比,ML未见明显改变(P>0.05);运动单独治疗、运动与福善美联合治疗组与模型组相比,ML均明显缩短(P<0.05),且联合治疗组较单纯福善美治疗组ML明显减短(P<0.05),与单纯运动治理组相比,未见显著差异(P>0.05)。2×2析因设计的方差分析显示,福善美与运动2种处理方式之间不存在交互作用(P>0.05),见表2。

表2 2×2析因的方差分析显示各指标P值改变Table 2.The changes of P values of the indexes calculated by 2×2 analysis of variance of factorial design
表3 运动和(或)福善美对去卵巢骨质疏松大鼠左侧股神经传导的影响Table 3.Effects of EX and/or FOX on MCV,ML and CMAP of the left femoral nerve(±sE)
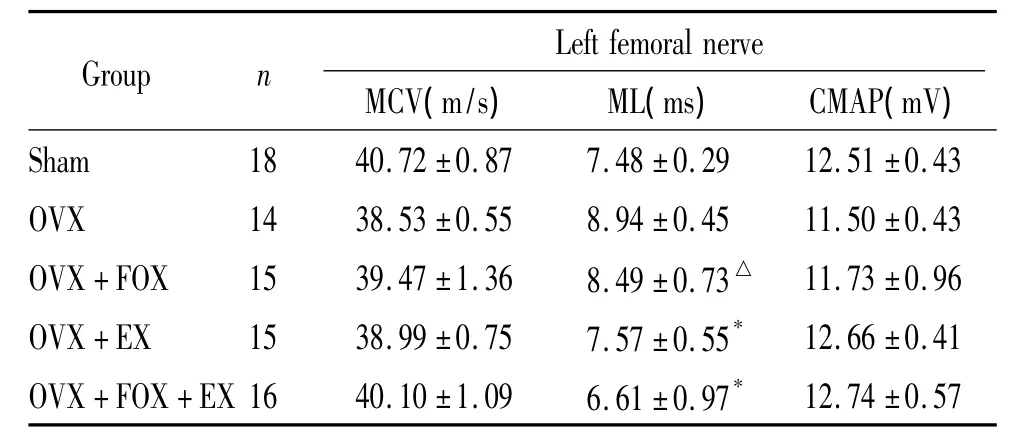
表3 运动和(或)福善美对去卵巢骨质疏松大鼠左侧股神经传导的影响Table 3.Effects of EX and/or FOX on MCV,ML and CMAP of the left femoral nerve(±sE)
*P <0.05 vs OVX group;△P <0.05 vs OVX+FOX+EX group.
Sham 18 40.72 ±0.87 7.48 ±0.29 12.51 ±0.43 OVX 14 38.53 ±0.55 8.94 ±0.45 11.50 ±0.43 OVX+FOX 15 39.47 ±1.36 8.49 ±0.73△ 11.73 ±0.96 OVX+EX 15 38.99 ±0.75 7.57 ±0.55* 12.66 ±0.41 OVX+FOX+EX 16 40.10 ±1.09 6.61 ±0.97*12.74 ±0.57
4 运动和(或)福善美对去卵巢骨质疏松大鼠血清Ⅰ型前胶原羧基端前肽的影响
去卵巢骨质疏松大鼠干预治疗12周后模型组血清 PICP 含量为(85.39 ±0.29)μg/L,与假手术组[(76.33 ±0.64)μg/L]相比明显升高(P <0.05)。福善美、运动、运动与福善美联合可以显著降低血清PICP含量(P<0.05 vs OVX)。运动与福善美联合治疗组较福善美、运动单用治疗组PICP含量显著降低(P<0.05);福善美治疗组较运动治疗组PICP含量低(P<0.05),见图2。2×2析因设计的方差分析显示,福善美与运动2种处理方式之间不存在交互作用(P >0.05),见表2。
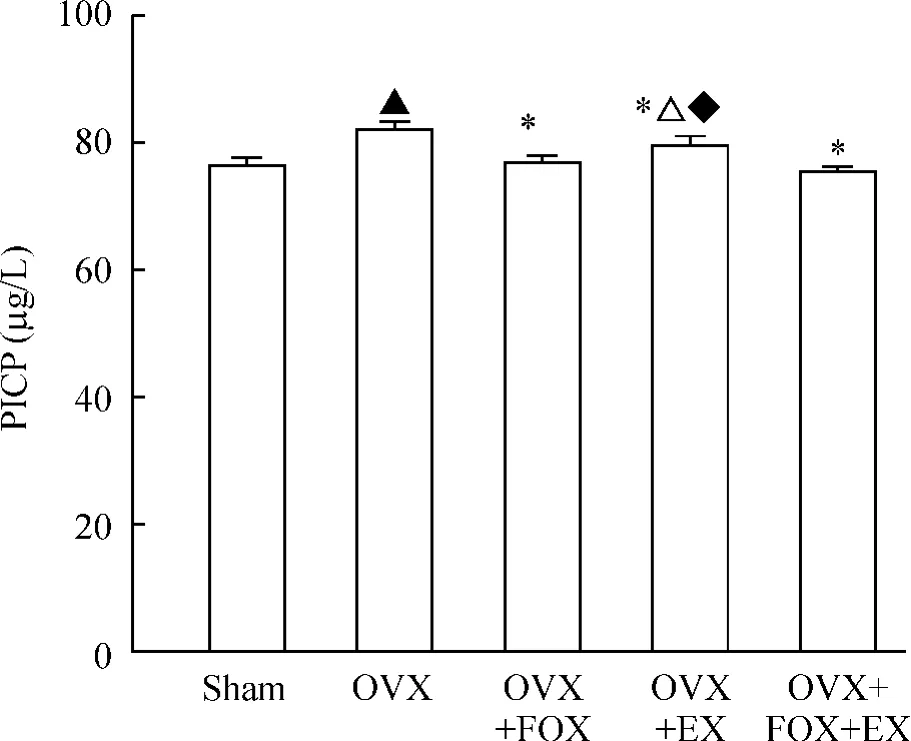
Figure 2.Effects of EX and/or FOX on serum type I procollagen carboxy-terminal propeptide after 12-week treatment in ovariectomized rats.±sE.n=14~18,▲P<0.05 vs sham group;*P <0.05 vs OVX group;◆P <0.05 vs OVX+FOX group;△P <0.05 vs OVX+FOX+EX group.图2 运动和(或)福善美对去卵巢骨质疏松大鼠血清型前胶原羧基端前肽的影响
5 运动和(或)福善美对去卵巢骨质疏松大鼠血清Ⅰ型胶原羧基端交联端肽的影响
如图3所示,去卵巢骨质疏松大鼠干预治疗12周后,模型组大鼠血清ICTP含量显著升高(P<0.05 vs sham)。福善美、运动与福善美联合均可显著降低模型组血清ICTP含量(P<0.05)。运动与福善美联合治疗组较运动单独治疗组ICTP含量降低明显(P<0.05),与福善美单独治疗组相比,未见明显差异(P>0.05)。福善美与运动2个单独治疗组之间无明显差异。2×2析因设计的方差分析显示,福善美与运动2种处理方式之间不存在交互作用(P>0.05),见表 2。

Figure 3.Effects of EX and/or FOX on serum typeⅠcollagen carboxy-terminal cross-linked telopeptide after 12-week treatment in ovariectomized rats.±sE.n=14~18,▲P <0.05 vs sham group;*P <0.05 vs OVX group;△P <0.05 vs OVX+FOX+EX group.图3 运动和(或)福善美对去卵巢骨质疏松大鼠血清Ⅰ型胶原羧基端交联端肽的影响
讨 论
OP是一种全身性代谢障碍疾病,严重影响患者生活质量和预期寿命[1-3]。雌激素对骨量维持至关重要,它既能通过对降钙素、甲状旁腺激素的影响而抑制骨钙释放;又可通过成骨细胞、破骨细胞上的雌激素受体(estrogen receptor,ER)而影响骨量[8-9]。绝经后由于卵巢功能低下,血清雌激素水平下降,继而出现骨质疏松,即PMOP。PMOP表现为高转换型骨质疏松,即骨吸收与骨形成均活跃,但以骨吸收为主[4]。绝经后骨质疏松的发病机制及其治疗和防治的研究,仍然是医学界面临的重大难题,具有重要的临床意义。
二膦酸盐(bisphosponates)是目前治疗OP的最有效药物之一,其作用于破骨细胞的骨吸收环节,用于预防和治疗原发性和糖皮质激素、甲状腺激素及肝素等引起的继发性OP[10]。在骨质疏松的防治方法中,运动疗法是一种最经济和基本的有效方法[10]。然而,绝经后骨质疏松病人在服用二膦酸盐治疗的同时辅以运动,是否可增强单独药物治疗对绝经后骨质疏松的疗效?尚缺乏研究。因此,本实验通过大鼠卵巢切除来复制绝经后骨质疏松这一经典模型[11-12],研究二膦酸盐(福善美)和运动联合运用对去卵巢骨质疏松大鼠的治疗作用,观察运动是否可增强福善美对骨质疏松大鼠的治疗作用,为临床绝经后骨质疏松病人的治疗提供理论依据。
BMD指单位面积所含的骨矿物量,它是反映人体骨骼代谢状况的一项重要指标[13]。骨密度是诊断OP的金标准,也是估计骨质疏松的程度、评价骨质疏松疗效的必要手段[13],其高低取决于骨代谢的状况。大鼠卵巢切除8周后,去卵巢模型组大鼠BMD较假手术组显著降低,且血清雌二醇很低或者检测不出来,这说明大鼠卵巢切除8周后骨质疏松模型复制成功。
上述骨质疏松模型复制成功大鼠分为4组:模型组、福善美治疗组、运动治疗组、运动与福善美联合治疗组,分别给予福善美灌胃和(或)跑台运动干预治疗12周后,福善美与运动单用或联合治疗均可显著提高去卵巢骨质疏松大鼠的BMD,且联合运用效果较福善美、运动单独治疗显著。这表明,福善美、运动对去卵巢骨质疏松大鼠均有治疗作用,且运动可增强福善美单独治疗作用。
神经传导是反映患者神经功能改变的重要指标,包括MCV、ML和CMAP等主要指标。MCV是肌电图检查中重要的检查项目,它直接反映了运动神经干的传导功能;ML反映神经传导在运动终板(神经-肌肉接头)的突触延搁时间;CMAP测得同一时刻点肌纤维兴奋电压的综合,反映机体募集运动单位的能力。这3个指标能够客观反映机体运动神经传导功能、肌肉功能和运动能力。我们用肌电图仪检测去卵巢骨质疏松大鼠干预治疗12周后各组大鼠左侧股神经MCV、ML和CMAP。实验结果显示,运动可明显改善神经传导功能,使ML明显缩短(P<0.05 vs sham),而福善美在改善神经传导功能方面,并未显示其优势。这说明,运动作为一种康复形式,能很大程度的改变卵巢切除所致的骨质疏松对神经传导的影响,这可能与运动增加NO合成量,增强突触可塑性,促进损失的神经细胞结构修复和神经功能的恢复[14];加强关节周围肌肉的力量,增强关节的稳定性,提高肌肉、关节周围韧带的伸展性[14];增加骨密度,在压力和张力作用下,骨小梁曲线排列整齐,从而增加骨的抗压、抗扭转、抗折和抗弯曲能力[14]等作用有关。
骨是具有新陈代谢的活组织,破骨细胞不段吸收旧骨,成骨细胞不断形成新骨,骨形成和骨吸收紧密联系形成骨重建(bone remodeling)。当骨重建处于平衡状态时,骨量维持稳定。骨形成的相对减弱和骨吸收的相对增强即二者的偶联障碍导致骨质疏松的发生。骨代谢过程中新骨不断形成,旧骨不断被沉积到骨,同时又不断地从骨中释放到血循环中,通过测定血尿等骨生化标志物可直接了解骨的生理和病理代谢变化[15]和骨转换率,临床上可作为骨质疏松症早期诊断的指标之一[16]。PICP是OB合成的前胶原转化为I型胶原过程中被等比例剪切掉的一种小分子多肽,因此PICP代表等量的骨胶原合成,是反映OB活性和胶原合成速率的特异指标,也是反映骨转换的敏感生化指标[17]。PICP升高提示Ⅰ型胶原合成速率加快,进而可增加骨的韧性和强度。ICTP是I型胶原降解释放出的含有8个氨基酸序列的小肽片段,只存在于I型胶原C末端,是目前唯一知道的I型胶原降解的特异性标志物,是特异性骨吸收指标[18]。正常情况下,I型胶原被降解甚微,ICTP在血中含量很少;在病理刺激下,破骨细胞活性增强,大量降解I型胶原,血中 ICTP含量增高[19-21]。
本实验中,大鼠卵巢切除后PICP和ICTP较假手术组均显著增高,说明卵巢切除大鼠处于高转换状态。这是由于大鼠卵巢切除后,雌激素水平下降,骨吸收显著增加;骨吸收增加又可通过偶联激活骨形成,因此,大鼠骨形成和骨吸收水平均增高。但由于骨吸收大于骨形成,故表现为高转换型骨质疏松类型。福善美(阿伦膦酸钠)能抑制骨吸收,其作用机制与干扰破骨细胞成熟、影响破骨细胞活性、改变骨特性有关。因此,运用福善美干涉治疗去卵巢骨质疏松大鼠12周后,PICP和ICTP较模型组均显著下降。运动和福善美联合运用亦可降低PICP和ICTP,且联合运用治疗组PICP和ICTP指标与运动单独治疗组比较,效果显著提高。
此外,我们又采用2×2析因设计的方差分析统计方法,进一步考察福善美与运动之间是否存在交互作用。分析显示,福善美与运动在各指标间均无交互作用,而完全随机设计的方差分析显示,福善美与运动联合运用较单独使用效果显著,这进一步提示,福善美与运动在治疗骨质疏松时单独发挥作用,当二者联用时有叠加作用。
综上可见,福善美和运动均可通过抑制骨吸收来改善骨转换状态,从而提高卵巢切除大鼠的骨密度值和改善其神经传导功能,且运动可增强福善美对去卵巢骨质疏松大鼠的治疗作用。但运动和福善美是通过何种机制来抑制破骨细胞的骨吸收作用,还有待进一步研究。
[1]邓红文,刘耀中.骨生物学前沿[M].第1版.北京:高等教育出版社,2006:27.
[2]Kanis JA,Black D,Cooper C,et al.A new approach to the develoment of assessment guidelines for osteoporosis[J].Osteoporosis Int,2002,13(7):527 -536.
[3]叶任高.内科学[M].第5版.北京:人民卫生出版社,2001:885.
[4]Smith G,Stassen L,Flint S.Treating osteoporosis[J].Ir Med J,2009,102(3):88.
[5]杨路昕,蔡 辉.原发性骨质疏松症的中医病因病机研究进展[J].河北中医,2009,31(3):467-469.
[6]Vicente - Rodríguez G.How does exercise affect bone development during growth[J].Spors Med,2006,36(7):561-569.
[7]潘宏良,何 德.运动疗法与磁疗、光疗改善老年骨质疏松症患者骨密度及腰背痛的效果评价[J].中国临床康复,2005,8(24):5072-5073.
[8]Komm BS,Terpening CM,Benz DJ.Estrogen binding,receptor mRNA,and biologic response in osteoblast-like osteosarcoma cells[J].Science,1988,241(4861):81-84.
[9]Eriksen EF,Colvard DS,Berq NJ.Evidence of estrogen receptors in normal human osteoblast- like cells[J].Science,1988,241(4861):84-86.
[10]Delmas PD,McClung MR,Zanchetta JR,et al.Efficacy and safety of risedronate 150mg once a month in the treatment of postmenopausal osteoporosis[J].Bone,2008,42(1):36-42.
[11]Kalu DN.The ovariectomized rat model of postmenopausal bone loss[J].Bone Miner,1991,15(2):175 -192.
[12]谢 肇,李起鸿,孟 萍,等.去卵巢大鼠骨质疏松模型的特点[J].中国临床康复,2006,10(28):79-81.
[13]李宝芬,闫国强.续断对去势大鼠骨密度的影响[J].中国中医骨伤科杂志,2012,20(1):15-16.
[14]吴伟奋,陈春美,董 华,等.有氧训练对大鼠局灶性脑缺血后神经功能修复的实验研究[J].体育科学,2008,28(2):59-62.
[15]陈一凡,黄宏兴,李 颖.骨康对去卵巢大鼠骨源性碱性磷酸酶和胰岛素样生长因子的影响[J].中国骨伤,2009,22(2):119-121.
[16]贾玉巧,王宇梅,高艳荣,等.大鼠骨质疏松模型中骨碱性磷酸酶和白细胞介素-6及肿瘤坏死因子-α的表达[J].中国妇幼保健,2007,20(36):5188-5190.
[17]Rotteveel J,Schonte E,Del emarre W.Serum procollaen I carboxytermmal propeptide(PICP)levels through puberty:reation to height velocity and serum hormone levels[J].Acta Daediatr,1997,86(2):143 -147.
[18]Garnero P,Sornay - Rendu E,Chapuy MC,et al.Increased bone turnover in late postmenopausal women is a major determinant of osteoporosis[J].J Bone Miner Res,1996,11(3):337-349.
[19]Srivastava AK,MacFarlane G,Srivastava VP.A new monoclonal antibody ELISA for detection and characterization of C-telopeptide fragments of type I collagen in urine[J].Calcif Tissue Int,2001,69(6):327 -336.
[20]Huber F,Traber L,Roth HJ.Markers of bone resorption-measurement in serum,plasma or urine?[J].Clin Lab,2003,49(5-6):203-207.
[21]Zoli A,Lizzlo MM,Capuano A.Osteoporosis and bone metabolism in postmenopausal women with osteoarthdtis of the hand[J].Menopause,2006,13(3):462-466.
