Myosin VI在人体不同癌组织中的差异表达及意义*
2012-01-30虞红珍徐勤枝周平坤
虞红珍, 祝 敏, 王 豫, 徐勤枝, 周平坤△
(1安徽医科大学基础医学院病理学与病理生理学教研室,安徽合肥230032;2军事医学科学院放射与辐射医学研究所,北京100850)
肌球蛋白VI(myosin VI)是其家族中唯一一个向微丝负极移动的蛋白,能水解ATP酶产生能量推动肌动蛋白丝的运动,是细胞的马达蛋白,能为细胞的迁移提供动力,参与吞饮或吞噬泡的运输,负责将高尔基体的分泌泡运输到胞内适当的位置等[1-4]。Yoshida等[5]发现 myosin VI在卵巢癌中异常高表达,与肿瘤的侵袭转移密切相关。但在人体其它肿瘤中没有做进一步的探讨。本研究通过cDNA多肿瘤表达谱阵列芯片技术筛查myosin VI在19种人体不同肿瘤组织和10种肿瘤细胞株中的表达情况,进一步采用组织芯片,利用免疫组化方法检测myosin VI在不同病理分级卵巢上皮肿瘤组织中的表达情况,以验证芯片结果的准确性,从而为探讨myosin VI在肿瘤中的作用机制提供实验基础。
材料和方法
1 材料
Cancer Profiling ArrayⅡ及Express Hyb杂交液为Clontech产品;引物合成与序列测定由北京英骏生物有限公司完成;Prime-a-Gene标记试剂盒为Promega产品;myosin VI单抗购自 Sigma;DNA Taq聚合酶为鼎国生物有限公司产品;琼脂糖凝胶回收试剂盒为天根生化(北京)公司产品;[α-32P]dCTP购自北京福瑞生物有限公司;不同病理级别人卵巢癌及癌旁正常组织组织芯片及资料由解放军总医院病理科自制提供;免疫组化检测试剂(SP法)及二氨基联苯胺(3,3'-diaminobenzidine,DAB)显色试剂盒由北京中杉金桥生物技术公司购买。
2 Northern杂交
2.1 探针合成与标记 以HeLa细胞cDNA为模板,以myosin VI mRNA序列随机设计1对引物,扩增myosin VI片段用于Northern杂交。引物序列为:上游引物 5'- CGGAGGAGACACAAACCT -3',下游引物5'-GCTATCTCCGCAGCGCCAGGT -3'。反应条件为94 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,35 个循环;产物600 bp。将目的PCR产物割胶回收纯化,DNA测序后,按照 Prime-a-Gene标记试剂盒的说明用[α-32P]dCTP标记探针。
2.2 Northern杂交 将杂交液在68℃预热,加入150 μL(1.5 mg)变性鲑鱼精 DNA。将芯片置于杂交管中,加入10 mL的杂交液,预杂交30 min。弃杂交液,将标记好的探针与5 mL杂交液混匀,加入杂交管,68℃杂交过夜。弃杂交液,200 mL 2×SSC+0.5%SDS,于68 ℃洗膜30 min×3次;200 mL 0.2×SSC+0.5%SDS,于68℃洗膜30 min;最后200 mL 2×SSC,室温洗膜5 min。将芯片小心取出,滤纸吸去表面残留液体,以保鲜膜包裹、压片,于-70℃冰箱显影,3~7 d后显影。以ubiquitin为内参照。
3 芯片杂交图像处理及统计学分析
分别将myosin VI和内参照ubiquitin的杂交胶片于相同条件下拍照,使用Labwork软件对图片上的杂交点进行灰度值及面积分析,结果以Excel表格形式呈现。以myosin VI与ubiquitin的比值作为目的基因的相对丰度。采用SPSS软件进行统计学分析,数据以均数±标准差(±s)表示。数据间比较采用配对t检验、U检验及χ2检验。以P<0.05为差异有统计学意义。
4 组织芯片免疫组化
80例不同病理分级卵巢上皮肿瘤组织芯片的相关资料如下:卵巢癌52例(包含浆液性和黏液性),其中中低分化腺癌(高级别)33例,高分化腺癌(低级别)19例;交界性肿瘤16例;囊腺瘤8例及癌旁组织40例。均为手术切除标本,癌旁组织取邻近肿瘤5 cm以外的正常卵巢上皮组织。采用免疫组化SP法检测myosin VI蛋白的表达情况,染色步骤按照试剂说明书进行。Ⅰ抗为鼠抗人单抗myosin VI(1∶200稀释);所使用的Ⅱ抗试剂盒为福州迈新公司的SP试剂盒,DAB显色,苏木素复染。用已明确myosin VI蛋白表达阳性的切片作为阳性对照,用PBS代替Ⅰ抗作为阴性对照。染色结果以细胞浆/核内出现阳性信号为判断标准,着色强度判读:无色为阴性(-),浅黄色为弱阳性(+),黄色为中等阳性(++),棕黄色或棕褐色为强阳性(+++)。
结 果
1 Myosin VI DNA探针合成
使用PCR的方法,在已知的myosin VI全长mRNA序列中扩增一段DNA片段作为探针序列。通过割胶回收目的条带并纯化后,再次行琼脂糖凝胶电泳,最终得到单一的目的条带,见图1。产物经测序显示正确。
Figure 1.The electrophoretogram of myosin VI probe generated by PCR amplification.图1 PCR扩增的myosin VI DNA探针割胶回收电泳图
2 肿瘤谱阵列芯片杂交结果
Northern杂交结果显示myosin VI在19种肿瘤和癌旁正常组织及10种细胞株中均有表达,见图2。但能用于统计学处理的共有14组(样本数较少的膀胱、女性外阴、前列腺、气管和肝脏共5组未作统计学分析)。统计学分析发现myosin VI在11种肿瘤如卵巢、结肠、乳腺、胃、肺、胰腺等癌组织表达明显高于癌旁组织,其中卵巢癌和结肠癌组织的表达丰度与配对正常组织差异显著(P<0.01);而肾、皮肤和睾丸癌组织中myosin VI的表达是下调的,见图3。

Figure 2.The gene expression map of myosin VI on the Cancer Profiling ArrayⅡ.A:the gene expression map of myosin VI;B:the gene expression map of ubiquitin.1:breast;2:ovary;3:colon;4:stomach;5:lung;6:kidney;7:bladder;8:vagina;9:prostate;10:trachea;11:liver;12:uterus;13:cervix;14:rectum;15:thyroid;16:testis;17:skin;18:small intestine;19:pancreas;20:cell lines(from up to down:HeLa,Daudi,K562,HL60,G361,A549,MOLT4,SW480 and Raji).N:normal;T:tumor;UBI:ubiquitin.图2 Myosin VI在Cancer Profiling ArrayⅡ中的表达图谱
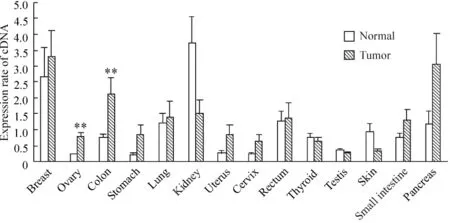
Figure 3.Altered expression of myosin VI in diverse human carcinomas and adjacent normal tissues.±s.n=154.**P<0.01 vs normal.图3 人体不同癌及其癌旁组织中myosin VI的差异表达
3 组织芯片免疫组织化学结果
Myosin VI只表达于卵巢上皮细胞,阳性信号定位于细胞浆,细胞核也有少量表达。在癌旁及囊腺瘤组织中不表达或弱表达,阳性率为10.4%(5/48);交界性肿瘤表达阳性,阳性率为81.3%(13/16);而在癌组织中均表达,阳性率为100%(52/52),且表达强度明显增强,见图4、表1。按组织分化程度不同将卵巢肿瘤分为高级别(中低分化)、低级别(高分化)和交界性肿瘤共3组,其表达呈中等阳性(++)以上的阳性率分别为87.9%(29/33)、73.7%(14/19)和31.3%(5/16),经 χ2检验前两者差异不明显(P>0.05),但后两者之间差异显著(P<0.05)。Myosin VI在卵巢的交界性上皮肿瘤、低级别卵巢癌和高级别卵巢癌的表达呈逐渐增强趋势,见表1。
讨 论
肿瘤谱阵列芯片技术是从人体不同癌和配对的癌旁组织中提取的cDNA样本,呈点状阵列排布固定于尼龙杂交膜,通过与靶基因杂交,分析靶基因在不同癌组织中的表达差异,该技术的优点在于信息量大,实验过程简单方便,一次Northern杂交可以分析靶基因在几十种不同癌组织中的表达差异,避免多次实验造成的批次间的实验误差并可减少实验成本,为靶基因功能的深入研究提供依据[6-7]。

Figure 4.The expression of myosin VI in cystadenoma(A),borderline ovarian tumor(B)and ovarian carcinoma(C)(immunohistochemical staining,×200).图4 Myosin VI在囊腺瘤、交界性卵巢肿瘤及卵巢癌中的表达

表1 Myosin VI在各种卵巢肿瘤及癌旁组织中的表达Table 1.Differentiated expression of myosin VI in diverse ovarian tumors and adjacent normal tissues
Myosin VI有动力马达之美称,能水解ATP酶产生能量推动肌动蛋白丝的运动,从而促使微丝聚合,为细胞内及细胞之间的运动迁移、物资运输等提供动力。早期的研究显示myosin VI基因的点突变可导致耳聋和不育,并已证实其在内耳的功能是稳定静纤毛基底的连接[8-9];表明 myosin VI与细胞的运动、迁移密切相关。现有的报道显示myosinVI与肿瘤的侵袭转移密切相关:Geisbrecht等[10]发现myosinVI起着维持调控E-cadherin和beta-catenin蛋白的作用。而Yoshida等[5]通过果蝇来模拟人卵巢癌迁移实验中,发现myosinVI在正常的卵巢组织中低表达,但在高度恶性的卵巢癌中高度表达,同时抑制卵巢癌中的myosinVI的表达量可以减弱肿瘤细胞的扩散,提示myosinVI在卵巢癌细胞的迁移中起到至关重要的作用。在人的前列腺癌中也发现中分化前列腺癌持续过表达myosin VI蛋白,而侵袭性强的前列腺癌组织myosin VI的表达更强于侵袭性弱的[11-12];近期文献报道免疫组化标记 myosin VI、E -cadherin和β-catenin可以作为肾癌诊断的分子标志物,与肾癌的预后相关[13]。上述研究说明myosin VI参与微丝聚合,促使细胞运动迁移,在肿瘤的侵袭转移中扮演极为重要的角色。那是否所有的上皮恶性肿瘤中都有myosin VI的表达,扮演着肿瘤转移关键因子的作用呢?
本实验cDNA肿瘤谱列阵芯片包括了源自人体19种不同癌组织和配对正常组织cDNA样本及10种肿瘤细胞株,其中12对组织各有10对cDNA样本,小肠和胰腺各7对,膀胱5对,女性外阴5对,前列腺4对,气管3对,肝脏3对,连同10种肿瘤细胞株总共154对。每对样本均取自同一病人的肿瘤组织及癌旁5 cm以外的正常组织,通过病理学形态检测无误。一次Northern杂交即可完成myosin VI在不同癌组织中的表达情况,因膀胱等5对组织样本量相对较少,本实验未纳入统计学分析;在其余14种上皮肿瘤中,myosin VI在11种肿瘤如卵巢、结肠、乳腺、胃、肺、胰腺等癌组织表达明显高于癌旁组织,其中卵巢癌和结肠癌组织的表达丰度与配对正常组织差异显著(P<0.01);而在肾、皮肤、睾丸组织中myosin VI表达下调;这与 Yoshida等[5]报道的基本一致。前列腺因其只含有4对cDNA样本,未纳入统计学分析,因而与Dunn等[11]的报道有出入。肾癌组织中myosin VI表达下调,但差异没有统计学意义,与前人的研究结果不一致,有待进一步实验验证。
卵巢肿瘤组织芯片进一步证实了Northern杂交结果的准确性,免疫组化结果显示myosin VI只表达于卵巢上皮细胞,阳性信号主要定位于细胞浆,细胞核也有少量表达。其在癌旁及囊腺瘤组织中不表达或弱表达,阳性率为10.4%(5/48);交界性肿瘤表达阳性,阳性率为81.3%(13/16);而在癌组织中均表达,阳性率为100%(52/52)。按组织分化程度不同将卵巢肿瘤分为高级别(中低分化)、低级别(高分化)和交界性肿瘤共3组,其表达呈中等阳性(++)以上的阳性率分别为 87.9%(29/33)、73.7%(14/19)和31.3%(5/16),经χ2检验前两者差异不明显(P>0.05),但后两者之间差异显著(P<0.05)。Myosin VI在卵巢的交界性上皮肿瘤、低级别卵巢癌和高级别卵巢癌的表达呈逐渐增强趋势。这说明myosin VI不仅在卵巢癌组织异常高表达,验证了芯片结果的可靠性,还进一步发现myosin VI的表达与卵巢癌的组织分化程度密切相关,随着恶性度的增强其表达也呈逐渐增强趋势。本研究提示myosin VI可能在卵巢癌的发生、发展中起重要作用,可能与卵巢癌的侵袭转移相关。而myosin VI在其它肿瘤如结肠癌和肾癌中的作用如何将是下一步实验研究的方向。
[1]Buss F,Spudich G,Kendrick-Jones J.Myosin VI:cellular functions and motor properties[J].Annu Rev Cell Dev Biol,2004,20:649 -676.
[2]Chibalina MV,Poliakov A,Kendrick - Jones J,et al.Myosin VI and optineurin are required for polarized EGFR delivery and directed migration[J].Traffic,2010 ,11(10):1290-1303.
[3]Chibalina MV,Puri C,Kendrick - Jones J,et al.Potential roles of myosin VI in cell motility[J].Biochem Soc Trans,2009,37(5):966 -970.
[4]Swiatecka-Urban A,Boyd C,Coutermarsh B,et al.Myosin VI regulates endocytosis of the cystic fibrosis transmembrane conductance regulator[J].J Biol Chem,2004,279(36):38025-38031.
[5]Yoshida H,Cheng W,Hung J,et al.Lessons from border cell migration in the Drosophila ovary:a role for myosin VI in dissemination of human ovarian cancer[J].Proc Natl Acad Sci U S A,2004,101(21):8144 -8149.
[6]Giltmane JM,Rimm DL.Technology insight:Identification of biomarkers with tissue microarray technology[J].Nat Clin Pract Oncol,2004,1(2):104 -111.
[7]Fricano MM,Ditewig AC,Jung PM,et al.Global transcriptomic profiling using small volumes of whole blood:a cost-effective method for translational genomic biomarker identification in small animals[J].Int J Mol Sci,2011,12(4):2502-2517.
[8]Sato O,White HD,Inoue A,et al.Human deafness mutation of myosin VI(C442Y)accelerates the ADP dissociation rate[J].J Biol Chem,2004,279(28):28844 -28854.
[9]Kelleher JF,Mandell MA,Moulder G,et al.Myosin VI is required for asymmetric segregation of cellular components during C.elegans spermatogenesis[J].Curr Biol,2000,10(23):1489 -1496.
[10]Geisbrecht ER,Montell DJ.Myosin VI is required for E-cadherin-mediated border cell migration[J].Nat Cell Biol,2002,4(8):616 -620.
[11]Dunn TA,Chen S,Faith DA,et al.A novel role of myosin VI in human prostate cancer[J].Am J Pathol,2006,169(5):1843-1854.
[12]Puri C,Chibalina MV,Arden SD,et al.Overexpression of myosin VI in prostate cancer cells enhances PSA and VEGF secretion,but has no effect on endocytosis[J].Oncogene,2010,29(2):188-200.
[13]Ronkainen H,Kauppila S,Hirvikoski P,et al.Evaluation of myosin VI,E-cadherin and beta-catenin immunostaining in renal cell carcinoma[J].J Exp Clin Canc Res,2010,29:2.
