孕期染毒PFOS对雄性胎鼠生殖系统的影响
2012-01-30金秀东初彦辉赵冰海张际绯
李 欣,金秀东,初彦辉,赵冰海,李 丽,张际绯
(牡丹江医学院1医药研究中心,2生理教研室,3组胚教研室,黑龙江牡丹江157011)
在西方发达国家,男性生殖障碍发病率逐年上升,已成为一个受重视的问题。男性儿童生殖系统的畸变包括尿道下裂和隐睾,青春期发育的紊乱和成年生殖系统的肿瘤以及精子发生障碍统称为睾丸紊乱综合征。已有一些动物实验和流行病学研究表明这些疾病与胎儿期母体及胎儿暴露于环境内分泌干扰因素有关。全氟有机化合物作为一种人造材料具有持久性、高度生物累积性、毒性及可以远距离环境迁移的特点,符合斯德哥尔摩公约关于持久性有机污染物定义特征,因而引起了更加广泛的关注,全球限用全氟辛烷磺酸盐(perfluorooctane sulfonate,PFOS)及其衍生物的呼声越来越高。胚胎期Leydig细胞只出现在胚胎期睾丸中,因此认为其分化受染色体组分或睾丸特殊机制调控。本研究利用出生前PFOS暴露的染毒方式,监子代一般毒性和睾丸内 Cyp17α1 mRNA表达水平以探讨PFOS致生殖毒性的可能机制,为PFOS安全性评价提供科学依据。
1 材料与方法
1.1 实验动物 动物为清洁级成年SD大鼠,体质量250~300 g,购自北京维通利华实验动物技术有限公司。大鼠饲养于其底装铺垫料的多聚碳酸塑料笼具,每笼饲喂1只,连接于独立供气动物笼系统,温度控制在20~25℃,相对湿度40%~60%。照明为普通日光灯,12 h明亮,12 h黑暗。上述动物按随机数字法分为4组:0.05%TW-20(对照组)、5 mg/(kg·d)(低剂量灌胃组)、、10 mg/(kg·d)(中剂量灌胃组)、20 mg/(kg·d)(高剂量灌胃组),各4只。
1.2 方法
1.2.1 材料与试剂 试剂PFOS购于sigma公司,RNA提取试剂盒(OMEGA,USA,SYBR(TAKARA,大连)引物设计参照GenBank中序列由上海Invitrogen公司合成,18Srna为内参序列。
1.2.2 动物染毒 SD孕鼠,从孕第11天至孕第19天,每天对给药动物组腹腔注射染毒PFOS。胎鼠睾丸于母鼠怀孕第20天处死孕鼠,取出胎鼠,记录胎鼠个数,并称量胎鼠个体的质量。立体显微镜下解剖胎鼠,辨明其雌、雄,观察睾丸位置和睾丸引带发育情况。同一胎鼠的2只睾丸分别用于提取 RNA和蛋白质,均保存于液氮备用。
1.2.3 real-time聚合酶链反应检测mRNA 取一侧胎鼠睾丸提取RNA,操作按RNA提取试剂盒说明要求进行,经紫外分光光度计测定 D260/D280比值均>1.8,可用于后续反转录-聚合酶链反应实验。样本设两个复孔,取其CT均值,根据标准曲线算出目的基因相对表达量。聚合酶链反应引物序列见表1。
1.3 统计学方法 采用SPSS 18.0软件进行统计分析,计量资料用均数±标准差)表示,多组比较采用方差分析,组间两两比较采用Bonferroni检验,P<0.05为差异有统计学意义。
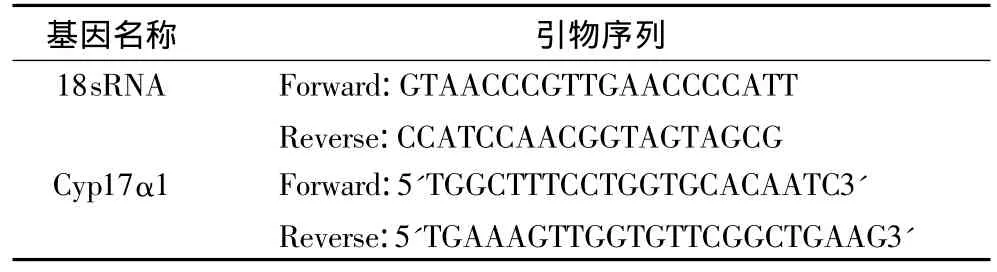
表1 real-time PCR所用引物
2 结果
2.1 四组孕鼠平均胎鼠个数、雌雄比例、雄胎鼠体重和睾丸质量的比较 四组孕鼠平均胎鼠数、雄性胎鼠体质量、睾丸重量比较差异有统计学意义(P<0.05);与对照组比较,低剂量组孕鼠平均胎鼠数增多(P<0.05),低剂量组和高剂量组雄性胎鼠体质量均明显降低,中剂量组升高(P<0.01),高剂量组睾丸重量下降(P<0.05)(表2)。

表2 四组孕鼠平均胎鼠个数、雌雄比例、雄胎鼠体重和睾丸质量比较
2.2 睾丸内Cyp17α1 mRNA表达水平的变化 各给药组与对照组比较,睾丸组织中Cyp17α1的表达量明显下降(P<0.01)(图1)。
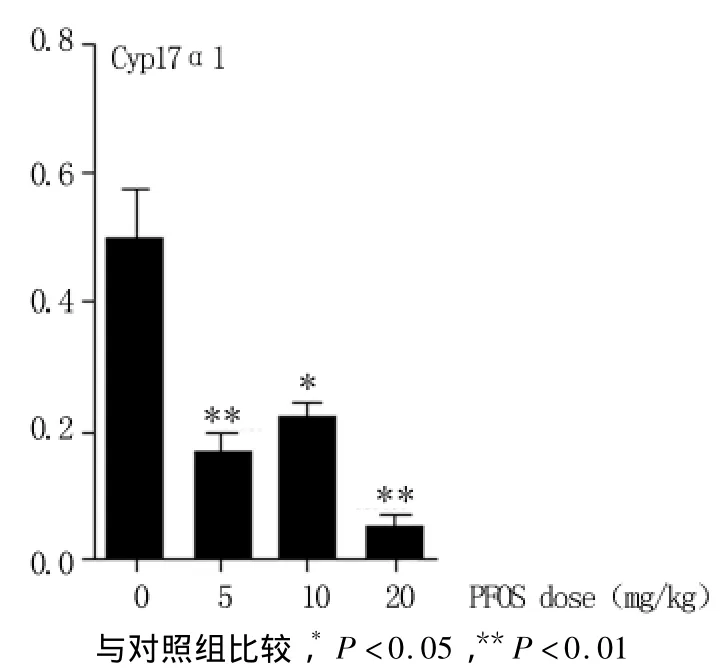
图1 睾丸内Cyp17α1 mRNA表达水平的变化
3 讨论
长期以来,人们通常把化学物质对胚胎或胎儿的潜在毒性效应视为研究生殖毒理学的重点。近年来很多研究表明,化学物质对生殖的损害都表现在对性腺的损害。因此,以性腺为研究对象可以更直接的表现化学物质对生殖系统的毒性,发掘睾丸紊乱综合征的原因。Leydig细胞是一类位于哺乳动物睾丸曲细精管间的间质细胞,它在睾丸发育、精子发生、雄性表型及生精管道的发育中行使重要的功能。Leydig细胞可分为胎儿型及成年型。胎儿型Leydig的主要功能是产生雄激素,维持机体男性化[1]。
研究发现啮齿类动物胚胎发生期的胚胎Leydig细胞在妊娠第12天出现,出生前1~2 d其合成能力达到最强,出生后很快消失[2]。本研究选择暴露期从母鼠受孕第12天起,至第19天结束灌胃的方式染毒。结果显示,与对照组比较,低剂量组孕期暴露于PFOS的孕鼠平均妊娠胎鼠数数量增多(P<0.05),其原因是怀孕中期给药,孕鼠暴露于PFOS时胚胎数和性别基因已经确定,因此无法说明PFOS对胚胎发育的个数和性别确实有影响,此参数只作为参考。与对照组比较,低剂量组和高剂量组雄性胎鼠体质量均明显降低(P<0.05),而中剂量组则升高(P<0.01),说明PFOS对胚胎发育有影响。
睾酮是外源性化学物质影响雄性生殖系统的靶标之一。它主要由Leydig分泌,能刺激雄性生殖器官的成熟和发育、促进蛋白质合成、促进精子发生,并且通过负反馈调节机制使雄激素的分泌相对稳定,从而维持机体的正常生理功能。它的生成需要一些酶的参与,如细胞色素 P450胆固醇侧链裂解酶、β-羟-类固醇脱氢酶、17α羟化酶(P450c17)、17β羟类固醇脱氢酶,其中只有 P450c17相对的基因Cyp17α1与对照组相比表达降低,差异有统计学意义(P<0.01)。Cyp17α1基因全长大约6 kb,含有8个外显子,在人体的染色体中定位于10q24.3,编码508个氨基酸,是单拷贝基因[3]。P450c17在啮齿类动物的性腺和胎盘中表达而不是在肾上腺,雄性则主要在睾丸中表达[4]。
有实验表明,雌性大鼠孕期摄入环境雌激素可减少雄性胎鼠睾丸间质中合成睾酮所必需的P45017α-羟化酶/C17,20裂解酶的表达,从而减少睾酮的合成量,影响胎鼠的雄性化过程[5]。P450c17是睾酮生成的关键酶,而且在早期胚胎发育的调节中发挥重要作用。有人在正常小鼠胚胎内胚层发现了P450c17酶的活性,删除鼠标P450c17基因可导致早期胚胎死亡[6]。在本实验中,与对照组比较,各给药组Cyp17α1基因表达均降低,表明PFOS对Cyp17α1有抑制作用。P450c17是 Cyp17α1基因的产物,P450c17是把孕酮转变成雄烯二酮的关键酶,Cyp17α1表达减少可导致睾酮生成减少。综上所述,PFOS具有发育和生殖毒性,孕期接触PFOS可引起胚胎发育和雄性生殖系统的异常。
[1] O'Shaughnessy PJ,Baker PJ,Johnston H.The foetal Leydig cell differentiation,function and regulation[J].Int J Andro,2006,29(1): 90-95.
[2] Habert R,Brignaschi P.Developmental changes in in vitro testosterone production by dispersed Leydig cells during fetal life in rats[J].Arch Androl,1991,27(2):65-71.
[3] Brock BJ,Waterman MR.Biochemical differences between rat and human cytochrome P450c17 support the different steroidogenic needs of these two species[J].Biochemistry,1999,38(5):1598-606.
[4] Shi Y,Schonemann MD,Mellon SH.Regulation of P450c17 expression in the early embryo depends on GATA factors[J].Endocrinology,2009,150(2):946-956.
[5] Colbron T,Vom Saal FS,Soto AM,et al.Developmental effects of endocrinedi-rupting chemicals in wildlife and humans[J].Environ Health Perspect,1993,101(5):378-338.
[6] Bair SR,Mellon SH.Deletion of the mouse P450c17 gene causes early embryonic lethality[J].Mol Cell Biol,2004,24(12):5383-5390.
