激肽释放酶相关肽6对乳腺癌细胞迁移侵袭的影响及其组织表达意义
2012-01-30黄福生黎汉忠刘志辉王洪学李永强
黄福生,黎汉忠,刘志辉,王洪学,李永强※
(1.扶绥县人民医院普外科,广西扶绥532100;2.广西医科大学附属肿瘤医院化疗一科,南宁530021)
乳腺癌为常见的人类恶性肿瘤。在西方发达国家,乳腺癌为最常见的女性恶性肿瘤[1]。传统观点认为我国属于乳腺癌相对低发地区,然而近年来我国乳腺癌发病率呈上升趋势[2],这种态势在生活水平高的地区尤为明显。据统计,乳腺癌发病率已居我国女性恶性肿瘤的第2位,在沿海经济发达地区已经成为发病率居首的女性恶性肿瘤。手术切除是治疗乳腺癌的基本手段,但部分具有远处侵袭倾向,恶性程度高的乳腺癌患者出现术后复发,并且往往对术后放化疗相对不敏感,而远处转移是这部分患者死亡的主要原因。因此,寻找可早期判断转移倾向的分子标志物,乃至探索预防转移的有效干预点显得尤为迫切。众多研究已经表明肿瘤细胞从静息状态到转移侵袭的激活,其所处的局部微环境发挥了决定性的作用。肿瘤间质是肿瘤微环境的重要组成部分,肿瘤间质分泌的各种蛋白酶调节着肿瘤细胞的功能状态。本课题研究了激肽释放酶相关肽6 (kallikrein-related peptidase 6,KLK6)对人乳腺癌细胞株MDA-MB-231迁移及侵袭运动的影响及其高表达的临床意义。
1 材料与方法
1.1 实验材料
1.1.1 细胞培养液及其试剂 细胞培养采用的胎牛血清为杭州四季青公司产品; DMEM培养基,D-Hanks缓冲液为美国Introvigen公司产品;胰蛋白酶为美国Amresco公司产品。细胞培养液由10%胎牛血清加入DMEM培养基中制备而成,每升培养液含青霉素1×105U及链霉素0.1 g。将胰蛋白酶(终浓度0.25%)溶于D-Hanks液后过滤除菌后用于细胞消化传代。人激肽释放KLK6重组蛋白购于美国My-BioSource公司,溶于二甲基亚砜(dimethyl sulfoxide,DMSO)中后4℃保存备用。
1.1.2 实验用细胞株及乳腺癌组织收集 人乳腺癌细胞株MDA-MB-231购自中南大学湘雅中心实验室。细胞常规置于37℃含5%的CO2的细胞培养箱中。收集2009年11月至2010年12月在广西医科大学附属肿瘤医院或广西壮族自治区扶绥县人民医院手术切除的29例乳腺癌组织标本,所有样本均由病理诊断证实,且均为第1次手术治疗,未经放化疗等其他治疗。所收集组织标本取得患者知情同意。
1.1.3 Transwell实验用培养板及细胞外基质 12孔嵌入式细胞培养板(直径10.5 mm,孔径8 μm)为美国BD Biosciences公司产品。该培养板分为嵌入式的上小室与底部的下室,上小室与下室之间由聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)膜相隔,8 μm的孔径可容细胞通过。细胞外基质购于美国BD Biosciences公司,用于实验前预处理并覆盖PET膜。
1.1.4 反转录-聚合酶链反应试剂 TRIzol与反转录试剂盒分别购于美国Invitrogen及Promeag公司,TaKaRa Ex Taq耐热性DNA聚合酶为上海生工生物工程公司产品,引物委托上海生工生物工程公司合成。
1.2 实验方法
1.2.1 划痕试验 细胞接种于35 mm培养皿,培养至细胞相互融合铺满整个培养皿后,用无菌普通枪头在培养皿均匀划痕。无菌PBS缓冲液冲洗3次,换入新鲜培养液,处理组含40 nmol/L人KLK6重组蛋白,该浓度参考以往文献[3],对照组加入等量DMSO。拍照并观察细胞于划痕处的迁移情况,12 h及24 h后重新于同一视野重新拍照,运用 Quantitative Wound Healing Image Analysis(德国Ibidi公司)在线分析软件,以细胞覆盖划痕处的百分率定量评价细胞的迁移能力。随机选取6处视野,通过比较两组间均数评价其统计学意义。
1.2.2 Transwell细胞侵袭实验 105的MDA-MB-231细胞重悬于10-3/L的无血清DMEM培养液中并接种于上小室,下室放置含10%血清的DMEM培养液。处理组上小室及下室含40 nmol/L人KLK6重组蛋白,处理组加入等量DMSO作为对照,每组6复孔。24 h后移去上小室,4%甲醛用于固定进入下室的细胞,结晶紫染色液染色,Quantity One软件(美国Bio-Rad公司)测量细胞数,计算24 h后通过PET膜进入下室的细胞数,定量分析处理组与对照组的细胞侵袭能力。
1.2.3 半定量反转录-聚合酶链反应 按Trizol试剂盒说明提取29例乳腺癌手术切除标本的总RNA,按反转录试剂盒说明合成cDNA。寡聚核苷酸引物: (KLK6,正义链,5'-GAAGCATAACCTTCGGCAAA-3';反义链,5'-GGGAAATCACCATCTGCTGT-3'),内参照磷酸甘油醛脱氢酶(GAPDH,正义链,5'-ACCACAGTCCATGCCATCAC-3';反义链,5'-TCCACCACCCTGTTGCTGTA-3')。聚合酶链反应扩增反应条件:预变性94℃ 5 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,28个循环,72℃延伸4 min (聚合酶链反应仪为美国Thermo公司产品)。反应结束后,取聚合酶链反应产物各5 μL,2%琼脂糖凝胶电泳,凝胶电泳成像分析系统扫描。ImageJ软件取得各样本电泳条带灰度值,利用各样本KLK6/ GAPDH的比值半定量评估KLK6在各样本中的表达高低。
1.3 统计学方法 采用SPSS 13.0软件进行统计学分析,两独立样本均数t检验用于检验组间差异,Fisher确切概率法用于检验KLK6高表达与临床特征的关系,P<0.05为差异有统计学意义。
2 结果
2.1 KLK6对MDA-MB-231细胞迁移活动的影响细胞划痕试验显示在处理12 h后,处理组的细胞覆盖面积为59.3%,而对照组为52.2%,处理组细胞覆盖面积大于对照组,但并无统计学意义;在处理24 h后再次观察,处理组的细胞覆盖面积为84.4%,而对照组为64.7%(图1),表明人激肽释放KLK6重组蛋白明显促进了MDA-MB-231细胞的迁移活动。
2.2 KLK6对MDA-MB-231细胞侵袭能力的影响人KLK6重组蛋白同时加入处理组上小室与下室,对照组加入等量不含重组蛋白的DMSO。24 h后细胞计数显示,处理组进入下室的细胞数平均为(589± 25)个,而对照组为(474±37)个(图2),处理组明显多于对照组,具有统计学意义(t=6.3083,P<0.05),显示激肽释放KLK6增强MDA-MB-231细胞侵袭能力。
2.3 KLK6高表达与临床特征的关系 半定量反转录-聚合酶链反应结果显示KLK6在29例乳腺癌原发灶组织中的灰度比值最大值为0.75,最小值为0.25,中位数为0.45,均数为0.44。以≥0.5定义为高表达,分析KLK6与诸临床特征的关系。所有临床分期均根据美国癌症联合委员会于2003年颁布的乳腺癌TNM分期(第6版)。统计学分析显示,KLK6高表达与年龄、T分期、M分期无关,与N分期,即淋巴转移有关(表1)。
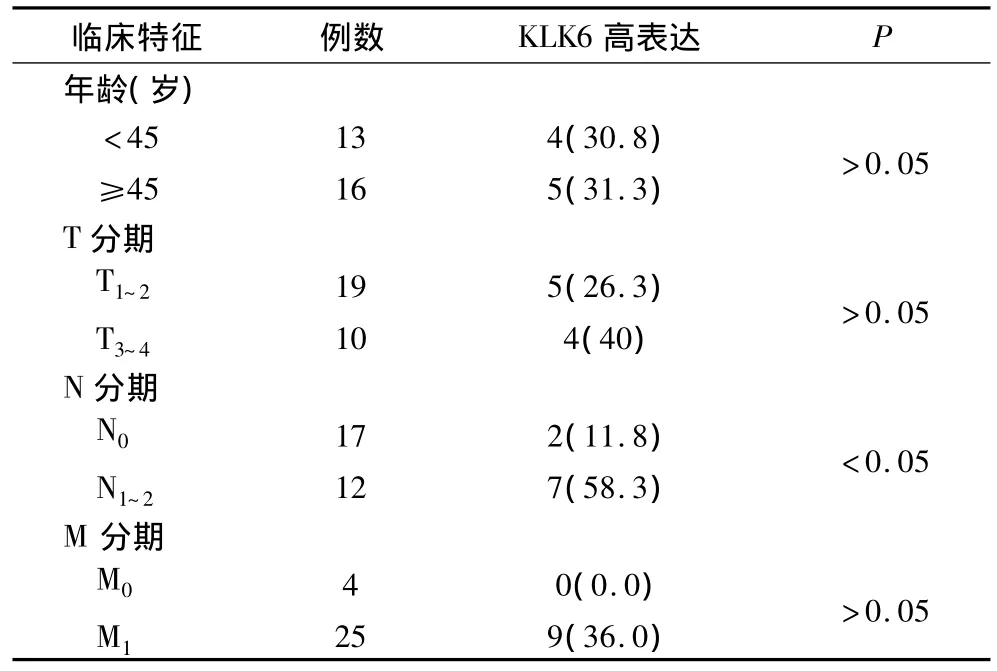
表1 KLK6高表达与临床特征的关系 [例(%)]
3 讨论
KLK6属于激肽释放酶相关肽家族成员,该家族作为分泌糜蛋白酶和胰蛋白酶样丝氨酸蛋白酶代表,在各种生理及病理条件下表达,包括各种人类肿瘤[4-6]。以往研究表明通过转染技术使KLK6在小鼠角质细胞株中异位表达,可破坏细胞间的黏附,加速细胞增殖并增强其迁移、侵袭能力[7]。由于乳腺癌的预后与是否发生淋巴结及远处转移密切相关,本课题研究了人重组KLK6蛋白在体外对乳腺癌细胞株MDA-MB-231迁移及侵袭能力的影响,并研究了其在原发肿瘤中高表达的临床意义。
划痕试验是经典的评估体外细胞迁移能力的方法,操作简便,而本研究进一步通过计算12 h和24 h迁移细胞覆盖划痕处的百分率来定量评价其迁移活动,比传统仅仅通过肉眼观察更为客观可信。本研究还运用Transwell细胞侵袭实验来验证KLK6在体外对MDA-MB-231细胞侵袭能力的增强。Transwell实验是近年来发展起来的可用于评估细胞侵袭能力的实验模型,由于在放置细胞的上小室并没有血清,具有侵袭倾向的MDA-MB-231细胞会向含有血清营养成分的下室运动,与普通的迁移实验不同的是,分隔上下小室的PET膜预先包被了细胞外基质,以模仿体内细胞外基质,细胞若进入下室,则先要分泌基质金属蛋白酶将基质胶降解,方可通过PET膜,这与肿瘤细胞在体侵袭过程是一致的。结果显示,KLK6不仅明显促进了MDA-MB-231细胞的迁移,而且增加了MDA-MB-231细胞的侵袭能力。体外实验提示KLK6表达可能与乳腺癌的转移有关,为此进一步研究了KLK6在乳腺癌组织的表达与临床特征的关系。统计学分析显示,KLK6高表达组的病例其淋巴转移率明显高于低表达组,提示KLK6高表达与乳腺癌的转移倾向密切相关。Breitenbach等[8]报道了在化学药物诱导的小鼠皮肤癌中,KLK6的高表达出现在进展期的肿瘤组织中,而在 Klucky等[7]的报道中,KLK6的异常高表达也与人类皮肤癌的临床进展有关。这些研究的结论与本研究的结果相一致,提示KLK6可能是一个通过增加乳腺癌细胞迁移、侵袭能力而促进乳腺癌发展的肿瘤相关蛋白。一项新近的报道初步探讨了KLK6作用于肿瘤微环境的具体通路及机制[3],而通过将来更为深入的研究,KLK6不仅可能成为一个具有临床诊断意义的蛋白分子,也有望成为一个潜在的乳腺癌治疗的基因靶点。
[1] Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2] 吴宁.乳腺癌的影像诊断:流行病学变化带来的挑战以及目前的形势与任务[J].中华放射学杂志,2006,40(4):341-343.
[3] Krenzer S,Peterziel H,Mauch C,et al.Expression and function of the kallikrein-related peptidase 6 in the human melanoma microenvironment[J].J Invest Dermatol,2011,131(11):2281-2288.
[4] Borgoño CA,Diamandis EP.The emerging roles of human tissue kallikreins in cancer[J].Nat Rev Cancer,2004,4(11):876-890.
[5] Obiezu CV,Diamandis EP.Human tissue kallikrein gene family:applications in cancer[J].Cancer Lett,2005,224(1):1-22.
[6] Yousef GM,Diamandis EP.The new human tissue kallikrein gene family:structure,function,and association to disease[J].Endocr Rev,2001,22(2):184-204.
[7] Klucky B,Mueller R,Vogt I,et al.Kallikrein 6 induces E-cadherin shedding and promotes cell proliferation,migration,and invasion[J].Cancer Res,2007,67(17):8198-8206.
[8] Breitenbach U,Tuckermann JP,Gebhardt C,et al.Keratinocyte-specific onset of serine protease BSSP expression in experimental carcinogenesis[J].J Invest Dermatol,2001,117(3):634-640.
