驻极体及联用氮酮对环孢菌素A的体外透皮促渗作用
2012-01-30刘鸿越梁媛媛董法杰崔黎丽第二军医大学药学院无机化学教研室基础部数理教研室上海200433
刘鸿越,江 键,马 琳,梁媛媛,董法杰,崔黎丽(第二军医大学,.药学院无机化学教研室;.基础部数理教研室,上海200433)
大分子量的肽和蛋白质类药物的特殊理化性质决定了其很难透过皮肤屏障,限制了其在经皮给药系统中的应用[1]。驻极体是一类能够长期储存空间电荷和(或)偶极电荷的功能电介质材料[2]。它的静电效应和微电流能改变皮肤角质层内的脂质双层排列方式,形成大量暂时的、可渗透的新孔道[3]。研究表明,驻极体对小分子药物有良好的促渗作用,有望成为大分子类药物经皮吸收的促渗方法[3,4]。
本实验以蛋白质类的环孢菌素A为模型药物,聚丙烯膜为驻极体材料,通过比较研究负极性驻极体、不同浓度氮酮以及两者联用的环孢菌素A溶液的经皮转运规律,为进一步阐明驻极体促渗机制和研究驻极体环孢菌素A贴剂奠定实验基础。
1 材料与仪器
1.1 仪器 RYJ-6B型药物透皮扩散试验仪(上海黄海药检仪器有限公司),高效液相色谱仪(美国安捷伦科技有限公司,Agilent-1100),栅控电晕充电系统(大连理工大学静电与特种电研究所),SD803表面电位计(机械电子部上海电动工具厂)。
1.2 药物、试剂及材料 聚丙烯商品膜(polypropylene,PP,日本东丽株式会社),膜厚13 μm。环孢菌素A(上海源叶生物科技有限公司,批号:CAS# 59865-13-3);氮酮(福建寿宁美菲思生物化学品厂,纯度≥99.0%);甲醇、乙腈为色谱纯,丙二醇、无水乙醇为分析纯。
1.3 动物 雄性SD大鼠[第二军医大学实验动物中心,SYXK(沪)2007-0003],体重(181±28.6)g。
2 方法与结果
2.1 驻极体材料制备 PP薄膜置于常温下电晕充电,针尖电压-25 kV,栅压分别为-500 V、-1 000 V、-2 000 V,注极时间5 min,制得-500 V、-1 000 V、-2 000 V驻极体。
2.2 HPLC法测环孢菌素A的含量
2.2.1 色谱条件 色谱柱为DiamonsilTM ODS柱(250 mm×4.6 mm,5 μm,迪马公司);流动相为乙腈-甲醇-水=[340∶100∶60(v/v/v)],检测波长为214 nm,流速为1.0 ml/min,柱温为60℃,进样量为10 μl。
2.2.2 标准曲线的建立 精密称取17.90 mg环孢菌素A于100 ml容量瓶中,加入25 ml乙醇,溶解后,用pH 7.2的PBS定容至100 ml,得环孢菌素A贮备液。精密量取该贮备液0.1、0.4、0.8、3.0、8.0 ml于10 ml的容量瓶中,加pH 7.3的PBS稀释、定容至刻度,得到浓度范围为1.79~143.2 μg/ml的环孢菌素A标准溶液。按2.2.1项下的色谱条件测定,以药物峰面积A对环孢菌素A的浓度C(μg/ ml)进行线性回归,得标准曲线方程为A=13.799 C-1.226 9(r=0.999 97),即在1.79~143.2 μg/ml范围内,峰面积与浓度间有良好的线性关系。
2.2.3 准确度和精密度的测定 配制13.9、36.5、84.5 μg/ml的高、中、低3种浓度的环孢菌素A溶液作为质控样品,按2.2.1项下的色谱条件进行测定,得日内RSD最大值为0.676%,日间RSD最大值为2.946%,准确度的RR值为100.38%~111.47%,符合方法学要求。
2.3 环孢菌素A的体外透皮特性考察
2.3.1 药物透皮溶液的制备 精密称取环孢菌素A,溶于丙二醇后,制得0.5%(w/w)的对照溶液。称取一定量的丙二醇,分别按1%、3%、5%(w/w)的比例加入相应的氮酮,混匀,再按前二者总质量的0.5%(w/w)精密称取环孢菌素A,待其完全溶解后,制得含化学促渗剂的药物溶液。
2.3.2 鼠皮的处理 取大鼠,用20%乌拉坦腹腔麻醉后,用电动剃须刀小心剃去腹部鼠毛,剥离皮肤,用脱脂棉擦除皮下组织和粘连物,再用生理盐水冲洗干净,待用。
2.3.3 体外透皮实验 采用改良的Franz扩散池,将皮肤固定于供给池和接受池之间,角质层面向供给池。供给池中分别放入对照溶液、含化学促渗剂A。式中 V为接受池的体积(6.75 ml),Vi为取样体积,cn为第n个取样点药物的校正浓度,ci为第i个取样点的实测浓度,A为有效扩散面积(2.8 cm2)。
2.3.4 负极性驻极体对环孢菌素A透皮的影响
对照溶液覆盖驻极体后,驻极体实验组和对照溶液的透皮行为如图1所示。结果显示,在0~8 h的实验过程各实验组环孢菌素A的累积渗透量为零。在8~24 h的实验过程中,不同表面的负极性驻极体对模型药物均具有一定的促渗效果且满足指数上升规律,-500 V、-1 000 V、-2 000 V驻极体作用后,环孢菌素A的24 h累积渗透量分别为7.52、9.28、8.86 μg/cm2,分别是对照溶液的1.20、1.48、1.41倍。结果表明,负极性驻极体对环孢菌素A的经皮吸收有促渗作用。的含药溶液、对照溶液覆盖驻极体(与溶液液面保持约1 mm高度),接受池中放入体积比为75∶25的pH 7.2的PBS与乙醇的混合溶液。水浴温度为(37.0±0.5)℃,磁力搅拌速度为320 r/min,分别于8、12、16、20、24 h从接受池取样,每次取样1 ml,并补充等量的接受介液,按2.2.1项下的条件测定,并按下式计算环孢菌素A的体外累积渗透量(Q)∶
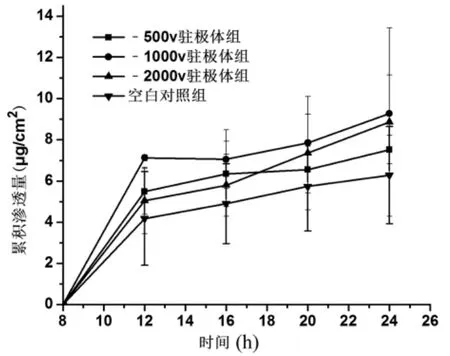
图1 负极性驻极体作用下环孢菌素A的透皮量(n=4)
2.3.5 不同浓度氮酮对环孢菌素A透皮的影响图2为含化学促渗剂的含药溶液和对照溶液的透皮行为。结果显示,1%氮酮、3%氮酮和5%氮酮均可有效提高环孢菌素A的透皮速率、增加环孢菌素A的透皮量和缩短环孢菌素A透皮的迟滞时间。1%、3%、5%氮酮的环孢菌素A溶液的24 h累积渗透量分别为66.35、31.71、21.40 g/cm2,是空白对照组的10.56、5.05、3.41倍(P<0.05)。其中,1%氮酮对环孢菌素A的促渗能力最强。
2.3.6 负极性驻极体与氮酮联用对环孢菌素A透皮的影响 含促渗剂的药物溶液覆盖驻极体后,除-1 000 V驻极体与1%氮酮联用组环孢菌素A的 24 h累积渗透量高于1%氮酮实验组外(P>0.05) (图3),其余各组的累积渗透量均小于对应氮酮促渗组(图4、图5)。与对照组和不同浓度氮酮实验组相比,24 h后,-1 000 V驻极体与1%氮酮联用组环孢菌素A的累积透皮量分别是对照组、1%氮酮、3%氮酮和5%氮酮的12.64、1.2、2.5、3.1倍。
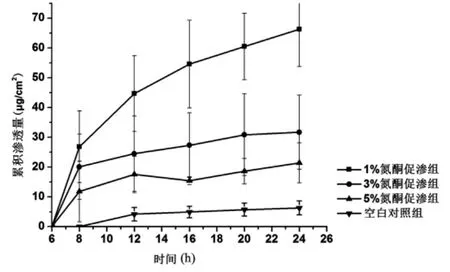
图2 不同浓度氮酮作用下环孢菌素A的透皮量(n=4)
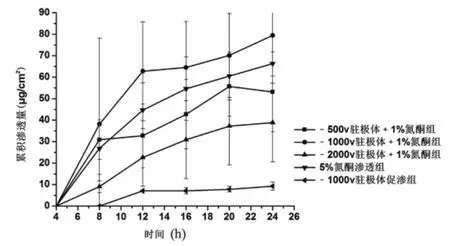
图3 不同表面电位负极性驻极体与1%氮酮对环孢菌素A体外透皮累积渗透量(n=5)
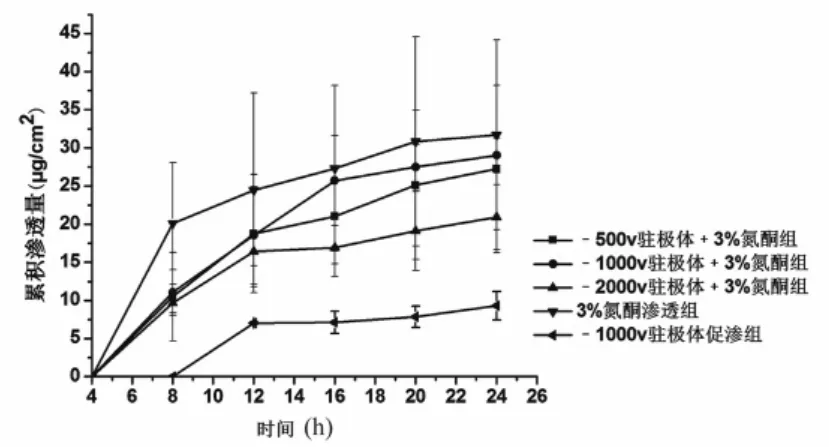
图4 不同表面电位负极性驻极体与3%氮酮对环孢菌素A体外透皮累积渗透量(n=5)
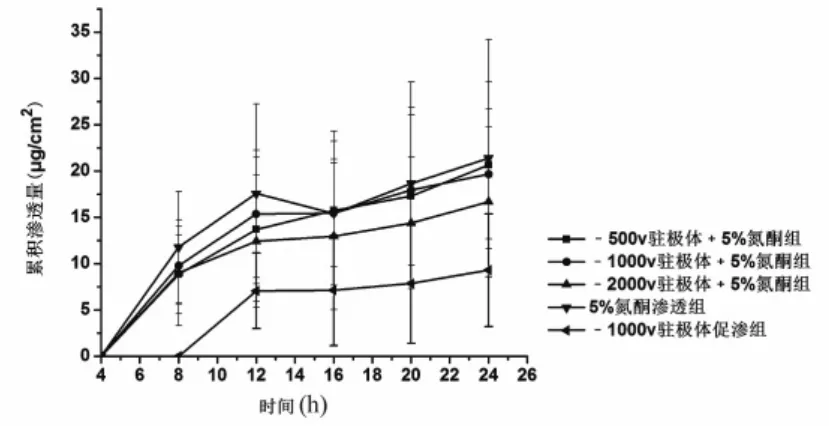
图5 不同表面电位负极性驻极体与5%氮酮对环孢菌素A体外透皮累积渗透量(n=5)
2.4 统计学处理 实验数据采用SPSS13.0统计软件进行单因素方差分析和t检验,检验水平(P)为0.05。
3 讨论
聚丙烯驻极体是能够长期储存大量空间电荷的功能电介质材料,它产生的静电场不仅可穿越离体皮肤并保持相对稳定,而且可在离体皮肤内诱导产生生物电流[5]。当驻极体作用离体皮肤,它产生的静电场和微电流可改变皮肤的自然极化状态,导致皮肤角质层层状类脂结构的改变和皮肤附属器毛囊口的拓宽,从而产生大量新孔道,并使这些新增孔道持续开放,这些结果可直接导致角质层“砖墙结构”的改变,药物分子通过这些孔道经皮传递而增加通透量,实现促进药物渗透的目的[3]。本实验的结果显示,负极性驻极体作用下的环孢菌素A溶液或单独的环孢菌素A溶液经皮渗透存在时滞现象。这是因为一方面驻极体对皮肤角质层结构的影响有时间延迟效应[6];另一方面环孢菌素A是较大分子脂溶性多肽类药物(分子量1 202.63Da),其高分子量和脂质溶解性使其容易在皮肤角质层和皮肤的深层形成储库而不易经皮扩散。因此,不同表面电位的负极性驻极体对环孢菌素A的体外促渗在宏观上表现出迟滞现象。此外,3种负极性驻极体中,-1 000 V驻极体对环孢菌素A的促渗效果最佳。驻极体作用下的皮肤显微结构研究结果表明,在-500 V~-2 000 V电压范围内,-1 000 V驻极体对皮肤角质层结构具有最佳的调控作用[7]。
氮酮由弱极性氮杂环和非极性结构长链烷烃或烯烃组成,是常用的化学促渗剂,对于亲水性和亲脂性化合物均具有良好的促透效果,尤其对亲水性药物促渗效果更佳。氮酮可以增加脂质双分子层的流动性,增加角质层的含水量,而且氮酮浓度越高,角质层的含水量越多,脂溶性药物不易通过,促渗效果减弱[8]。环孢菌素A为脂溶性药物,随着氮酮浓度的增加,其促渗效果也相应减弱。因此本实验中,1%氮酮对环孢菌素A的促渗作用优于3%氮酮和5%氮酮,其24 h的累积渗透量分别为3%和5%氮酮促渗组的2.09倍和3.10倍。
本实验的研究结果还表明,-1 000 V驻极体与1%氮酮联用可提高环孢菌素A的透皮速率和透皮量,该作用产生的主要机制,一方面是驻极体作用大鼠皮肤改变了大鼠皮肤的电极化状态和角质层的空间结构,新增了大量可逆性孔道,从皮肤表面经孔道扩散进入角质层及皮肤各层的1%氮酮进一步改变了脂质双分子层的有序排列,且增加了脂质的流动性。另一方面,1%氮酮还使从贴剂中进入皮肤各层的环孢菌素A部分溶解并滞留在皮肤中,在皮肤中的大量环孢菌素A在自然扩散力和驻极体外电场力的作用下定向运动通过皮肤各层。而3%和5%的氮酮增加了角质层的含水量,高浓度的水分子在驻极体的外静电场作用下极化,使得皮肤内的电场强度减弱,电场对药物的作用力减小。因此,-1 000 V驻极体与3%和5%氮酮联用,药物的透皮速率和透皮量反而减小。
[1] Wang S,Kara M,Krishnan TR.Transdermal delivery of cyclosporin-A using electroporation[J].J Control Release,1998,50: 61.
[2] 夏钟福.驻极体[M].北京:科学出版社,2001:2.
[3] Cui LL,Hou XM,Jiang J,et al.Comparative enhancing effects of electret with chemical enhancers on trnasdermal delivery of meloxicam in vitro[J].J Phys:Conf Ser,2008,142:012015.
[4] 孔玉秀,程 亮,肖永恒,等.驻极体利多卡因贴剂的促渗作用[J].第二军医大学学报,2009,30(5):469.
[5] Jiang J,Liang YY,Dong FJ,et al.Study of electret effect of rat skin by thermally stimulated discharge analysis[J].J Electrostat,2012,70:258.
[6] 梁媛媛,董法杰,马 琳,等.驻极体对大鼠皮肤显微结构影响的时间效应研究[J].广东工业大学学报,2011,28(2): 88.
[7] Cui LL,Liang YY,Dong FJ,et al.Structure of rat skin after application of electret characterized by DSC[J].J Phys:Conf Ser,2011,301:012027.
[8] Harrison JE,Watkinson AC,Green DM,et al.The relative effect of Azone and Transcutol on permeant diffusivity and solubility in human stratum corneum[J].Pharm Res,1996,13:542.
