中温固体氧化物燃料电池的基本性质测量
2012-01-26舒文玉
魏 波,刘 伟,舒文玉,吕 喆
(哈尔滨工业大学 物理系,黑龙江 哈尔滨150080)
1 引 言
固体氧化物燃料电池(Solid oxide fuel cell,简称SOFC)是一种全固态、可以直接将燃料的化学能转变成电能的发电装置.它具有高效、无污染等突出优点,被誉为21世纪的绿色电源.由于不经历卡诺循环,其能量转化效率高达40%~50%,在热电联供后总效率可达80%.SOFC具有很强的模块化设计,输出功率可在瓦级到兆瓦级范围.小的方面可以用于便携式电源或辅助电源,而大的方面则可以应用于固定电站或分布式电站.因此,在能源和环境问题日益突出的今天,以燃料电池为代表的新能源技术成为各国政府大力发展的关键技术[1-2].为了降低成本、延长寿命,运行在800℃以下的中温SOFC是目前的研究重点.现广泛采用的方案是使用阳极支撑型SOFC,薄膜化的电解质层可以降低电池欧姆内阻,进而提高电池输出性能[3-4].
在目前形势下,新能源技术方兴未艾,而对大学生进行新能源知识的传播和教育也显得越来越重要.贺天民等人介绍了基于锥管结构高温SOFC的测试和演示装置[5].本课题组在SOFC材料和器件方面拥有多年的研究积累,我们也积极尝试将科研成果向本科生宣传.近几年来,在国家和校级大学生创新实验计划的资助下,多次安排了与SOFC相关的课题,都取得了较好的效果.本文中,我们尝试将科研成果转化为教学实验,设计了阳极支撑型SOFC的演示实验,具体包括工作原理、开路电压、电流-电压-功率关系等测量和相关内阻分析.相信SOFC演示实验可以激发学生对科研的兴趣,拓展学生知识面,树立绿色能源的意识.
2 实验原理
SOFC单电池为典型的“三明治”结构,基本组件为电解质、阳极和阴极.SOFC具有很强的燃料适应性,可以使用H2、天然气、城市煤气等多种燃料.本文以H2为燃料来说明,SOFC工作原理示意图如图1所示.在阳极一侧通入H2,在阴极一侧通入空气.H2在阳极催化作用下与氧离子(O2-)作用生成水,同时释放出2个电子(e-),电子则通过外电路向阴极转移.在阴极处,O2得到电子还原成O2-.而O2-则在浓度梯度的作用下由阴极侧穿过电解质向阳极侧输运.具体反应分别为
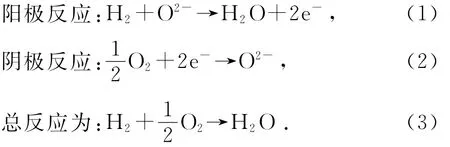
由式(3)可以看出,燃料电池是一个能量转换装置,只要外界源源不断地供应燃料和氧化剂,燃料电池就可以持续地发电.该过程中不存在电极材料的消耗,这一点与传统的一次或二次电池不同.
只从热力学角度考虑,燃料电池的理论电压为能斯特(Nernst)电压:

图1 阳极支撑型SOFC示意图

式中:R为气体常量,T为绝对温度,F为法拉第常量.pH2O,pH2和pO2分别为 H2O,H2和 O2的气体分压.E0为标准电池电压,且

式中ΔG为吉布斯自由能变化.
3 实验装置和实验方法
电池所用的材料:摩尔分数为8%的Y2O3稳定的Zr O2(8YSZ)电解质,NiO+8YSZ为阳极和锰酸锶镧(La0.7Sr0.3Mn O3,LSM)阴极.具体的单电池制备过程见文献[6],单电池的直径约10.46 mm,阴极有效面积为0.25 cm2.
单电池阳极一侧封装在氧化铝瓷管上,而阴极侧直接与静止空气接触.将电池放置于电炉中升温,当温度达到700℃时通入流量为100 m L/min的氢气,将NiO还原为金属Ni.使用英国Solartron SI 1287+SI 1260电化学系统测量电池的开路电压和放电曲线,温度测试范围为550~800℃,温度间隔为50℃.所得的电流和功率数据除以面积后得到电流密度和功率密度.使用日本JEOL-JSM6480LV扫描电子显微镜观察测试电池的微观形貌.
4 实验结果
图2给出了单电池的微观形貌(扫描电镜照片),从左到右依次为多孔阴极、电解质薄膜和多孔阳极支撑体,它们的厚度分别约为12~15μm,20μm和700μm.电解质膜厚度均匀,致密性高,主要起到隔绝阴极、阳极反应气体和传输氧离子的作用.早期SOFC多采用电解质支撑结构,电解质厚度在200μm左右[7].采用阳极支撑结构后,电解质薄膜减小到10~20μm,可以大大降低电解质欧姆内阻在电池总内阻中的比例.

图2 典型的阳极支撑型单电池微观形貌
开路电压(Open circuit voltage,OCV)是不接入负载时电池两端的电压,此时电池中无电流.图3中给出了单电池在不同温度下的开路电压值,其结果在1.07~1.11 V之间,与理论电压值(图3中曲线)接近.这也说明8YSZ电解质薄膜气密性很好,没有出现明显的渗漏现象.对于反应(3),电压的温度系数为负值,导致开路电压随温度的升高而下降.此外,需要指出的是单电池电压在1 V左右,很难有实际应用.为了得到高电压,需要把多个单电池进行串联构成电池堆.比如,日本NTT公司制造的阳极支撑型1 k W电池堆是由50个直径为120 mm的单电池片串联而成[8].

图3 单电池在550~800℃的开路电压

图4 单电池在600~800℃的电压-电流曲线
图4中给出了单电池在600~800℃范围内的放电曲线(电压-电流曲线).随着温度的升高,电池的短路电流密度也随之增大.在600,700,800℃的最大值分别达到1.36,2.11,2.61 A·cm-2.这是由于电池中阳极、阴极和电解质性能都与温度密切相关.随着温度的升高电极活性增强,电极内阻下降.而电解质电导率升高,欧姆内阻下降.反应在电池上则是总内阻下降,进而可以提供更大的输出功率.
以800℃结果为例,对电池的放电曲线进行分析.该曲线中电压-电流关系呈现出非线性规律.每点斜率对应于电池内阻,它是随电流变化而变化的.为了便于计算,使用Origin 7.0软件对不同特定电压附近取5个数据点进行线性拟合,得到近似的电池内阻值.具体结果在图5中给出,拟合误差在2.6%以内.从开路到短路状态的放电过程中,电池内阻呈现出先降低后增大的趋势.在开路时,电池内阻为0.74Ω·cm2,随着电压的下降(放电电流增加),阻值显著降低到0.8 V的0.28Ω·cm2,随后逐渐增加,到短路时达到0.70Ω·cm2.

图5 800℃时电池总内阻随放电电压的变化关系
8YSZ在800℃的离子电导率约为0.04 S·cm-1[9],据此可以估计20μm 厚 YSZ薄膜的欧姆电阻为0.05Ω·cm2.可见在阳极支撑型电池中,欧姆电阻所占比例要低于电极电阻(尤其是阴极).电池内阻可以通过交流阻抗谱技术测试得到,频率变化跨度比较大(0.1 Hz~1 MHz),需要使用专门的仪器来实现.如果粗略估计,可以通过电压-电流曲线的斜率得到.而电压-电流曲线可以通过数字电压表、电流表、电子负载等来实现测量.
假设电池开路电压为ε,工作电压为V,内阻为r,输出功率为P,闭合电路中电流为I.电池在放电时的工作电压为开路电压减去电池内部的电压降,即

把 (7)式代入 (6)式即得

当电池内阻r不变时,输出功率对电流的函数是开口向下的抛物线,因此功率存在最大值Pmax=ε2/4r.从图6可以看出内阻r是随电流变化而变化的,从而导致抛物线出现变形.在600,700,800℃的最大功率密度分别达到了0.32,0.63,0.86 W·cm-2.

图6 单电池在600~800℃的功率-电流曲线
5 结束语
本文介绍了SOFC的基本原理,并给出了中温薄膜型SOFC的开路电压、放电曲线和功率曲线等实验结果.考虑到SOFC是典型的交叉方向,本实验可以作为演示实验向物理、化学、材料、能源等相关专业本科生和研究生开设.本实验的开设有利于学生了解最新科研进展,培养创新意识.此外,还可以在此基础上开设研究性实验内容,引导有兴趣的学生进行科学研究.相信本实验对于普及新能源知识,丰富实验物理教学内容具有很好的意义.
[1] Singhal S C,Kendal K.高温固体氧化物燃料电池:原理、设计和应用[M].韩敏芳,蒋先锋译.北京:科学出版社,2007:309-330.
[2] 彭苏萍,韩敏芳,杨翠柏,等.固体氧化物燃料电池[J].物理,2004,33(2):90-94.
[3] Will J,Mitterdorfer A,Kleinlogel C,et al.Fabrication of thin electrolytes for second-generation solid oxide fuel cells[J].Solid State Ionics,2000,131(1/2):79-96.
[4] 韩敏芳,李伯涛,彭苏萍,等.SOFC电解质薄膜YSZ制备技术[J].电池,2002,32(3):156-158.
[5] 贺天民,孙敬姝,吕喆,等.高温固体氧化物燃料电池实验演示[J].物理实验,2000,20(4):9-10.
[6] Chen Kong-fa,L¨U Zhe,Ai Na,et al.Fabrication and performance of anode-supported YSZ films by slurry spin coating[J].Solid State Ionics,2007,177(39/40):3455-3460.
[7] Singhal S C.Advances in solid oxide fuel cell technology[J].Solid State Ionics,2000,135(1/4):305-313.
[8] Yokoo M,Tabata Y,Yoshida Y,et al.Development of 1kW class solid oxide fuel cell stack using anode-supported planar cells [J]. J. Power Sources,2008,184(1):84-89.
[9] Sammes N M,Cai Zhi-hong.Ionic conductivity of ceria/yttria stabilized zirconia electrolyte materials[J].Solid State Ionics,1997,100(1/2):39-44.
