结核病新疫苗的免疫毒理学评价方法研究
2012-01-24都伟欣董娜陈保文徐苗杨蕾卢锦标沈小兵王国治
都伟欣 董娜 陈保文 徐苗 杨蕾 卢锦标 沈小兵 王国治
随着疫苗临床应用中不良反应报道越来越多,疫苗研发过程中的安全性评价日益引起人们的重视。由于疫苗的作用机理是引起机体免疫系统的应答,故疫苗接种后的多数不良反应是由免疫系统引起的毒性反应[1]。为了保证疫苗在人体应用的安全性,我国从2002年开始要求新型疫苗作临床前的免疫毒性分析。
疫苗的免疫毒性主要包括:免疫抑制、超敏反应和自身免疫三大类。但其中超敏反应最为常见,而超敏反应中又以Ⅰ型过敏反应最为常见与凶险。Ⅰ型过敏反应多为全身性反应,目前对其评价大多依靠全身主动过敏试验和被动皮肤过敏试验,所用的实验动物模型仍多为大鼠和小鼠。但这些方法均主观性较强,并且难以量化。而豚鼠是公认的对致敏物质比较敏感的动物,并且与人类Ⅰ型过敏反应发病状态较为接近[2-3]。本研究以豚鼠为过敏反应动物模型,初步建立了评价Ⅰ型过敏反应的几种量化检测指标和方法,并将建立的方法初步应用到结核病新疫苗(耻垢疫苗)的免疫毒性评价中。
材料和方法
一、材料
1.试剂和耗材:鸡卵清白蛋白(ovalbumin,OVA)和 Al(OH)3(0.5 mg/ml)由北京生物制品研究所惠赠。羊抗豚鼠IgG1抗体和辣根过氧化物酶(HRP)标记的羊抗豚鼠IgG1抗体购于Ab D Serotec公司。四甲基联苯胺(TMB)底物显色液购于Amresco公司。豚鼠淋巴细胞分离液购于天津灏洋生物。Hank液、刀豆球蛋白A(concanavalin A,Con A)、台氏液、红细胞裂解液购于北京欣经科生物有限公司。15及50 ml离心管、96和24孔酶标板(Corning公司)均购于希尔诚公司。组胺检测试剂盒(histamine enzyme immunoassay kit)和白三烯检测试剂盒(leukotriene C4 EIA kit)购于Cayman公司。其他试剂和耗材均为中国食品药品检定研究院提供。
2.仪器:酶标仪:Labsystems Dragon公司;离心机:Eppendorf公司。
3.豚鼠:品系:Hartley,无特定病原体(specific pathogen free,SPF)级,由中国食品药品检定研究院实验动物中心提供。
二、方法
(一)豚鼠Ⅰ型过敏反应模型的制备
首先制备免疫原[含0.05 mg/ml Al(OH)3和1 mg/ml OVA],方法是取120 mg OVA溶于48 ml生理盐水中,另取12 ml Al(OH)3与60 ml生理盐水充分混匀后,边振荡边加入已溶解的OVA,4℃振荡过夜即可。然后将体质量300~350 g的雄性豚鼠按照数字表法随机分为过敏模型组和生理盐水对照组(简称对照组),其中过敏模型组30只,对照组15只。最后免疫豚鼠,取1 ml免疫原,过敏模型组中每只豚鼠背部皮下多点注射进行初次免疫。此后每2周加强免疫1次,加强免疫时取1 ml同样免疫原对每只豚鼠进行肌内注射,共加强免疫3次。对照组以生理盐水代替免疫原对豚鼠进行注射,注射方式同过敏模型组。
(二)豚鼠血清总IgG1抗体检测方法的建立
将过敏模型组和对照组豚鼠在末次免疫后7 d进行心脏取血并分离血清,应用棋盘滴定法建立豚鼠血清总IgG1抗体检测方法。实验步骤为:分别以1、2、4、6、8、10μg/ml浓度的羊抗豚鼠IgG1抗体包被酶标板。包被结束并洗板后,每孔加入200μl封闭液在室温下进行封闭。封闭结束并洗板后,分别加入1∶103、1∶104和1∶105稀释的豚鼠血清,同时做空白对照和试剂对照,每孔100μl,室温孵育2 h。孵育结束并洗板后,每孔加入200μl 1∶20 000和1∶50 000稀释的HRP标记的羊抗豚鼠IgG1抗体,室温孵育2 h。孵育结束并洗板后,每孔加入200μl TMB底物显色液,避光孵育5 min。每孔加入50μl的2 mol/L H2SO4终止反应。于酶标仪上读取每孔A450值。数据处理:分别计算阳性孔与阴性对照孔的比值(P/N),按照P/N值>2.1为阳性。
(三)豚鼠不同组织来源的过敏性介质(组胺和白三烯)含量检测方法的建立
1.外周血嗜碱粒细胞的分离和体外刺激分泌过敏性介质方法的建立:首先从过敏模型组和对照组豚鼠中按照数字表法分别随机选择10只和5只进行心脏取血,每只取血约4 ml,取血后迅速注入抗凝管中,颠倒混匀。然后应用豚鼠淋巴细胞分离液分离外周血单个核细胞。外周血单个核细胞分离后应用红细胞裂解液裂解细胞。裂解结束后,用1 ml Hank液进行重悬。重悬后显微镜下计数,将细胞浓度调至1×106/ml。将调好浓度的各管细胞悬液于37℃孵育10 min后充分振荡弹匀。每管取细胞悬液300μl,加入等量的 OVA(1 mg/ml)液进行体外刺激分泌过敏性介质;同时每管取细胞悬液300μl,加入等量的 Con A(10μg/ml)液作阳性对照;每管另取细胞悬液300μl,加入等量生理盐水作阴性对照。将所有管置37℃水浴45 min进行刺激培养。培养结束后,所有管均离心,离心条件:25℃,720×g离心10 min,离心结束后取上清液即可。
2.支气管肺泡灌洗液收集方法的建立:按照数字表法随机选择过敏模型组10只和对照组豚鼠5只,在末次免疫后7 d,从后肢静脉注射1 mg/ml OVA溶液予以激发。激发后麻醉豚鼠,进行支气管插管术取支气管肺泡灌洗液。方法是用注射器缓慢注入37℃预热的无菌生理盐水2.5 ml,保留30 s后抽出,重复进行4次,收集全部支气管肺泡灌洗液,总计约10 ml。将收集的支气管肺泡灌洗液液置无菌15 ml离心管中进行离心,离心条件:4℃,444×g离心10 min,离心结束后取上清液即可。
3.腹腔灌洗液中肥大细胞的分离和体外刺激分泌过敏性介质方法的建立:按照数字表法随机选择过敏模型组10只和对照组豚鼠5只,末次免疫结束后断颈处死,用20 ml台氏液(含肝素钠5 IU/ml)对豚鼠进行腹腔注射吸取腹腔灌洗液。将腹腔灌洗液置于50 ml无菌离心管中进行离心,离心条件:4℃,720×g离心15 min,离心结束后弃上清收集细胞沉淀。加入1 ml红细胞裂解液于细胞沉淀中,4℃,444×g离心5 min,离心结束后弃上清。用台氏液重悬细胞沉淀并洗涤细胞2次后,用1 ml台式液重悬细胞进行镜下计数,调细胞浓度至2×106/ml。取24孔培养板,每孔加入0.1 ml的OVA液(1 mg/ml)、0.9 ml台氏液和1 ml细胞悬液体外刺激肥大细胞分泌过敏性介质。阴性对照为每孔加入0.1 ml无菌生理盐水、0.9 ml台氏液和1 ml细胞悬液。加样完毕后,将培养板置37℃孵箱中刺激培养30 min。培养结束后进行离心,离心条件:4℃,405×g离心15 min,离心结束后取上清液即可。
4.ELISA法检测各样本中过敏性介质(组胺和白三烯)的含量:(1)组胺含量的检测:应用Histamine Enzyme Immunoassay试剂盒对上述“1~3”段中的各样本组胺含量进行检测。不同来源样本处理方式有差异,其中外周血嗜碱粒细胞体外刺激培养上清液样本用Hank液做4倍稀释;支气管肺泡灌洗液的上清液样本用酶免疫试验(EIA)缓冲液做5倍稀释;腹腔灌洗液中肥大细胞体外刺激培养上清液样本用台氏液做4倍稀释。不同样本检测中标准品制备所用的稀释液与待测样本的稀释液相一致,即分别以Hank液、EIA缓冲液和台氏液稀释制备标准品。检测步骤完全按照试剂盒说明书进行操作。(2)白三烯含量的检测:应用Leukotriene C4 EIA试剂盒对上述“1~3”段中的各样本组白三烯含量进行检测。不同来源样本处理方式有差异,其中外周血嗜碱粒细胞体外刺激培养上清液样本和腹腔灌洗液中肥大细胞体外刺激培养上清液样本直接检测;支气管肺泡灌洗液的上清液样本用EIA缓冲液做2倍稀释后检测。不同样本检测中标准品制备所用的稀释液与待测样本的所含溶液或稀释液相一致,即分别以Hank液、EIA缓冲液和台氏液稀释制备标准品。检测步骤完全按照试剂盒说明书进行操作。
(四)应用以上建立的Ⅰ型过敏反应的各项指标评价结核病新疫苗(耻垢疫苗)的免疫毒性
1.动物分组和免疫:Hartley豚鼠,雄性,体质量300~350 g,将豚鼠按照数字表法随机分为3组,分别为耻垢疫苗组、过敏模型阳性组和生理盐水阴性对照组,每组12只。耻垢疫苗组:以浓度35μg/ml的耻垢疫苗原液后腿肌内注射豚鼠,每只0.5 ml,每2周加强免疫1次,共免疫4次。过敏模型阳性组和生理盐水阴性对照组免疫方式同豚鼠Ⅰ型过敏反应模型的制备。
2.血清中总IgG1抗体水平检测:以上各组豚鼠中按照数字表法随机选取8只,心脏采血后分离血清。应用“豚鼠血清总IgG1抗体检测方法的建立”中已建立的ELISA方法检测豚鼠血清中总IgG1抗体水平。其中羊抗豚鼠IgG1抗体包被浓度为6μg/ml,豚鼠血清稀释度为1∶105,HRP标记的羊抗豚鼠IgG1抗体稀释度为1∶20 000。具体实验步骤同上面“豚鼠血清总IgG1抗体检测方法的建立”段所述。
3.不同组织来源的过敏性介质(组胺和白三烯)评价指标的检测:(1)不同组织来源样本的制备:以上各组豚鼠中按照数字表法随机选取6只,心脏取血分离外周血嗜碱粒细胞,然后进行支气管插管术取支气管肺泡灌洗液。各组再按照数字表法随机选取另外6只,经注射器取腹腔灌洗液中分离的肥大细胞。制备过程同上面“豚鼠不同组织来源的过敏性介质(组胺和白三烯)含量检测方法的建立”段所述。(2)组胺含量的检测:外周血嗜碱粒细胞体外刺激培养上清液样本、支气管肺泡灌洗液样本和腹腔灌洗液中肥大细胞体外刺激培养上清液样本中组胺含量检测同上面“组胺含量的检测”段所述。(3)白三烯含量的检测:外周血嗜碱粒细胞体外刺激培养上清液样本、支气管肺泡灌洗液样本和腹腔灌洗液中肥大细胞体外刺激培养上清液样本中白三烯含量检测同上面“白三烯含量的检测”段所述。
结 果
一、豚鼠血清总IgG1抗体检测方法的建立结果
总IgG1抗体棋盘滴定结果:确定6μg/ml羊抗豚鼠IgG1抗体包被,待测血清稀释1∶105,以及HRP标记的羊抗豚鼠IgG1抗体稀释1∶20 000的条件为最佳实验条件,以此为条件建立豚鼠血清中总IgG1抗体检测方法。
二、豚鼠过敏模型中不同组织来源的过敏性介质(组胺和白三烯)含量检测结果
(一)组胺含量检测结果
1.外周血嗜碱粒细胞体外刺激培养上清中组胺含量检测结果:ELISA法检测模型组和对照组外周血嗜碱粒细胞体外刺激培养上清中的组胺含量。实验结果显示:过敏模型组中组胺含量为(99.37±15.34)nmol/L,而对照组中组胺含量为(29.94±5.86)nmol/L。两样本经t检验,过敏模型组中组胺含量与对照组比较差异有统计学意义(t=12.60,P<0.05)。见图1。
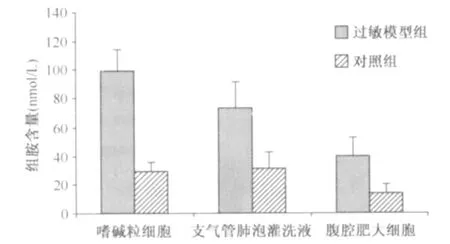
图1 过敏模型组和对照组中不同组织来源的样本上清液组胺含量的检测结果
2.支气管肺泡灌洗液上清中组胺含量检测结果:ELISA法检测模型组和对照组支气管肺泡灌洗液上清中组胺含量。实验结果显示:过敏模型组中组胺含量为(73.42±18.60)nmol/L,而对照组中组胺含量为(31.00±12.09)nmol/L。两样本经t检验,过敏模型组中组胺含量与对照组比较差异有统计学意义(t=5.41,P<0.05)。见图1。
3.腹腔肥大细胞体外刺激培养上清中组胺含量检测结果:ELISA法检测模型组和对照组腹腔肥大细胞体外刺激培养上清液中组胺含量。实验结果显示:过敏模型组中组胺含量为(39.59±12.94)nmol/L,而对照组中组胺含量为(14.35±5.85)nmol/L。两样本经t检验,过敏模型组中组胺含量与对照组比较差异有统计学意义(t=5.20,P<0.05)。见图1。
(二)白三烯含量检测结果
1.外周血嗜碱粒细胞体外刺激培养上清中白三烯含量检测结果:ELISA法检测模型组和对照组外周血嗜碱粒细胞体外刺激培养上清中的白三烯含量。实验结果显示:过敏模型组中白三烯含量为(13.09±3.87)pg/ml,而对照组中白三烯含量为(2.22±0.53)pg/ml。两样本经t检验,过敏模型组中白三烯含量与对照组比较差异有统计学意义(t=8.46,P<0.05)。见图2。
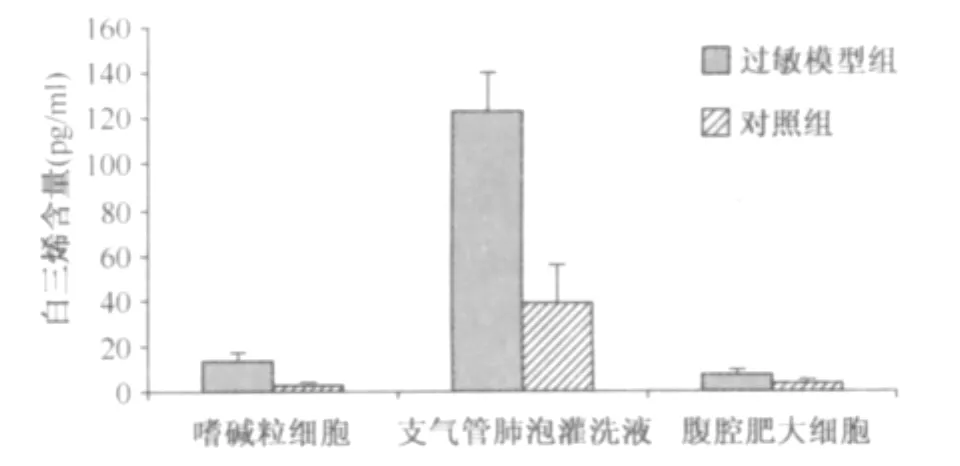
图2 过敏模型组和对照组中不同组织来源的样本上清液白三烯含量的检测结果
2.支气管肺泡灌洗液上清中白三烯含量检测结果:ELISA法检测模型组和对照组支气管肺泡灌洗液上清中白三烯含量。实验结果显示:过敏模型组中白三烯含量为(123.20±16.57)pg/ml,而对照组中白三烯含量为(39.05±16.94)pg/ml。两样本经t检验,过敏模型组中组胺含量与对照组比较差异有统计学意义(t=9.15,P<0.05)。见图2。
3.腹腔肥大细胞体外刺激培养上清中白三烯含量检测结果:ELISA法检测模型组和对照组腹腔肥大细胞体外刺激培养上清液中白三烯含量。实验结果显示:过敏模型组中白三烯含量为(6.79±2.58)pg/ml,而对照组中白三烯含量为(3.09±1.18)pg/ml。两样本经t检验,过敏模型组中白三烯含量与对照组比较差异有统计学意义(t=3.85,P<0.05)。见图2。
三、结核病新疫苗(耻垢疫苗)评价中豚鼠血清总IgG1抗体检测结果
ELISA法分别对生理盐水阴性对照组、过敏模型阳性对照组和耻垢疫苗组豚鼠血清中总IgG1抗体进行测定。实验结果显示:耻垢疫苗组豚鼠血清中总IgG1抗体A值为0.179±0.03,与生理盐水阴性对照组(A 值为0.156±0.05)相近,低于过敏模型阳性对照组总IgG1水平(A值为1.768±0.13)。经两样本t检验,耻垢疫苗组与过敏模型阳性对照组比较差异有显著统计学意义(t=33.68,P<0.01),与生理盐水阴性对照组比较差异无统计学意义(t=-1.06,P>0.05)。见图3。
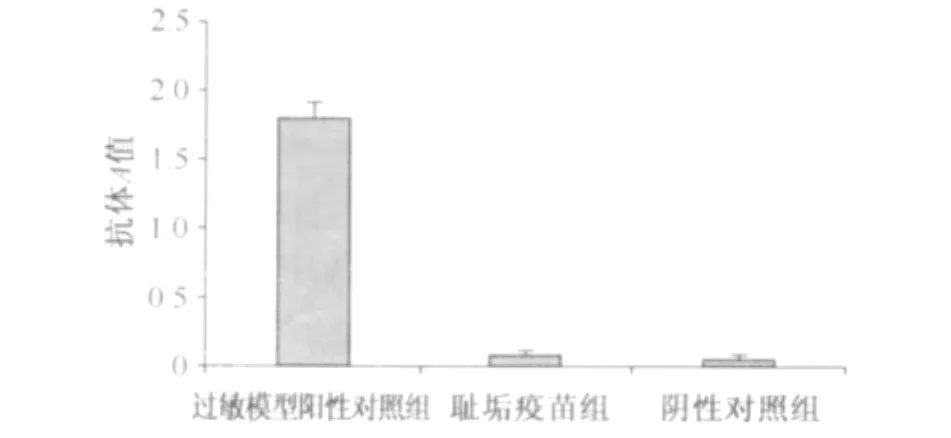
图3 耻垢疫苗与对照组总IgG1抗体水平检测结果
四、结核病新疫苗(耻垢疫苗)评价中豚鼠过敏性介质(组胺和白三烯)含量检测结果
(一)组胺含量检测结果
1.外周血嗜碱粒细胞体外刺激培养上清中组胺含量检测结果:对各组豚鼠外周血嗜碱粒细胞体外刺激培养上清液中组胺含量进行测定。实验结果显示:耻垢疫苗组组胺含量[(61.64±21.62)nmol/L],与生理盐水阴性对照组[(59.22±16.55)nmol/L]相近,低于过敏模型阳性对照组的组胺含量(128.3±61.5 nmol/L)。经两样本t检验,耻垢疫苗组与过敏模型阳性对照组比较差异有统计学意义(t=2.50,P<0.05),与生理盐水阴性对照组比较差异无统计学意义(t=-0.22,P>0.05)。见图4。
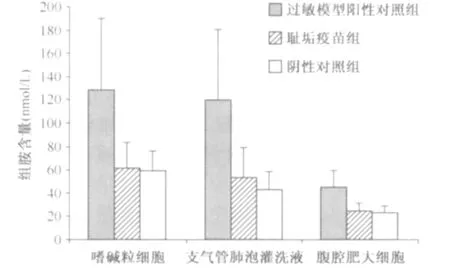
图4 耻垢疫苗与对照组中不同组织来源的样本上清液组胺含量的检测结果
2.支气管肺泡灌洗液上清中组胺含量检测结果:对各组豚鼠支气管肺泡灌洗液上清液中组胺含量进行测定。实验结果显示:耻垢疫苗组组胺含量[(53.2±25.5)nmol/L ]与生理盐水阴性对照组[(42.58±16.1)nmol/L]相近,低于过敏模型阳性对照组的组胺含量[(119.5±60.8)nmol/L]。经两样本t检验,耻垢疫苗组与过敏模型阳性对照组比较差异有统计学意义(t=-2.46,P<0.05),与生理盐水阴性对照组比较差异无统计学意义(t=0.87,P>0.05)。见图4。
3.腹腔肥大细胞体外刺激培养上清中组胺含量检测结果:对各组豚鼠腹腔肥大细胞体外刺激培养上清中组胺含量进行测定。实验结果显示:耻垢疫苗组组胺含量[(24.52±6.69)nmol/L]与生理盐水阴性对照组[(23.08±5.56)nmol/L]相近,低于过敏模型阳性对照组的组胺含量[(44.92±14.19)nmol/L]。经两样本t检验,耻垢疫苗组与过敏模型阳性对照组比较差异有统计学意义(t=-3.19,P<0.05),与生理盐水阴性对照组比较差异无统计学意义(t=0.41,P>0.05)。见图4。
(二)白三烯含量检测
1.外周血嗜碱粒细胞体外刺激培养上清中白三烯含量检测结果:对各组豚鼠外周血嗜碱粒细胞体外刺激培养上清液中白三烯含量进行测定。实验结果显示:耻垢疫苗组组胺含量[(9.89±6.36)pg/ml]与生理盐水阴性对照组[(6.91±1.92)pg/ml]相近,低于过敏模型阳性对照组的白三烯含量[(19.98±6.74)pg/ml]。经两样本t检验,耻垢疫苗组与过敏模型阳性对照组比较差异有统计学意义(t=-2.67,P<0.05),与生理盐水阴性对照组无统计学差异(t=1.10,P>0.05)。见图5。
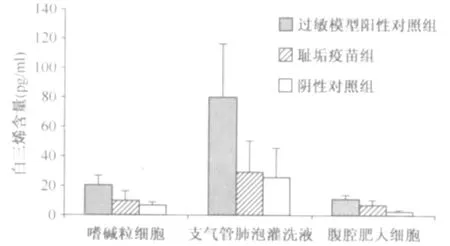
图5 耻垢疫苗与对照组中不同组织来源的样本上清液白三烯含量的检测结果
2.支气管肺泡灌洗液上清中白三烯含量检测结果:对各组豚鼠支气管肺泡灌洗液上清液中白三烯含量进行测定。实验结果显示:耻垢疫苗组组胺含量[(28.94±21.55)pg/ml]与生理盐水阴性对照组[(25.39±20.14)pg/ml]相近,低于过敏模型阳性对照组的白三烯含量[(79.8±36.3)pg/ml]。经两样本t检验,耻垢疫苗组与过敏模型阳性对照组比较差异有统计学意义(t=-2.95,P<0.05),与生理盐水阴性对照组比较差异无统计学意义(t=0.29,P>0.05)。见图5。
3.腹腔肥大细胞体外刺激培养上清中白三烯含量检测结果:对各组豚鼠腹腔肥大细胞体外刺激培养上清中白三烯含量进行测定。实验结果显示:耻垢疫苗组组胺含量[(6.64±3.73)pg/ml]与生理盐水阴性对照组[(2.73±0.68)pg/ml]相近,低于过敏模型阳性对照组的白三烯含量[(11.26±2.52)pg/ml]。经两样本t检验,耻垢疫苗组与过敏模型阳性对照组比较差异有统计学意义(t=2.52,P<0.05),与生理盐水阴性对照组比较差异无统计学意义(t=-2.53,P>0.05)。见图5。
讨 论
结核病新疫苗的研究一直是结核病研究领域的重点,各类型的新疫苗研究进展很快。疫苗最终将应用于人体,其是否具有很好的安全性是疫苗审评部门和研发部门非常关注的问题。通常疫苗的不安全性因素是接种后引发不良反应。临床统计资料显示疫苗引起的不良反应中以过敏反应所占比例最大。其中,Ⅰ型过敏反应发生率较高,且最为严重。因此,建立Ⅰ型过敏反应的动物模型和可量化的各种免疫毒理学评价指标,并以此来评价结核病新疫苗或其他新疫苗的临床前安全性将具有很重要的意义。
国外的免疫毒理学研究中多以大鼠和小鼠作为Ⅰ型过敏反应动物模型,但评价方法缺乏可以量化的指标,具有一定的主观性。豚鼠作为Ⅰ型过敏反应最为敏感的动物,其过敏反应可表现出与人类哮喘相似的病理生理学症状,并且豚鼠对分枝杆菌及其相关产品具有高度敏感性。因此,笔者选择豚鼠作为疫苗特别是结核病疫苗免疫毒性评价的实验动物模型。同时建立几种量化的检测指标和方法进行疫苗的免疫毒性评价。
过敏抗体的产生可以使疫苗引起毒性反应,其中IgE作为过敏反应的主要抗体研究已较为深入和明确。然而,Ig E并不是检测豚鼠过敏抗体的惟一指标。近年来,IgG及其亚型在过敏反应发生发展中的作用愈来愈受到重视[4-5]。有研究表明,IgG抗体,特别是IgG1抗体同样参与了豚鼠Ⅰ型过敏反应,甚至有可能是主要过敏抗体[6-7]。并且相比于IgE引起过敏反应作用较为缓慢,IgG抗体在Ⅰ型过敏反应中发生作用更加迅速、短暂。根据豚鼠IgG抗体在过敏反应中的这一特点,笔者选择血清中IgG1抗体的水平作为疫苗Ⅰ型过敏反应毒理学评价的血清学指标,通过ELISA棋盘滴定实验建立了总IgG1抗体的检测方法。实验结果显示过敏模型组中的总IgG1抗体水平远高于对照组,进一步证实IgG1抗体参与了豚鼠过敏反应的发生。
组胺和白三烯均是过敏反应发生的重要因子和炎性介质,其浓度高低可以定量反映Ⅰ型过敏反应的严重程度[8-9]。实验研究中,笔者建立了激发后豚鼠支气管肺泡灌洗液上清的收集方法、未激发豚鼠外周血嗜碱粒细胞的分离和体外刺激培养方法,以及腹腔灌洗液中肥大细胞分离和体外刺激培养的方法,并对各上清中的组胺和白三烯含量进行了测定。结果显示,过敏模型组豚鼠各样本上清中的组胺和白三烯含量均显著高于对照组。这表明通过检测这3种样本中组胺和白三烯的含量,将可能成为评价疫苗是否能够引发Ⅰ型过敏反应的定量指标。
总IgG1抗体水平检测、各样本组胺和白三烯的含量检测方法建立后,选取耻垢疫苗作为结核病新疫苗的代表,应用已建立的方法对其进行免疫毒性评价。免疫毒性评价除设立疫苗评价组外,同时设立阳性对照组和阴性对照组。结果显示耻垢疫苗组豚鼠血清总IgG1抗体水平、各样本上清液中的组胺和白三烯含量均与阴性对照组比较差异无统计学意义,却与阳性对照组相比差异有统计学意义。实验结果证明耻垢疫苗具有很好的临床前安全性。耻垢疫苗是已经取得临床批件的疫苗,并完成了Ⅰ期临床研究,临床研究资料显示其具有很好的安全性,这与本次实验的豚鼠模型评价结果相一致。
实验研究建立了几种可以量化的免疫毒理学评价指标,这将是国内首次对疫苗可能引起的豚鼠Ⅰ型过敏反应进行客观、可量化的评价,并为今后对其他各种疫苗特别是结核病疫苗的安全性评价奠定了基础。
[1]易智勇,左笑丛.5种疫苗接种致198例不良反应文献分析.中国公共卫生,2001,17(6):547-549.
[2]Hashimoto K,Ishii Y,Uchida Y,et al.Exposure to diesel exhaust exacerbates allergen-induced airway responses in guinea pigs.Am J Respir Crit Care Med,2001,164(10 Pt 1):1957-1963.
[3]Nagao K,Akabane H,Masuda T,et al.Effect of MX-68 on airway inflammation and hyperresponsiveness in mice and guinea-pigs.J Pharm Pharmacol,2004,56(2):187-196.
[4]Lange H,Kiesch B,Linden I,et al.Reversal of the adult IgE high responder phenotype in mice by maternally transferred allergen-specific monoclonal IgG antibodies during a sensitive period in early ontogeny.Eur J Immunol,2002,32(11):3133-3141.
[5]Desquand S,Rothhut B,Vargaftig BB.Role of immunoglobulins G1 and G2 in anaphylactic shock in the guinea pig.Int Arch Allergy Appl Immunol,1990,93(2/3):184-191.
[6]Undem BJ,Buckner CK,Harley P,et al.Smooth muscle contraction and release of histamine and slow-reacting substance of anaphylaxis in pulmonary tissues isolated from guinea pigs passively sensitized with IgG1 or IgE antibodies.Am Rev Respir Dis,1985,131(2):260-266.
[7]Erdmann SM,Heussen N,Moll-Slodowy S,et al.CD63 expression on basophils as a tool for the diagnosis of pollen-asso-ciated food allergy:sensitivity and specificity.Clin Exp Allergy,2003,33(5):607-614.
[8]Sainte-Laudy J,Sabbah A,Drouet M,et al.Diagnosis of venom allergy by flow cytometry.Correlation with clinical history,skin tests,specific IgE,histamine and leukotriene C4 release.Clin Exp Allergy,2000,30(8):1166-1171.
[9]Abrahamsen O,Haas H,Schreiber J,et al.Differential mediator release from basophils of allergic and non-allergic asthmatic patients after stimulation with anti-IgE and C5a.Clin Exp Allergy,2001,31(3):368-378.
