结核分枝杆菌Ag85B-ESAT-6融合蛋白重组耻垢分枝杆菌对小鼠的免疫原性研究
2012-01-24王平王丽梅张薇柏银兰康健郝彦斐罗泰来徐志凯
王平 王丽梅 张薇 柏银兰 康健 郝彦斐 罗泰来 徐志凯
据WHO估计全世界已有约20亿人感染Mtb,其中受耐药菌株感染者可能达到5000万,有传染性患者1110万,每年新发患者约940万,每年死亡人数高达200万,在所有传染病中TB死亡率仅次于AIDS[1]。WHO将TB与 AIDS、疟疾一起列为人类最主要的传染性杀手。BCG是用于TB预防的惟一有效疫苗,但其保护效果不理想,在不同地区免疫保护效果从0%到80%不等[2],尤其对于成人的保护效果低下。因此,迫切需要研制新型有效的抗结核疫苗以加强对TB的预防和控制。
当前正在开发的TB新型疫苗主要包括亚单位疫苗、基因疫苗、重组BCG疫苗、减毒或增强的全菌体活疫苗及营养缺陷型活疫苗等。其中重组活疫苗是将编码Mtb保护性抗原的基因导入活的微生物载体内进行表达,一方面利用Mtb特异性的保护性抗原获得对Mtb的保护力,另一方面利用活载体强的免疫佐剂特性加强机体产生的特异性免疫反应[3]。因此,在活疫苗的研究中如何获得理想免疫效果的疫苗最关键的是:第一,选择合适的具有免疫佐剂作用的载体;第二,选择合适的靶抗原。
耻垢分枝杆菌(Mycobacterium smegmatis,M.s)是一种生长较快的非致病菌分枝杆菌。研究表明M.s具有与BCG相似的免疫学特性,能够刺激T淋巴细胞增殖,促使分泌各种细胞因子如γ干扰素(IFN-γ)、白细胞介素-2(interleukin-2,IL-2)、白细胞介素-12(interleukin-12,IL-2)等,启动 Th1型免疫应答,提高机体对病原体的吞噬和杀灭作用等[4]。Goldstone等[5-6]将 Mtb 4种分泌型蛋白在 M.s中进行表达,结果M.s中表达的重组蛋白与天然蛋白的生物学特性几乎完全相同,重组蛋白的表达量为BCG中的5~10倍。
Ag85B是Mtb分泌蛋白中含量最高的一个蛋白,其与Mtb的细胞壁的合成有关,并与人纤维连接蛋白结合后参与致病过程。Ag85B具有较强的免疫原性,用Ag85B蛋白或基因疫苗免疫小鼠,对小鼠感染H37Rv毒株具有免疫保护作用。比较基因组学发现,ESAT-6是 Mtb的毒力相关抗原,其在BCG及非致病性分枝杆菌中均缺失。研究发现ESAT-6亚单位疫苗能够激发一种强的ESAT-6特异性T细胞反应保护性,与BCG作用相当;ESAT-6还是免疫回忆效应细胞的主要靶抗原之一,可在再次Mtb感染的早期,诱导其迅速增殖和释放高水平的IFN-γ,激活单核巨噬细胞,并控制感染[7-8]。据文献报道,用Ag85B与ESAT-6融合蛋白亚单位疫苗免疫小鼠,对小鼠具有免疫保护作用,能够降低小鼠对毒株H37Rv的脏器荷菌数,提高小鼠存活率[9]。本课题组前期利用基因重组技术构建表达Ag85B-ESAT-6融合蛋白基因,并利用分枝杆菌表达载体将其电穿导入M.s中表达(重组M.s命名为Ag85B-ESAT 6-r M.s,专利号:CN 101875913A),结果Ag85B-ESAT-6能够在 M.s中特异性的表达。本研究进一步评价了 Ag85B-ESAT-6-r M.s在小鼠中的免疫原性,为其用于TB新型疫苗的研究奠定基础。
材料和方法
1.菌株、质粒和试剂:M.s(ATCC mc2155)、BCG,分泌表达 Ag85B-ESAT-6融合蛋白的重组M.s均由本室保存。7 H9和7H10培养基,油酸白蛋白葡萄糖过氧化氢酶添加剂(OADC)等均购自BD公司(Becton Dickinson公司,USA);淋巴细胞增殖 MTS[3-(4,5-dimethylthiazol-2-yl)-5(3-carboxymethoxyphenyl )-2-(4-sulfopheny )-2H-tetrazolium,inner salt]检测试剂盒、细胞因子IL-2、IL-4和IFN-γ等检测试剂盒均购自 Mabtech公司(Mabtech AB,Stockholm,Sweden)。Ag85B-ESAT-6融合蛋白由本室前期制备保存[10]。
2.实验动物:6周龄BALB/c雌鼠,由第四军医大学动物中心提供。
3.小鼠免疫:6周龄雌性BALB/c小鼠50只,数字表法随机分为5组,每组10只。各组小鼠经背部皮下注射方式免疫,分别为生理盐水(saline)组(0.2 ml/只),BCG 组 1×106CFU/(0.2 ml/只),M.s组1×106CFU/(0.2 ml/只),Ag85B-ESAT-6-r M.s组1×106CFU/(0.2 ml/只),Ag85B-ESAT-6融合免疫组50μg/(0.2 ml/只)。
4.小鼠外周血CD4+和CD8+T细胞所占百分比分析:小鼠免疫1周后开始每周采血1次,随机抽取3只/(组/周),持续至第6周,以尾静脉采血方式采取乙二胺四乙酸(EDTA)抗凝血约300μl,用0.83%NH4Cl红细胞裂解液裂解红细胞制备单个淋巴细胞悬液,用p H 7.4的磷酸盐缓冲液(PBS)调整细胞浓度为1×105个/ml,各取100μl,加10μl荧光标记羊抗鼠单克隆抗体:异硫氰酸荧光素(FITC)标记 CD4和 R-藻红蛋白(RPE)标记 CD8的双抗(Becton Dickinson公司,USA))染色30 min,流式细胞仪检测CD4+、CD8+T细胞所占百分比。
5.ELISPOT检测小鼠脾淋巴细胞细胞因子:各组小鼠免疫6周后断颈处死,无菌分离脾脏。200目铜网研磨制备单个脾细胞。用0.83%NH4Cl红细胞裂解液裂解红细胞制备脾淋巴细胞悬液,调整细胞浓度为2×106个/ml。检测细胞量为2×105个/(100μl/孔)。分别用融合蛋白 Ag85B-ESAT-6(5μg/孔),结核菌素纯蛋白衍生物(PPD)(5μg/孔)和Con A蛋白(5μg/孔)进行刺激。酶联免疫斑点检测(enzyme-linked immunospot assay,ELISPOT)具体实验步骤参照试剂盒说明书进行。
6.小鼠脾淋巴细胞增殖实验:按上述实验方法制备小鼠的脾淋巴细胞悬液,调整细胞浓度为1×105个/ml。用MTS法检测各组小鼠脾淋巴细胞的增殖。实验分为空白对照组(加入培养液)、未刺激组、Ag85B-ESAT-6蛋白刺激组(5μg/孔),PPD 蛋白刺激组(5μg/孔)和Con A蛋白阳性对照组(5μg/孔)。每组设3个复孔,各孔加入细胞1×104/100 μl,37℃ 5%CO2培养 72 h后,加入 MTS 20μl/孔,继续培养3 h,酶标仪490 nm可见光波长测定吸光度,计算淋巴细胞增殖指数,增殖指数(SI)=(试验孔A值-空白对照孔)/(阴性未刺激对照孔-空白对照孔)。
结 果
1.免疫小鼠外周血淋巴细胞CD4+和CD8+T细胞所占百分比:小鼠免疫后1~6周连续尾静脉采血,分离外周血淋巴细胞,流式细胞仪检测CD4+和CD8+T细胞所占百分比。结果表明,与生理盐水组相比,各组免疫小鼠随着免疫时间的延长,小鼠外周血中的CD4+和CD8+T细胞所占比率逐渐增高(图1)。当免疫6周后,Ag85B-ESAT-6-r M.s免疫组小鼠外周血CD4+和CD8+T细胞所占比率达到(59.6±1.5)%,明显高于 BCG 免疫组[(48.8±2.3)%](t=12.252,P<0.05)、M.s免疫组[(45.7±1.6)%](t=20.166,P<0.05)和其他各对照免疫组 小 鼠 [Ag85B-ESAT-6:(45.6±1.7)% (t=19.468,P <0.05),saline:(27.1±1.0)% (t=56.939,P<0.05)]。
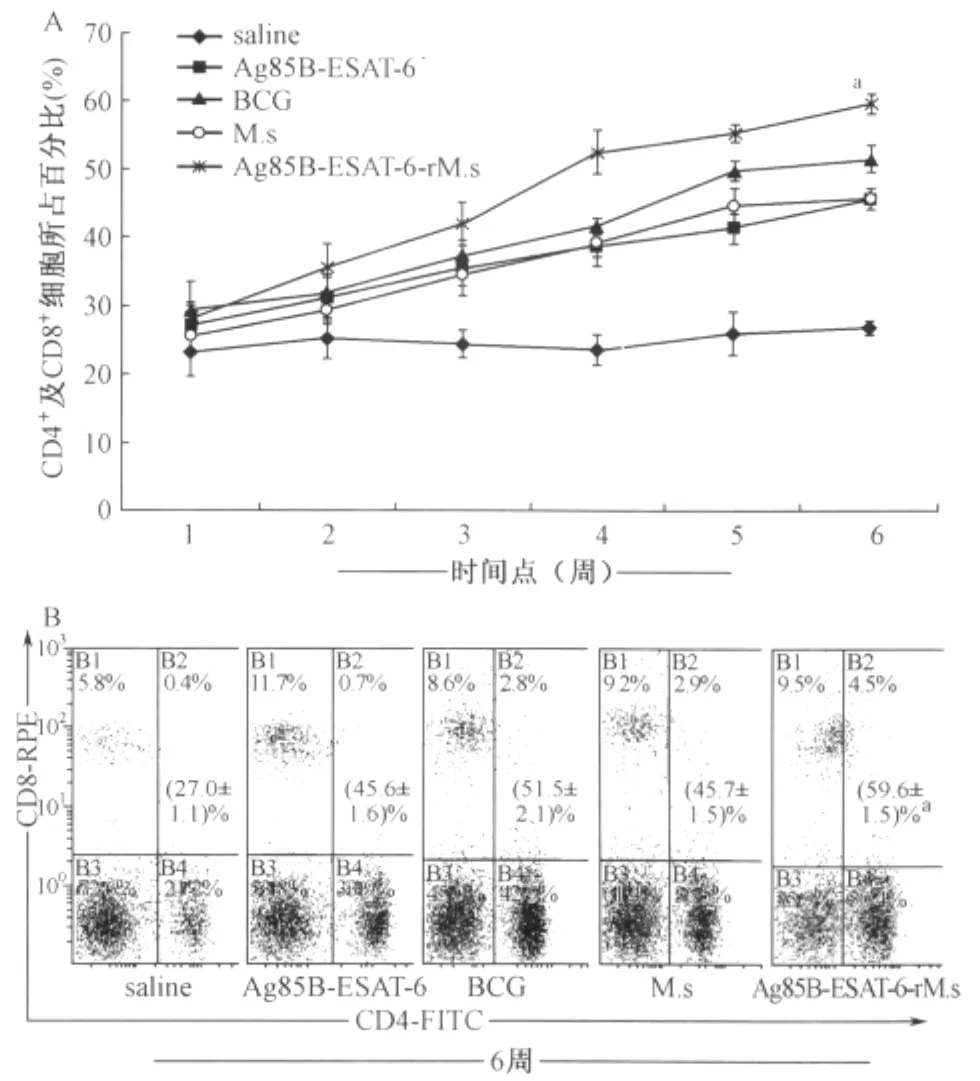
图1 免疫小鼠外周血淋巴细胞中CD4+和CD8+T细胞所占百分比分析
2.ELISPOT检测免疫小鼠脾淋巴细胞细胞因子产生水平:各组小鼠免疫6周后分离小鼠脾淋巴细胞,ELISPOT法检测脾淋巴细胞特异性分泌IFN-γ、IL-2和IL-4等细胞因子的水平[斑点形成细胞(spot forming cells,SFC)],结果如图2所示。与生理盐水组相比,各免疫组均可特异性刺激IFN-γ、IL-2和IL-4等细胞因子的分泌,且分泌IFN-γ的细胞频数明显高于分泌IL-2 [(85.4±20.7)SFC/106]或IL-4[(87.8±13.7)SFC/106]的细胞频数(t=6.174,6.449,P<0.05)。其中 Ag85B-ESAT-6-r M.s免疫小鼠后刺激产生的特异性分泌IFN-γ的细 胞 频 数 最 高 [(167.5±36.6)SFC/106],与saline组[(25.3±18.1)SFC/106]、Ag85B-ESAT-6蛋白 免 疫 组 [(48.7±17.3)SFC/106]、M.s 组[(94.6±27.1)SFC/106]和BCG组[(98.5±26.9)SFC/106]相比,差异具有统计学统计学意义[Ag85B-ESAT-6-r M.s组与对照组t检验,t值分别为:11.013(saline),9.280(Ag85B-ESAT-6),5.062(M.s)和4.804(BCG),P 值均<0.05]。

图2 免疫小鼠脾淋巴细胞产生IFN-γ、IL-2和IL-4等细胞因子的水平
3.免疫小鼠脾淋巴细胞增殖指数:小鼠免疫后6周,MTS法检测免疫小鼠的脾淋巴细胞增殖指数。结果如图3所示,Ag85B-ESAT-6-r M.s免疫小鼠后可以明显刺激小鼠脾淋巴细胞增殖,SI为3.23±0.31,明显高于saline组(1.16±0.26)(t=16.179,P<0.05)和 Ag85B-ESAT-6蛋白免疫组(2.11±0.38)(t=7.222,P<0.05),但与BCG免疫组(2.95±0.36)相比,其免疫小鼠的脾淋巴细胞SI差异无统计学意义(t=1.864,P>0.05)。
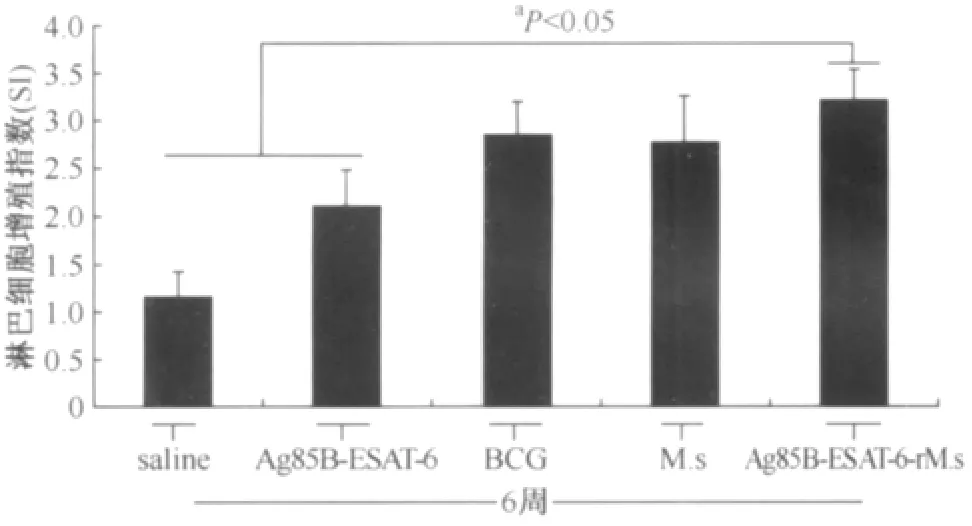
图3 免疫小鼠脾淋巴细胞增殖指数
讨 论
目前TB又死恢复燃,成为威胁人类健康的第一杀手。我国是全球TB高负担国家之一,TB患者数量位居世界第二,而Mtb感染人数则位居世界第一。因此,如何能有效地预防和控制TB在我国尤其显得迫切。
TB新型疫苗的研制是预防和控制TB感染与传播的一个有效途径。当前TB新型疫苗研究的种类有亚单位疫苗、基因疫苗、重组BCG、减毒或增强的全菌体活疫苗及营养缺陷型活疫苗等。不同种类的疫苗有着各自不同的优缺点,其中活疫苗接种后,在体内有一定程度的生长繁殖能力,可以模拟自然感染的过程,刺激机体产生全面的体液免疫、细胞免疫和局部黏膜免疫,免疫效果较高且持久。本研究评价的表达 Mtb Ag85B-ESAT-6融合蛋白的重组耻垢分枝杆菌(Ag85B-ESAT-6-r M.s)经皮下免疫小鼠后可以有效刺激小鼠CD4+和CD8+T淋巴细胞的产生,且从免疫初始开始刺激产生的CD4+和CD8+T细胞所占百分比就明显高于原始M.s刺激产生的和BCG免疫产生的,表明Ag85B-ESAT-6融合蛋白的加入能够明显增强M.s的免疫原性,且Ag85B-ESAT-6-r M.s较 BCG 能够更快和有效地刺激产生CD4+和CD8+T细胞反应应答,这对于机体控制胞内菌Mtb感染具有重要的意义。同时,Ag85B-ESAT-6-r M.s能够明显刺激小鼠脾淋巴细胞增殖,其诱生脾淋巴细胞分泌IFN-γ的水平明显高于BCG免疫组,且分泌IFN-γ的细胞频数也显著高于分泌IL-2和IL-4的细胞频数,表明Ag85BESAT-6-r M.s能够刺激机体产生有利于抗 Mtb感染的免疫反应,作为TB新型候选疫苗具有一定的研究前景。
活疫苗的另一个优点就是其接种途径多。可通过注射、滴鼻、点眼、饮水、口服、气雾等途径刺激机体产生全面的免疫反应。因此,下一步笔者将通过不同的接种途径、不同的免疫剂量来评价Ag85BESAT-6-r M.s重组活疫苗在小鼠模型中抗 Mtb的保护效果,进一步评价其用于TB新型候选疫苗的应用前景。
[1]World Health Organization.Tuberculosis[EB/OL].WHO.Fact Sheet No104,2010.(2010-11-01)[2011-08-16].http://www.who.int/mediacentre/factsheets/fs104.
[2]Wiker HG,Mustafa T,Målen H,et al.Vaccine approaches to prevent tuberculosis.Scand J Immunol,2006,64(3):243-250.
[3]Hoyt A,Thompson MA,Moore FJ,et al.The preparation and mouse evaluation of nonviable,solvent-extracted antituberculous vaccines:(a)main assay findings;(b)stability of nonviable vaccines;(c)a major disadvantage of intravenous challenge.Am Rev Respir Dis,1967,95(5):806-819.
[4]Falcone V,Bassey E,Jacobs W Jr,et al.The immunogenicity of recombinant Mycobacterium smegmatis bearing BCG genes.Microbiology,1995,141(Pt 5):1239-1245.
[5]Goldstone RM,Moreland NJ,Bashiri G,et al.A new Gateway vector and expression protocol for fast and efficient recombinant protein expression in Mycobacterium smegmatis.Protein Expr Purif,2008,57(1):81-87.
[6]Doherty TM,Olsen AW,Weischenfeld TJ,et al.Comparative analysis of different vaccine constructs expressing defined antigens from Mycobacterium tuberculosis.J Infect Dis,2004,190(12):2146-2153.
[7]Wang LM,Shi CH,Fan XL,et al.Expression and immunogenicity of recombinant Mycobacterium bovis Bacillus Calmette-Guérin strains secreting the antigen ESAT-6 from Mycobacterium tuberculosis in mice.Chin Med J(Engl),2007,120(14):1220-1225.
[8]Shi CH,Wang XW,Zhang H,et al.Immune responses and protective efficacy of the gene vaccine expressing Ag85B and ESAT6 fusion protein from Mycobacterium tuberculosis.DNA Cell Biol,2008,27(4):199-207.
[9]Dietrich J,Aagaard C,Leah R,et al.Exchanging ESAT6 with TB10.4 in an Ag85B fusion molecule-based tuberculosis subunit vaccine:efficient protection and ESAT6-based sensitive monitoring of vaccine efficacy.J Immunol,2005,174(10):6332-6339.
[10]师长宏,范雄林,徐志凯,等.结核分枝杆菌分泌蛋白Ag85BESAT6的融合表达及纯化.中华结核和呼吸杂志,2004,27(2):89-92.
