两种多克隆刺激条件下人诱导性Treg表型的多样性变化①
2012-01-23王海灏仰霈雯雷家慧华中科技大学同济医学院附属同济医院器官移植研究所教育部器官移植重点实验室卫生部器官移植重点实验室武汉430030
王海灏 仰霈雯 雷家慧 (华中科技大学同济医学院附属同济医院器官移植研究所教育部器官移植重点实验室卫生部器官移植重点实验室,武汉430030)
越来越多的研究表明,在人体内存在着一群具有免疫抑制功能的细胞,这些细胞在诱导移植免疫耐受、控制自身免疫性疾病和肿瘤免疫等方面发挥着重要的作用。因为这种特殊的细胞可以对免疫反应进行调节,所以顾名思义被称为调节性T细胞(regulatory T cells,Treg)[1-3]。目前已知,人 Treg 被区分为两大类:即自然性调节性T细胞(natural Treg,nTreg)和诱导性调节性T细胞(induced Treg,iTreg)。有研究表明,nTreg在胸腺中产生,而iTreg则是在外周血或外周淋巴组织中,由原始T细胞(na ve T cells)受到自体或异体的抗原刺激而产生[4]。虽然,人nTreg和iTreg都具有免疫抑制功能,但iTreg在诱导移植物免疫耐受中的作用更重要。
1995 年,Sakaguchi等[5]率先报道了 CD4+CD25+T细胞具有免疫抑制功能;然而,随着研究的深入,人和鼠的体内均发现活化的T细胞也表达CD25;进一步的研究发现,只有高表达 CD25(CD25high)的CD4+T细胞才能在体外发挥免疫抑制功能[6-8]。2003年,Sakaguchi研究组发现叉头状转录因子(Forkhead transcription factor,FoxP3)与Treg的发育及功能密切相关[9]。动物实验的结果显示FoxP3仅表达于Treg,而不表达于未激活的CD4+CD25-T 细胞或 Th1、Th2 等细胞中[9,10],因此,直到现在CD4+CD25+FoxP3+都被公认为最具代表性的Treg的细胞表型。近年来,另一个人Treg的细胞标志物CD127-逐渐被人们所熟悉,IL-7受体CD127表达在细胞表面,并且与FoxP3呈明显的负相关,Treg 不表达或弱表达 CD127[11]。
虽然iTreg的作用有细胞与细胞间接触和分泌细胞因子两种途径,但是无论在体外还是体内实验的结果都表明,分泌细胞因子的途径是起主要作用的[12,13]。因此,除了上述的这些特异性细胞标志物外,一些非特异性的细胞因子也因为与iTreg的功能相关而被用于 iTreg的细胞表型中,如 IL-2-、IL-10+、TGF-β+、IFN-γ+等。
然而,在静态条件下,T细胞并不或仅少量分泌产生细胞因子,为了研究细胞因子的变化,必须首先激活淋巴细胞。目前常用的淋巴细胞刺激剂为PMA(Phorbol 12-myristate 13-acetate,豆蔻酰佛波醇乙酯)和Ionomycin(离子霉素),二者联合使用被视为淋巴细胞最经典的多克隆刺激剂。然而,PMA/Ionomycin的刺激有一个无法回避的缺陷,即会显著抑制CD4的表达,这一特点对实验对象为CD4+T细胞的相关研究(如研究iTreg)将产生不利影响。近年来,其他的淋巴细胞刺激剂也陆续出现在相关报道中,如PHA(Phytohaemagglutinin,植物血凝素)等。本研究分别使用PMA/Ionomycin和PHA对人淋巴细胞进行刺激,检测iTreg的诱导和细胞表型变化,分析其多样性。本实验在体外分离人外周血单个核细胞(Peripheral blood mononuclear cells,PBMC)后进行多克隆刺激,诱导产生iTreg,以四色流式细胞仪检测其表达特异性/非特异性细胞标志物和相关细胞表型的变化。
1 材料与方法
1.1健康受试者 本实验中每组实验均选取5名健康受试者。本实验实施前已经获得本单位伦理委员会批准,并遵循《赫尔辛基宣言》的精神。所有健康受试者均被详细告知本实验的过程和目的,并签署知情同意书。
1.2实验分组 实验依不同的实验方法分为4组:①空白对照组:分离出PBMC后马上染色检测;②非刺激对照组:PBMC与细胞培养液RPMI1640(购自Invitrogen Gibco公司)培养16小时后检测;③PMA/Ionomycin刺激组:将 PBMC与含 PMA/Ionomycin(购自Sigma公司)的培养液培养16小时后检测;④PHA刺激组:将PBMC与含PHA(购自Remel公司)的培养液培养16小时后检测。
1.3细胞制备、培养 用Ficoll梯度离心法从外周血(50 ml)中提取外周血单个核细胞(PBMC)。用含10%胎牛血清(FCS-500)的RPMI1640将试管中PBMC的浓度调整为1×106ml-1。空白对照组的PBMC马上染色并上机检测,其余各组则以1∶1的比例,将PBMC与10%RPMI1640细胞培养液(非刺激对照组)、含 PMA(10 ng/ml)/Ionomycin(1 μg/ml)的培养液(PMA/Ionomycin刺激组)或含PHA(180 μg/ml)的培养液(PHA刺激组)置于CO2培养箱中培养16小时。
1.4流式细胞计数检测前准备 将培养后的PBMC从培养箱中取出,依分组移入准备好的试管,1 300 r/min离心8分钟,弃上清。以10 μl PerCP-mouse-IgG1、20 μl FITC-mouse-IgG1、20 μl APC-mouse-IgG1以及 20 μl PE-rat-IgG1(均购自 BD公司)作为Isotype control;依实验计划,在试管中加入细胞表面抗体 CD4(PerCP,20 μl,BD)、CD25(APC,5 μl,BD)、CD127(FITC,5 μl,BD),振荡后室温下避光培养15分钟,加入2 ml缓冲液(DPBS,购自Invitrogen Gibco公司),洗细胞(1 300 r/min转速离心 8分钟,弃上清)。加入 500 μl Perm2溶液(BD公司)作细胞透膜处理,振荡后室温下避光培养10分钟。再加入2 ml DPBS洗细胞。加入胞内抗体 FoxP3(PE,20 μl,BD)、FoxP3(FITC,5 μl,eBioscience)、IFN-γ (FITC,10 μl,BD)、IL-2(FITC,10 μl,BD)、IL-10(PE,10 μl,BD)、TGF-β(PE,20 μl,R&D)。振荡后室温下避光培养30分钟,加入2 ml DPBS洗细胞;再加入2 ml DPBS,继续培养30分钟,洗细胞。以四色流式细胞仪(Flow Cytometry,Calibur,BD公司)检测。
1.5流式检测的设门策略 每支试管有至少100 000信号被记录和分析。首先根据前向散射(FSC)和侧向散射(SSC)设门选择淋巴细胞群,然后再根据不同的实验目的进行再次设门,如选择CD4+CD25+PBL等。
1.6统计学分析 本实验所有实验数据用±s的形式表达,用 PASW Statisticc 18.0(IBM,Chicago,Illinois,USA)统计软件进行方差分析,以P<0.01为有明显统计学差异。
2 结果
2.1PHA不抑制T细胞CD4的表达 图1所示可见本实验的设门策略。与非刺激组相比,PMA/Ionomycin刺激16小时后,CD4的表达明显下降;同时,PHA刺激后,CD4的表达并不明显减少。有意思的是,从图1中还可以发现,PMA/Ionomycin和PHA的多克隆刺激后,CD3的表达均略有下降。可见,PMA/Ionomycin的刺激可以显著抑制T细胞CD4分子的表达,而PHA并不抑制其表达。
2.2两种多克隆刺激均可明显诱导产生大量CD4+CD25+FoxP3+CD127-iTreg 图2所示,在从全血分离得到PBMC(空白对照组)中,CD4+CD25+FoxP3+CD127-占全部CD4+T细胞的比例仅为2.0% ±2.6%,即为nTreg的含量。在细胞培养液中培养16小时后,这一比例未见明显变化(P=n.s.);用PMA/Ionomycin刺激 16小时后,CD4+CD25+FoxP3+CD127-iTreg的表达升为26% ±19%(P<0.01),而用PHA刺激16小时后则上升为49% ±8.3%(P<0.01)。实验结果表明,细胞培养液并不能诱导产生CD4+CD25+FoxP3+CD127-iTreg,而不论是PMA/Ionomycin还是PHA,均可以显著诱导产生CD4+CD25+FoxP3+CD127-iTreg。
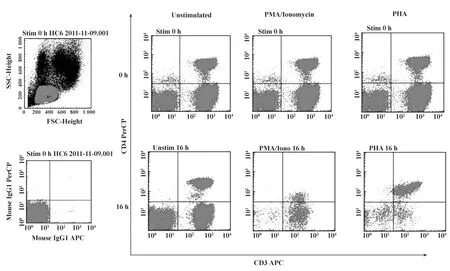
图1 设门策略及CD3和CD4分子在多克隆刺激下的表达Fig.1 Gating strategy and expressions of CD3 and CD4 during polyclonal stimulation
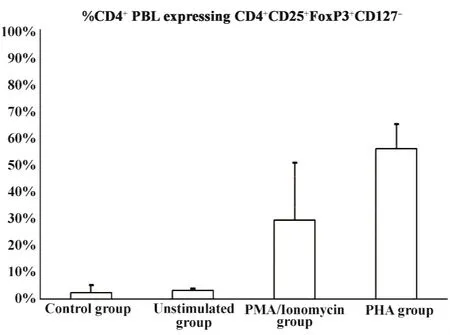
图2 CD4+CD25+FoxP3+CD127-PBL在两种多克隆刺激条件下的表达Fig.2 Expression of CD4+CD25+FoxP3+CD127- PBL during polyclonal stimulation
2.3多克隆刺激对 IL-2-、IL-10+和 TGF-β+Treg的影响 多克隆刺激后CD4+CD25+FoxP3+IL-2-、CD4+CD25+FoxP3+IL-10+和CD4+CD25+FoxP3+TGF-β+iTreg的表达上升,且 PHA对 IL-2-和TGF-β+iTreg的诱导比PMA/Ionomycin强。细胞培养16小时后,可以观察到,在非刺激对照组中,CD4+CD25+FoxP3+IL-2-、CD4+CD25+FoxP3+IL-10+和 CD4+CD25+FoxP3+TGF-β+iTreg的表达与空白对照组中没有明显变化(16 h vs 0 h:P=n.s.,见表1~3),而经过PMA/Ionomycin或PHA刺激16小时后,上述iTreg的表达明显上升(均P<0.01),提示表达 IL-2-、IL-10+或 TGF-β+的 CD4+CD25+FoxP3+iTreg经多克隆刺激后可以明显被诱导产生,却不能被细胞培养液诱导。有意思的是,PHA刺激后CD4+CD25+FoxP3+IL-2-的比例较之PMA/Ionomycin刺激后有明显的差异(42% vs 27%,P<0.01,表1),同样的情况也可以在CD4+CD25+FoxP3+TGF-β+iTreg的表达上观察到(33%vs 19%,P<0.01,表2),但 PHA 和 PMA/Ionomycin对CD4+CD25+FoxP3+IL-10+iTreg的刺激却并没有显著的差异(26%vs 19%,P=n.s.,表3),提示PMA/Ionomycin和 PHA虽然都可以产生 CD4+CD25+FoxP3+iTreg,但刺激的强度并不相同。
2.4PMA/Ionomycin可诱导CD4+CD25+FoxP3+IFN-γ+的表达升高 表4的结果显示,CD4+CD25+FoxP3+IFN-γ+在nTreg中比例极低,接近于零;经过16小时的刺激后,仅PMA/Ionomycin可以成功的诱导产生CD4+CD25+FoxP3+IFN-γ+iTreg(vs非刺激对照组:P<0.01),而PHA却不行(vs非刺激对照组:P=n.s.,表4),提示 PMA/Ionomycin和 PHA 的刺激途径是不同的。
2.5PMA/Ionomycin刺激后,CD4+CD25+FoxP3+IFN-γ+iTreg的表达与CD25的水平呈负相关 在空白对照组和非刺激对照组中,无论CD25的表达高或低,都几乎没有 CD4+细胞表达 FoxP3+IFN-γ+;而经过 PMA/Ionomycin刺激16小时后,CD4+FoxP3+IFN-γ+PBL的表达明显上升(均P<0.01)。有意思的是,将用PMA/Ionomycin刺激16小时后的PBMC根据CD25的表达水平来设门后发现,CD4+CD25-FoxP3+IFN-γ+的 表 达 高 于 CD4+CD25intermediateFoxP3+IFN-γ+和 CD4+CD25highFoxP3+IFN-γ+的表达,即诱导产生的 CD4+FoxP3+IFN-γ+PBL的表达与 CD25呈逆相关(图3),且 CD4+CD25-FoxP3+IFN-γ+的 表 达 水 平 与 CD4+CD25intermediateFoxP3+IFN-γ+、CD4+CD25highFoxP3+IFN-γ+相比均有显著性差异(13% ±3.7% vs 3.4% ±2.4%,13% ±3.7%vs 1.4% ±2.0%,均P<0.01),但是 CD4+CD25intermediateFoxP3+IFN-γ+和CD4+CD25highFoxP3+IFN-γ+相比则无统计学差异(P=n.s.),这个结果表明,在多克隆刺激后诱导产生的CD4+FoxP3+IFN-γ+PBL中,真正具有免疫抑制功能的CD4+CD25highFoxP3+IFN-γ+iTreg只是很少一部分,这也反映了iTreg的多样性变化。

表1 CD4+CD25+FoxP3+IL-2-iTreg的表达Tab.1 Expression of CD4+CD25+FoxP3+IL-2- iTreg

表2 CD4+CD25+FoxP3+TGF-β+iTreg的表达Tab.2 Expression of CD4+CD25+FoxP3+TGF-β+iTreg

表3 CD4+CD25+FoxP3+IL-10+iTreg的表达Tab.3 Expression of CD4+CD25+FoxP3+IL-10+iTreg

表4 各组CD4+CD25+FoxP3+IFN-γ+iTreg占全部CD4+PBL的百分比Tab.4 Proportion of CD4+PBL expressing CD4+CD25+FoxP3+IFN-γ+iTreg

图3 CD4+FoxP3+IFN-γ+PBL与CD25的表达的关系Fig.3 Relationship between expression of CD4+FoxP3+IFN-γ+PBL and CD25
3 讨论
Treg(尤其是iTreg)的细胞表型多样性研究一直是Treg相关研究的热点。在各种文献报道中,多种细胞标志物被用于表示iTreg的细胞表型,造成在对iTreg进行比较和研究时常常产生误会。
本实验,既关注于iTreg的特异性细胞标志物(CD25+、FoxP3+、CD127-),又关注于非特异性细胞标志物(IL-2-、IL-10+、TGF-β+、IFN-γ+),通过在体外实验中多克隆刺激的方式,诱导产生不同细胞表型的iTreg,研究其刺激前后的变化。实验中,对于全血进行淋巴细胞分离后马上检测的新鲜细胞(Fresh cells)的结果,可以反映血液中nTreg的状况。通过实验中可以看出,外周血中细胞表型为CD4+CD25+FoxP3+CD127-的 nTreg约占全部CD4+T细胞的4%左右,这部分nTreg细胞在维持自身的免疫稳态中发挥着重要的作用。而非特异性细胞标志物在nTreg中的表达同样非常低,这是因为在静止状态下,机体不分泌或仅分泌少量的细胞因子。只有在细胞活化的时候,细胞内合成细胞因子才会增加。要研究细胞因子的变化,必须使用淋巴细胞刺激剂使之活化。
目前最常用的淋巴细胞刺激剂是PMA/Ionomycin和PHA两种。本实验研究和比较了两种激活剂对iTreg的刺激效果,为选择合适的实验剂量,在课题预实验中,我们比较了 PMA(5、10、20 ng/ml)/Ionomycin(0.5、1、2 μg/ml) 和 PHA(90、180、270 μg/ml)等多个剂量对 T 细胞 CD4、CD8、CD25、IL-10、TGF-β、IFN-γ的刺激效果,各浓度间无明显差异(P=n.s.,具体数据未显示),均可视为对淋巴细胞充分刺激。
本实验结果显示,PMA/Ionomycin和PHA均可以有效的刺激静止的淋巴细胞活化,并诱导产生iTreg。值得注意的是,这二者刺激的效果并不一样,对表达 IFN-γ的 Treg诱导过程中可以发现,PMA/Ionomycin可以有效的刺激产生CD4+CD25+FoxP3+IFN-γ+iTreg,而PHA则不能诱导产生;而对于表达IL-2-和TGF-β+的Treg的诱导过程中可以看到,PMA/Ionomycin和PHA对iTreg的刺激力度是不一样的,提示PMA/Ionomycin和PHA对淋巴细胞的刺激有不同的作用途径。另外,以PMA/Ionomycin作为激活剂对淋巴细胞进行刺激会显著降低CD4分子的表达(本实验中,刺激前54%的CD3+T细胞表达CD4+,而刺激后仅16%,具体数据未显示),这严重影响到后续实验中以CD4+细胞设门分析iTreg的表达。因此,有报道指出,可以用CD3+CD8-T细胞设门来代替 CD3+CD4+T 细胞[14];但是,我们在以非CD4组合抗体(Cocktail sets)和CD8抗体进行比较后发现,PMA/Ionomycin刺激后的淋巴细胞表达CD3+CD4-的细胞并非全部表达CD3+CD8+(具体数据未显示),即CD3+CD8-T细胞也并不能代替CD3+CD4+T细胞,它还包括有自然杀伤细胞(NK细胞)和部分CD3+CD8-CD4-细胞。有意思的是,虽然PMA/Ionomycin刺激后会降低CD4+的表达,但是刺激后CD4+iTreg的表达却明显升高,各种特异性和非特异性的细胞标志物均明显升高。同时,对于本实验所观测几项指标,除了CD4+CD25+FoxP3+IFN-γ+iTreg外,其余的细胞标志物在受到PHA的刺激后升高的程度比PMA/Ionomycin更高,这为进一步的分选择iTreg或功能实验提供了一种新的选择。另外,经过PMA/Ionomycin或PHA刺激后,流式细胞检测时会发现PBMC与刺激前出现了明显的变化,表现为淋巴细胞群与单核细胞群出现明显的重叠,并由于染色过程中破膜,使得细胞变小、颗粒减少,在FSC-SSC散点图上表现为细胞群向左下移动、聚集,而不易圈出明显的淋巴细胞群。
在所有细胞因子中,分泌IL-10、TGF-β及缺乏IL-2一直被公认为是与iTreg的发育和功能密切相关,本实验也观测到 CD4+CD25+FoxP3+IL-2-iTreg、CD4+CD25+FoxP3+IL-10+iTreg 和 CD4+CD25+FoxP3+TGF-β+iTreg在受到刺激后表达明显升高。IFN-γ是一类比较特殊的细胞因子。虽然几乎所有的淋巴细胞都可以产生IFN-α和IFN-β,但是只是活化T细胞和NK细胞才能产生IFN-γ。以前,IFN-γ被认为是Th1细胞的标志性细胞因子,但是后来又发现Treg和CD8+T细胞同样可以产生IFN-γ,且IFN-γ在抗炎症、抗肿瘤和免疫调节方面发挥着重要的作用。
近来,德国Daniel研究组(笔者作为主要研究者参与其中)陆续报道,表达IFN-γ的CD4+iTreg和肾移植术后患者移植肾功能长期存活密切相关。在对肾移植术后患者的长期随访监测中发现,与移植肾功能受损的患者相比,移植物功能良好的患者体内表达 IFN-γ的 CD4+Treg(CD3+CD4+CD25+FoxP3+IFN-γ+)数量明显升高,提示 IFN-γ 也许在诱导人移植物免疫耐受中发挥着重要的作用,并认为CD4+CD25+FoxP3+IFN-γ+iTreg的免疫抑制功能可能是IFN-γ依赖性的[15-17]。本实验观察到,虽然PMA/Ionomycin刺激后,CD4+CD25+FoxP3+IFN-γ+iTreg的表达会明显升高,但是其表达水平与CD25的水平呈逆相关,虽然 CD4+CD25intermediateFoxP3+IFN-γ+和 CD4+CD25highFoxP3+IFN-γ+的水平无明显差异,但是随着CD25水平的升高,CD4+CD25+FoxP3+IFN-γ+iTreg占所有CD4+T细胞的百分比越低,这也许表明真正具有免疫抑制功能的CD4+CD25+FoxP3+IFN-γ+iTreg在外周血中含量极低。值得探讨的是,虽然也有文献报道刺激后的CD4+CD25-T细胞表达FoxP3+,且同样会产生活化的细胞因子[18],但本实验中观察到的部分细胞刺激后表达为 CD4+CD25-FoxP3+IFN-γ+,是否全部为诱导性的CD4+CD25-T细胞,是否包括部分的自然杀伤T细胞(NKT细胞),这些都值得进一步的深入研究。
综上所述,本实验通过使用PMA/Ionomycin和PHA对人PBMC进行多克隆刺激后可以诱导产生iTreg。不同细胞表型的iTreg反映了人调节性T细胞的多样性变化,同时细胞表型中表达或不表达的细胞因子与iTreg的作用机制可能密切相关;实验中同时发现PMA/Ionomycin和PHA对人iTreg诱导的机制和程度不一样。这些实验结果将有利于进一步开展人iTreg的功能实验,并最终将人iTreg的实验成果应用于临床的诊断和治疗实践中。
1 Sakaguchi S,Wing K,Onishi Y et al.Regulatory T cells:how do they suppress immune responses? [J].Int Immunol,2009;21:1105-1111.
2 Nomura T,Sakaguchi S.Naturally arising CD25+CD4+regulatory T cells in tumor immunity[J].Curr Top Microbiol Immunol,2005;293:287-302.
3 Sakaguchi S.Regulatory T cells:key controllers of immunologic selftolerance[J].Cell,2000;101:455-458.
4 Bluestone J A,Abbas A K.Natural versus adaptive regulatory T cells[J].Nat Rev Immunol,2003;3:253-257.
5 Sakaguchi S,Sakaguchi N,Asano M et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alphachains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J].J Immunol,1995;155:1151-1164.
6 Takahashi T,Kuniyasu Y,Toda M et al.Immunologic self-tolerance maintained by CD25+CD4+naturally anergic and suppressive T cells:induction of autoimmune disease by breaking their anergic/suppressive state[J].Int Immunol,1998;10:1969-1980.
7 Baecher-Allan C,Brown J A,Freeman G J et al.CD4+CD25highregulatory cells in human peripheral blood[J].J Immunol,2001;167:1245-1253.
8 Wang Z,Fu X Y,Shi B Y et al.Antigen-specific suppression by induced CD4+CD25highregulatory T cells in kidney recipients[J].Transplant Proc,2009;41:1574-1576.
9 Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003;299:1057-1061.
10 Fontenot J D,Gavin M A,Rudensky A Y.Foxp3 programs the development and function of CD4+CD25+regulatory T cells[J].Nat Immunol,2003;4:330-336.
11 Liu W,Putnam A L,Xu-Yu Z et al.CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+T reg cells[J].J Exp Med,2006;203:1701-1711.
12 Thornton A M,Donovan E E,Piccirillo C A et al.Cutting edge:IL-2 is critically required for the in vitro activation of CD4+CD25+T cell suppressor function[J].J Immunol,2004;172:6519-6523.
13 Sanchez-Lockhart M,Marin E,Graf B et al.Cutting edge:CD28-mediated transcriptional and posttranscriptional regulation of IL-2 expression are controlled through different signaling pathways[J].J Immunol,2004;173:7120-7124.
14 Rostaing L,Tkaczuk J,Durand M et al.Kinetics of intracytoplasmic Th1 and Th2 cytokine production assessed by flow cytometry following in vitro activation of peripheral blood mononuclear cells[J].Cytometry,1999;35:318-328.
15 Daniel V,Naujokat C,Sadeghi M et al.Observational support for an immunoregulatory role of CD3+CD4+CD25+IFN-gamma+blood lymphocytes in kidney transplant recipients with good long-term graft outcome[J].Transpl Int,2008;21:646-660.
16 Volker Daniel,Mahmond Sadeghi,Haihao Wang et al.CD4(+)CD25(+)Foxp3(+)IFN-γ(+)human induced T regulatory cells are induced by interferon-γ and suppress alloresponses nonspecifically[J].Hum Immunol,2011;72:699-707.
17 Volker Daniel,Mahmond Sadeghi,Haihao Wang et al.CD4+CD25+Foxp3+IFN-g+induced human Treg are a heterogenous cell population suppressing alloresponses specifically as well as unspecifically[J].Transpl Int,2011;24(Suppl 2):114-119.
18 Naqar M,Vernitsky H,Cohen Y et al.Epigenetic inheritance of DAN methylation limits activation-induced expression of FOXP3 in conventional human CD25-CD4+T cells[J].Int Immunol,2008;20(8):1040-1055.
