参一胶囊联合化疗对胰腺癌患者外周血细胞水平及免疫细胞活性的影响
2012-01-22马少军单丽珠
马少军,张 洁,单丽珠,张 鹤,王 欢
天津市南开医院肿瘤科(天津 300100)
化疗在肿瘤治疗中居于重要位置,但在抑制肿瘤细胞生长同时,也会杀伤机体正常细胞,损伤正气,对造血系统亦有抑制作用[1]。通过合理有效的化疗方案和联合拮抗毒副反应的其他药物,最大限度地减少毒副反应的发生率,可提高患者生存质量和依存性。我们于2010年3月—2011年8月,应用参一胶囊联合吉西他滨治疗36例胰腺癌,取得较好效果。
1 资料与方法
1.1 一般资料 经病理或细胞学,或经影像学检查确诊的胰腺癌患者66例,估计生存期超过3个月;一般状况Karnorfsy>60分;近3个月无化疗史者;化疗前WBC>3.5×109/L,PLT>90×109/L,肝肾功能大致正常。按入院单双日半随机分为两组。治疗组36 例,男22 例,女14 例;年龄39~72 岁,中位年龄56.6岁。临床分期:Ⅲa期13例,Ⅲb期17例,Ⅳ期6例。对照组30例,男21例,女9例;年龄41~73岁,中位年龄57.5岁。临床分期:Ⅲa期10例,Ⅲb期13例,Ⅳ期7 例。两组一般资料差异无显著意义,P <0.05,具有可比性。
1.2 治疗方法 两组化疗均采用吉西他滨单药方案,即吉西他滨1 g/m2,d1、8、15,28 d为1周期,治疗4~6 个月。治疗组于化疗的当天口服人参皂甙Rg3(参一胶囊,吉林亚泰制药生产)每次2 粒,2 次/d,28 d为1疗程,共用4~6个疗程。两组均不使用其他明显影响血细胞及免疫功能的药物。
1.3 检测指标于每个周期化疗前后检测外周血细胞、T细胞亚群和NK细胞活性 外周血细胞检测用西斯美康血细胞分析仪测定;T细胞亚群和NK细胞采用单克隆抗体APAAP 法测定。试剂盒由北京邦定生物医学公司提供。
1.4 统计学方法 计量资料以(±s)表示,采用t检验,以P<0.05为显著性差异标准。
2 结果
2.1 血常规 治疗组治疗前后血白细胞、红细胞及血小板含量无显著差异(P >0.05)。对照组治疗前后血白细胞及血小板含量均有显著性差异(P <0.05),血红蛋白无显著性差异(P>0.05)。见表1。
2.2 T 细胞亚群及NK 细胞 治疗组T 细胞亚群及NK 细胞活性都有所上升,而对照组都表现为下降,差异具有显著性(P<0.05)。见表2。
表1 两组治疗前后血常规比较(±s,×109)
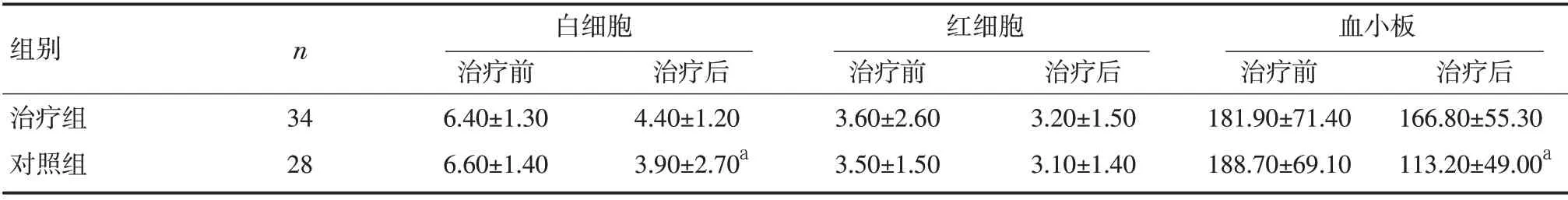
表1 两组治疗前后血常规比较(±s,×109)
注:与本组治疗前比较,aP<0.05
组别治疗组对照组n 34 28白细胞治疗前6.40±1.30 6.60±1.40治疗后4.40±1.20 3.90±2.70a红细胞治疗前3.60±2.60 3.50±1.50治疗后3.20±1.50 3.10±1.40血小板治疗前181.90±71.40 188.70±69.10治疗后166.80±55.30 113.20±49.00a
表2 两组治疗前后T细胞亚群和NK细胞活性治疗前后变化(±s)
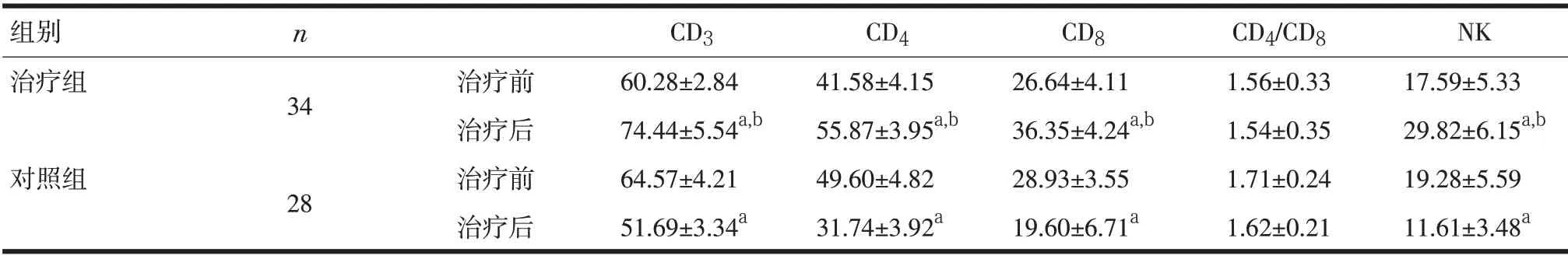
表2 两组治疗前后T细胞亚群和NK细胞活性治疗前后变化(±s)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.01
组别治疗组对照组n 34 28治疗前治疗后治疗前治疗后CD3 60.28±2.84 74.44±5.54a,b 64.57±4.21 51.69±3.34a CD4 41.58±4.15 55.87±3.95a,b 49.60±4.82 31.74±3.92a CD8 26.64±4.11 36.35±4.24a,b 28.93±3.55 19.60±6.71a CD4/CD8 1.56±0.33 1.54±0.35 1.71±0.24 1.62±0.21 NK 17.59±5.33 29.82±6.15a,b 19.28±5.59 11.61±3.48a
3 讨论
胰腺癌是预后最差的恶性肿瘤之一,近年来城市发病率迅速上升,死亡率极高。3/4的病人确诊时已失去手术机会,几乎不可治愈。吉西他滨作为中晚期胰腺癌一线化疗药物,有效率为26.8%[2],疾病无进展时间13.4 个月,中位生存期22.8 个月[3]。化疗因严重毒副反应,如骨髓、免疫抑制等,降低了化疗的耐受性,使化疗结果不能令人满意。中医认为,“正气不足,而后邪气踞之”,中晚期胰腺癌患者多体质虚弱,气血不足,驱邪无力,加之化疗药物的毒副反应,使毒邪内壅,阻碍气机调畅,使全身脏腑功能大大减退。临症见:腹痛绵绵,精神倦怠,少气懒言,面色无华,形体瘦消。舌淡,苔薄白。脉虚细。研究发现,补益气血、扶正抗癌类中药配合化疗,与单纯化疗相比,能够显著减轻由化疗带来的毒副反应,改善患者的生活质量,提高远期疗效[4]。参一胶囊从中药人参中分离出来的有效成分人参皂甙Rg3,具有培元固本,补益气血的功效。该药能通过抑制肿瘤新生血管生成具有抗癌作用[5],与细胞毒药物联合应用时,可使抗肿瘤疗效叠加,提高化疗有效率[6]。一项Ⅱ期临床试验已经证实该药与化疗药联合应用,对气虚证肺癌患者有增效减毒作用,能提高免疫功能和改善生存质量[7]。目前尚未有该药与化疗联合应用于胰腺癌的临床报道。
由化疗引起的骨髓抑制,导致白细胞下降及血小板减少在临床中相当普遍,尤其是白细胞减少时,任何感染都将对患者的生命构成潜在危险。在胰腺癌患者选择吉西他滨化疗后,约62%病人发生粒细胞、白细胞减少,Ⅲ~Ⅳ度的发生率粒细胞下降17%、白细胞下降9.5%,约35%发生血小板下降,其中Ⅲ~Ⅳ度约为8.5%[8]。此时需要终止化疗,如伴有发热,首先要隔离,并给予抗生素预防或治疗。本研究中,治疗组白细胞、红细胞及血小板均未见明显下降,而对照组显著下降,说明参一胶囊能降低化疗引起的骨髓抑制,保护造血系统功能显著,使患者能更好的耐受化疗,提高疗效。T 淋巴细胞及其亚群、NK 细胞在抗肿瘤免疫中具有极其重要的作用。测定CD3+、CD4+、CD8+、CD4+/CD8+,能直接反映患者的细胞免疫水平[9]。NK 细胞则具有非特异地直接杀伤靶细胞的功能。研究显示,治疗组口服参一胶囊后,T 细胞亚群、NK 细胞明显高于单纯化疗组(P <0.05),提示参一胶囊联合化疗能改善晚期胰腺癌的细胞免疫状态,维持患者的免疫水平稳定,为抑制肿瘤发生、发展起到积极作用。
综上所述,参一胶囊联合化疗能增强机体免疫功能,降低化疗后血液学毒性反应的发生率,可以作为晚期胰腺癌化疗的辅助用药。
[1]孙燕.内科肿瘤学[M]. 第5 版.北京:人民卫生出版社,2001:90-134.
[2]Louvet C,Labianca R,Hammel P,et al.Gemcitabine in combina⁃tion with oxaliplatin compared with gemcitabine alone in locally ad⁃vanced or metastatic pancreatic cancer:results of a GERCOR and GISCAD phase III trial [J]. J Clin Oncol,2005,23(6):3509-3516.
[3]Neuhaus P,Riess H,Post S,et al.CONKO-001:Final results of the randomized,prospective,multicenter phase III trial of adjuvant chemotherapy with gemcitabine versus observation in patients with resected pancreatic cancer (PC) [J]. J Clin Oncol, 2008, 26 (Sup⁃pl):Abstr LBA4504-4510.
[4]孙一予,马少军,贾英杰,等.参芪扶正注射液联合化疗对非小细胞肺癌患者外周血细胞水平及免疫细胞活性的影响[J]. 中国中医急症,2007,1 6(7):776-777.
[5]Luo X,Wang CZ,Chen J,et al.Characterization of gene expres⁃sion regulated by American ginseng and gins enoside Rg3 in hu⁃man colorectal cancer cells [J]. Int J Oncol,2008,32 (5):975-983.
[6]盛华明,朱晓霞,吴丹.NP 方案联合参一胶囊治疗晚期非小细胞肺癌疗效观察[J]. 华西医学, 2009,24( 12):3198-3199.
[7]林洪生,朴炳奎,李树奇.参一胶囊治疗肺癌Ⅱ期临床试验总结[J]. 中国肿瘤临床,2002,29(4):276-279.
[8]丁永斌,夏建国.肿瘤化疗处方手册[M]. 第2版.南京,江苏科学技术出版社,2007:145-146.
[9]王鸿利.实验诊断学[M]. 第2 版.北京:人民卫生出版社,2001:222-224.
