组织块法培养人胃成纤维细胞及其结缔组织生长因子的表达
2012-01-17肖在鹏史炼钢杨佩满邵淑娟赵瑾瑶
肖在鹏,史炼钢,胡 祥,杨佩满, 邵淑娟,胡 军,赵瑾瑶
(1.大连市中心医院 普外一科, 辽宁 大连 116033; 2. 大连医科大学 附属第一医院 普外科, 辽宁 大连 116011 ; 3. 大连医科大学 组织学胚胎学教研室, 辽宁 大连 116044)
成纤维细胞是结缔组织中最常见的细胞,由胚胎时期的间充质细胞分化而来。电镜下,成纤维细胞胞质内可见丰富的粗面内质网、游离核糖体和高尔基复合体,表明其具有合成和分泌蛋白质的功能。己知成纤维细胞的主要功能之一是合成胶原蛋白及其他细胞外基质,在组织器官纤维化过程中发挥重要作用。在纤维化疾病的研究中,原代培养成纤维细胞是基础工作之一。成纤维细胞的原代培养方法可分为酶消化法和组织块法,其中组织块法因其操作简便、条件易于控制而应用更为普遍,因此本研究采用组织块法对人胃成纤维细胞进行原代培养,为进一步研究提供实验材料。
1 材料和方法
1.1 主要试剂和仪器
胎牛血清(TBD Company);胰蛋白酶(Hyclone,USA);DMEM培养基(Hyclone,USA);RT-PCR试剂盒(Takara Company);DNA Marker DL 2000 (Takara Company);鼠抗人波形蛋白抗体(北京中山试剂公司);鼠抗人角蛋白抗体(北京中山试剂公司);TritonX-100(北京中山试剂公司);FITC羊抗兔IgG (北京中山试剂公司);羊抗小鼠SP免疫组化试剂盒(北京中山试剂公司);人Connective Tissue Growth Factor (CTGF)多克隆抗体 (武汉博士德生物技术公司);CO2细胞培养箱(Forma,USA);倒置相差显微镜 (Olympus,Japan);PCR 扩增仪(PE2400,USA)。
1.2 实验方法
1.2.1 成纤维细胞的培养
采用组织块贴壁法进行人胃成纤维细胞的原代培养,其步骤如下:取标本前征得患者及家属同意,并通过伦理委员会批准。由手术台上取得胃癌标本,立即于台下无菌条件下,选择远离肿瘤部分(经病理检查无肿瘤细胞),严格切取胃壁的黏膜层,去除皮下脂肪组织,以生理盐水冲洗去血后,于0.1%洗必泰溶液中浸洗2 min,再以生理盐水反复冲洗去除洗必泰,置于盛有含100 U/mL青霉素、100 μg/mL链霉素DMEM培养液的小玻璃瓶里(冰盒中),尽快送入实验室。在超净台上,将瓶内胃黏膜组织从瓶中转移至无菌培养皿中,用生理盐水冲洗标本3次。在培养皿中将胃黏膜组织切成适当大小的组织块(1~2 mm3),去掉脂肪组织。 另取一无菌培养皿,以眼科镊将组织块送入培养皿中摆好,组织块间距约为5 mm。将无菌盖玻片轻轻覆盖在组织块上,向培养皿内缓慢滴加少量含15%胎牛血清的DMEM培养液。 将培养皿置入CO2培养箱内,在37 ℃、5%CO2、饱和湿度下孵育3 h。 3 h后补加DMEM培养液约3 mL,继续于培养箱内孵育。3 d后第1次换液,以后每3日换液1次。
1.2.2 成纤维细胞传代培养、纯化、冻存、复苏
(1)成纤维细胞传代培养:当从组织块中游出的细胞铺满培养皿底约80%时,进行首次传代,倒去原培养液,用PBS液洗1次弃去,加入0.25%胰蛋白酶1.5 mL消化细胞,待成纤维细胞出现胞质回缩、细胞变成圆球形、细胞间隙增大时倾去胰蛋白酶,加入含15%胎牛血清的DMEM培养液终止消化,用吸管从培养皿底一边开始到另一边结束,按顺序吹打,吹打时动作要轻柔,尽量避免出现泡沫。将脱壁细胞制成细胞悬液,计数,调好细胞密度(0.5×105~1×105cell/mL),将细胞悬液按1∶3接种于3个新的25 mL培养瓶中,并各补加培养液,然后置入37 ℃、5%CO2、饱和湿度条件的培养箱中继续培养,这时所得细胞多数为成纤维细胞,培养皿中没有脱壁的主要是上皮细胞,传至第3代可获得足够数量的人胃成纤维细胞用于实验。
(2)人胃成纤维细胞的冻存:细胞消化后,将单细胞悬液转移至10 mL离心管内,1000 r/min,离心5 min,弃上清,加入4 ℃预冷的冻存液(含15%胎牛血清的DMEM培养液、DMSO比例为9∶1),将细胞重新混悬,分装于1 mL冻存管内密封。先将冻存管置4 ℃冰箱0.5 h,然后移入-20 ℃冰箱2 h,再将冻存管置于-80 ℃冰箱内24 h后放入液氮罐内, -196 ℃长期保存。
(3)人胃成纤维细胞的复苏:复苏时将冻存管从液氮罐内取出,迅速放入37 ℃水浴中复温(1 min),吸出细胞悬液注入离心管并加入5 mL DMEM培养液,混匀后1000 r/min 离心5 min,倾去上清液,加入适量含15%胎牛血清的DMEM培养液重悬细胞,调细胞密度为1×106/mL,接种于培养瓶,置37 ℃、5%CO2培养箱内培养,第2天更换培养液1次,继续培养。
1.2.3 成纤维细胞的鉴定
(1)相差显微镜下进行细胞形态学鉴定;(2)用抗波形蛋白、角蛋白的抗体对传3 代及以上的细胞进行免疫细胞化学染色,完成成纤维细胞标记物鉴定,具体步骤详见免疫组化试剂盒说明书。
1.2.4 RT-PCR法检测人胃成纤维细胞CTGFmRNA表达
根据GenBank数据库,用Primer-3软件设计目的基因PCR扩增引物,由大连宝生物公司合成。CTGF:上游引物:5'- AAGTACCAGTGCACGTGCCTG -3';下游引物:5'- TGTAATGGCAGGCACAGGTC -3',扩增后片段长度为621 bp。β-actin: 上游引物:5'- TCGTCACCAACTGGGACGACATGG -3';下游引物:5'- GATCTTGATCTTCATTGTGCTGGG -3',扩增后片段长度为750 bp。参照TRIzol试剂的说明书提取总RNA,将提取的RNA逆转录为cDNA后作为模板用于PCR,反转录条件为:(1)50 ℃反应50 min; (2)95 ℃ 5 min灭活转录酶;(3) 5 ℃,5 min。应用50 μL PCR扩增体系,以细胞cDNA作为模板用于PCR,循环参数为:94 ℃预变性 5 min, 94 ℃变性 30 s, 55 ℃退火 30 s, 72 ℃延伸 45 s,30个循环,72 ℃ 再延伸10 min。反应结束后,1.5%琼脂糖凝胶电泳对PCR产物进行电泳分析,用美国UVP 凝胶成像系统EC3 System观察并照相记录。
1.2.5 免疫细胞荧光染色法观察人胃成纤维细胞中CTGF蛋白表达
应用CTGF多克隆抗体对传3 代及以上的细胞进行免疫细胞荧光染色,观察人胃成纤维细胞中CTGF蛋白表达情况,具体步骤详见免疫组化试剂盒说明书。
2 结 果
2.1 组织块法原代培养人胃成纤维细胞
组织块贴壁后,经培养5~7 d,少量的成纤维细胞开始从组织块四周游出,随时间推移,游出的成纤维细胞逐渐增多,组织块周围可见大量成纤维细胞包绕,常有成纤维细胞和上皮样细胞混杂生长,成纤维细胞生长旺盛,3~4周后,组织块游出的单层细胞汇合,细胞接近铺满瓶底,可消化传代。细胞纯化、传代、冻存同上(图1)。
2.2 成纤维细胞的鉴定
2.2.1 倒置相差显微镜下观察结果
选第3代生长的人胃成纤维细胞在倒置显微镜下观察,细胞呈长梭形或星形,体积大小不一,胞体狭长、透亮,胞核呈椭圆形,位于细胞中央,胞浆丰富,胞膜清晰,至汇合时,细胞排列密集,细胞界限不清,呈放射状或旋涡状走行,大小基本一致,排列有一定的方向性(图2)。
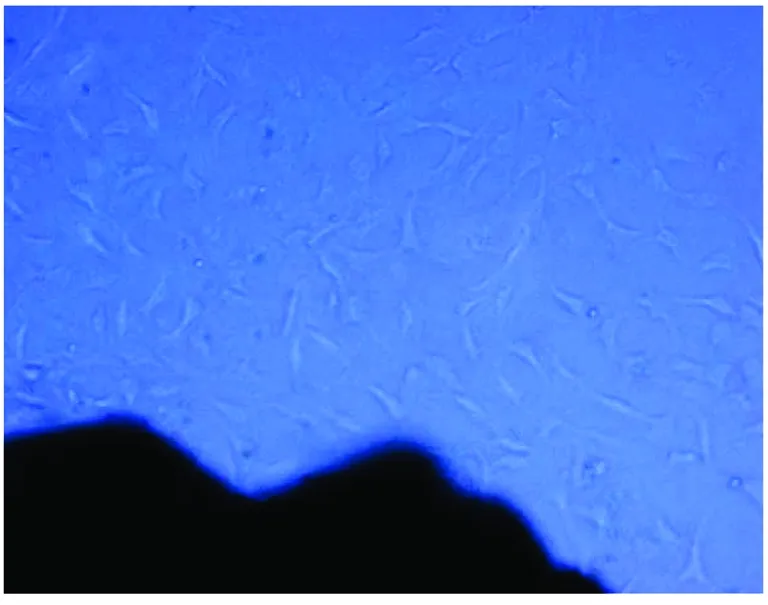
图1 人胃成纤维细胞从组织块周围游出Fig1 The human gastric fibroblasts grow from the tissue explant
2.2.2 免疫细胞化学染色结果
培养细胞经免疫细胞化学染色显示:波形蛋白染色阳性,胞浆内见大量棕黄色颗粒,衬染的核呈蓝色;细胞角蛋白染色阴性,符合培养条件下成纤维细胞的细胞标记特征(图3、4)。

图3 体外培养的人胃成纤维细胞波型蛋白表达阳性(免疫细胞化学染色方法)

图4 体外培养的人胃成纤维细胞角蛋白表达阴性(免疫细胞化学染色方法)
2.3 RT-PCR检测人胃成纤维细胞CTGFmRNA表达情况
从第3代培养细胞中提出的RNA纯度较高,紫外分光计测定所提取的RNA OD260/OD280值为1.8~2.0,PCR反应产物经琼脂糖凝胶电泳分离,紫外透射仪下观察发现每个反应产物有一条特异性条带,与DNA分子量标准相比较,分别为621 bp(CTGF)和750 bp(β-actin),与预想结果一致(图5)。
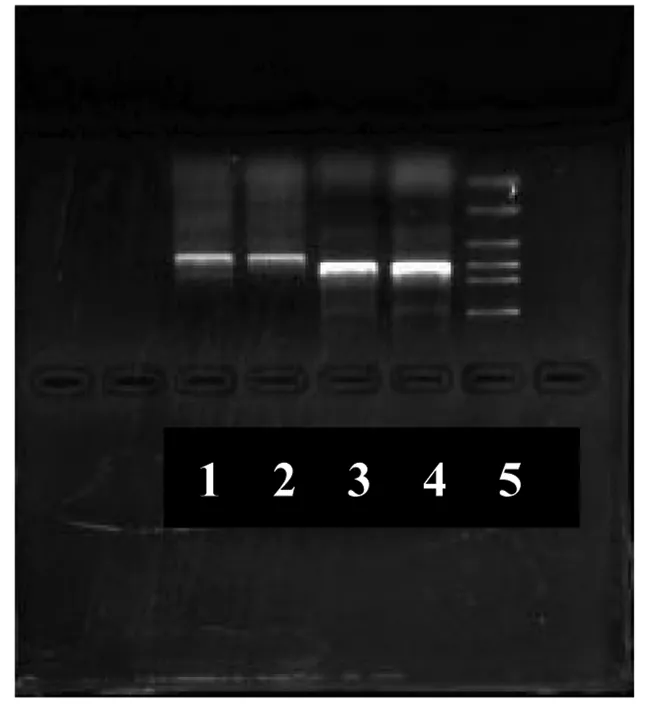
图5 体外培养的人胃成纤维细胞表达CTGFmRNA(1、2为CTGF,3、4为β-actin,5为Marker)
2.4 免疫细胞荧光染色法观察人胃成纤维细胞中CTGF蛋白表达情况
荧光显微镜下培养细胞的细胞质中可见黄绿色荧光,呈现阳性反应,人胃成纤维细胞表达CTGF蛋白(图6)。

图6 体外培养的人胃成纤维细胞表达CTGF蛋白(免疫细胞荧光染色方法)
3 讨 论
原代培养是指细胞自机体分离之后至第1次传代之前的细胞培养阶段,可分为3个步骤:(1)分离组织;(2)解离组织块;(3)接种于培养器皿中培养。自组织分离之后,原代细胞培养可分为两种:一种是将组织块用机械法或酶消化法处理,此方法可以很快得到大量活细胞,细胞也可在短时间内生长成片,原代细胞产量高。酶消化法的缺点是消化酶损伤细胞,因此消化酶浓度、处理温度和处理时间非常重要,同时消化酶的活力变异很大,细胞消化程度的判断很大程度上取决于个人的经验,掌握起来很困难,无法形成一个明确的操作规范。另一种是将组织块贴附于适宜的基质上,细胞自组织块向外迁移生长。此方法虽然获取细胞所需周期长,不是每个组织块都能长出细胞,不能在短时间内获取大量细胞,但其在很大程度上保持了原有组织结构,有利于细胞适应体外培养环境。组织块法简单、实用,只要实验方法正确,持之以恒,必定成功。
本实验选择组织块法分离培养人胃成纤维细胞,较经典组织块法改进了1处:切取标本后先以生理盐水冲洗去血,再以0.1%洗必泰浸洗消毒杀菌。本实验开始时细胞污染率居高不下,反复思索后方明白其中缘由,正常人胃黏膜表面存在多种细菌,如不处理,离体培养人胃成纤维细胞污染率必定很高,所以实验过程中加0.1%洗必泰浸洗,再以生理盐水冲洗去洗必泰,大大降低了细胞污染率。无菌操作是原代细胞培养的关键,一切操作应同手术操作一样,严格要求无菌处理。
在原代细胞早期培养阶段,经常见到成纤维细胞和上皮细胞混杂生长,根据这两种细胞对胰蛋白酶耐受性不同,成纤维细胞对酶性分离敏感,胰酶消化时成纤维细胞先脱壁,而上皮样细胞需要消化较长时间才能够脱壁,而且接种后成纤维细胞贴壁展开也较快,而上皮细胞在短时间内不能贴附或贴附不牢,这样根据这一特征采用差别消化及反复贴壁的办法,去除上皮细胞和其它细胞,可获取纯化的成纤维细胞。本实验采用3~6代处于对数生长期的人胃成纤维细胞。
成纤维细胞是结缔组织中最主要的细胞类型,其基本功能是合成和分泌各型胶原蛋白,从而形成胶原纤维,成纤维细胞也能分泌弹性蛋白等其它细胞外基质成分。成纤维细胞中间丝的结构蛋白为波形蛋白,不同于上皮细胞的角蛋白,成为不同种类细胞分类鉴定的相对特异性标志。本实验的免疫细胞化学染色结果显示,培养的细胞表达波形蛋白,不表达角蛋白,这说明本实验培养的细胞为人胃成纤维细胞。
本研究在体外成功地进行了人胃成纤维细胞的分离、培养和传代,并从形态学、免疫细胞化学等方面对细胞进行了鉴定,为后续的研究提供了稳定的细胞模型。
在本实验中,用RT-PCR和免疫荧光染色方法检测了体外培养的处于指数增生期的人胃成纤维细胞中CTGFmRNA和蛋白的表达情况,发现人胃成纤维细胞自身能合成、分泌CTGF,是胃癌组织中CTGF的来源之一。自分泌是生长因子的一种重要的分泌方式,自分泌细胞在产生生长因子的同时,产生了该生长因子的受体,从而作用于自身细胞,成纤维细胞可自分泌转化生长因子β1(TGF-β1)、表皮生长因子(EGF)、成纤维细胞生长因子(FGF)等[1-2]。其中TGF-β1自分泌广泛存在于各种成纤维细胞,与成纤维细胞增殖、分化以及组织器官纤维化的发生、发展密切相关[3-5]。研究发现在CTGF基因启动子序列-162 bp和-128 bp之间存在着TGFβ应答元件TβRE/BCE-1,不存在于CCN家族其它成员或TGFβ诱导的其它基因启动子中,提示TGFβ诱导CTGF表达具有特异性,其在CTGF基础表达的调节中起重要作用[6-7]。TGFβ主要通过SMAD3/SMAD4依赖途径,蛋白激酶C(PKC)和Ras/MEK/ERK信号传导途径诱导CTGF表达[8-10]。因此,可推测人胃成纤维细胞自身分泌的TGF-β诱导了CTGF的表达。
本实验结果表明活化增生的人胃成纤维细胞能合成CTGF,通过自分泌、旁分泌途径作用于自身,为进一步研究CTGF与人胃成纤维细胞的关系提供了实验基础。
[1] Nowinski D, Koskela A, Kiwanuka E,et al. Inhibition of connective tissue growth factor/CCN2 expression in human dermal fibroblasts by interleukin-1alpha and beta[J]. J Cell Biochem, 2010,110(5):1226-1233.
[2] Mohammad Syaiful Bahari Abdull Rasad, Ahmad Sukari Halim, Kamaruddin Hashim,et al. In vitro evaluation of novel chitosan derivatives sheet and paste cytocompatibility on human dermal fibroblasts [J]. Carbohydrate Polymers,2010,79 (4): 1094-1100.
[3] Gurtner GC, Werner S, Barrandon Y,et al. Wound repair and regeneration [J]. Nature, 2008,453(7193):314-321.
[4] Strzalka-Mrozik B, Stanik-Walentek A, Kapral M,et al. Differential expression of transforming growth factor-beta isoforms in bullous keratopathy corneas [J]. Mol Vis, 2010, 16:161-166.
[5] Strzalka B, Dorecká M, Stanik-Walentek A,et al. Quantitative analysis of transforming growth factor beta isoforms mRNA in the human corneal epithelium [J]. Folia Biol (Praha), 2008,54(2):46-52.
[6] Grotendorst GR, Okochi H, Hayashi N. A novel transforming growth factor beta response element controls the expression of the connective tissue growth factor gene[J]. Cell Growth Differ, 1996,7(4):469-480.
[7] Leask A, Parapuram SK, Shi-Wen X,et al. Connective tissue growth factor (CTGF, CCN2) gene regulation: a potent clinical bio-marker of fibroproliferative disease? [J]. J Cell Commun Signal, 2009, 3(2):89-94.
[8] Chen CC, Lau LF. Functions and mechanisms of action of CCN matricellular proteins [J]. Int J Biochem Cell Biol, 2009, 41(4):771-783.
[9] Moustakas A, Heldin CH. The regulation of TGFbeta signal transduction [J]. Development, 2009,136(22):3699-3714.
[10] Cicha I, Goppelt-Struebe M. Connective tissue growth factor: context-dependent functions and mechanisms of regulation [J]. Biofactors, 2009,35(2):200-208.
