Rad18缺失对雄小鼠生殖细胞的影响
2012-01-17孙婧华刘立峰
孙婧华,刘立峰
(1.大连医科大学 附属第二医院 肿瘤内科, 辽宁 大连 116027;2.大连医科大学 附属第一医院 妇产科,辽宁 大连 116011)
紫外照射、生殖毒素能引起多种DNA损伤。DNA损伤后在复制期引起复制叉不稳定从而导致细胞死亡。复制后修复(postreplication repair, PRR)能不去除损伤模板而恢复DNA复制。该种修复在多种物种中可见,主要包括以下3个过程:损伤DNA合成 (TLS)、重组和模板转换[1]。
芽殖酵母(Saccharomyces cerevisiae)中,Rad6 epistasis家族参与复制后修复过程。其中编码泛素结合酶E2和泛素连接酶E3的Rad6和18在PRR中起关键作用[2]。Stelter[3]指出Rad6/Rad18决定复制后修复PCNA泛素化。目前,人的细胞中已鉴定出一个Rad18同源物(hRad18)[4]和两个Rad6同源物(HHR6A和HHR6B)[5]。hRad18和mRad18在PRR通过PCNA单或多泛素化而维持基因信息稳定[4,6]。小鼠中,mRAD18在胚胎干细胞(mouse embryonic stem cells, mESCs)和成年小鼠睾丸粗线期精母细胞中高表达[6-7],定位于XY体[7-8]。Roest等[9]报道mRad6B敲除雄小鼠在减数分裂后染色体重塑过程受损而不育,认为mRad18对精子发生起重要作用。本文利用Rad18-/-小鼠模型研究Rad18缺失对雄小鼠生殖细胞的影响。
1 材料和方法
1.1 材 料
动物:C57BL/6J 野生小鼠(wild-type,WT)和Rad18-/-雄小鼠,来源于日本熊本大学动物实验中心。1、6周龄WT雄小鼠各3只, 2、6、12月龄的WT和Rad18-/-雄小鼠各5只。
抗体和试剂:生殖细胞特异标记物TRA98一抗购自Bioacademia公司;二抗VECTASTAIN试剂盒购自Vector Laboratories公司。Rad18一抗来源于日本熊本大学组织制御实验室;二抗购自Jackson ImmunoResearch公司。TSA plus 生物素体系信号放大NEL700购自Perkin-Elmer公司,DAB显色检测购自Roche公司。
1.2 实验方法
1.2.1 生精小管及附睾中生殖细胞的检测:取2、6、12月龄WT和Rad18-/-雄小鼠各5只,取睾丸和附睾,于Bouin’s 固定液室温固定4 h,经梯度酒精脱水,二甲苯透明,浸蜡,石蜡包埋。切片:厚度为4 μm。采用常用步骤行TRA98免疫组织化学检测。TRA98阳性(棕色)为精原细胞,精母细胞,圆形精细胞,阴性(蓝色)为延长的精细胞和体细胞。
1.2.2 退化睾丸生精小管分类:根据退化管中TRA98标记的不同种类生殖细胞存在情况,将生精小管分为5类。0: 仅存在Sertoli细胞或同时存在拉长的精细胞;I: 存在Sertoli细胞和精细胞(包括圆形和拉长),II: 存在Sertoli细胞、精母细胞和精细胞;III: 存在Sertoli细胞、精原细胞和精母细胞;IV:正常结构。分别计数分布情况并制图。
1.2.3 生殖细胞中Rad18表达的检测:取1、6周龄各3只WT雄小鼠睾丸,于4%多聚甲醛中4 ℃固定过夜。甲基丙烯酸甲酯包埋,切片:厚度为5 μm。采用常用步骤行Rad18免疫组织化学检测。
1.2.4 原位杂交:组织切片同Rad18检测切片,利用mRad18 cDNA 的OFR区上的471碱基cDNA片段制成Rad18反义和正义探针。原位杂交采用Tadokoro的方法[10]。
1.3 统计学方法

2 结 果
2.1 Rad18-/-雄小鼠生殖细胞检测
Rad18-/-小鼠睾丸组织切片HE染色发现Rad18-/-雄小鼠随年龄增加,睾丸组织中生精小管退化。应用生殖细胞特异标记物TRA98检测退化生精小管中生殖细胞表达,结果见图1。与WT小鼠睾丸类似,12月龄Rad18-/-雄小鼠睾丸表面正常生精小管中含有精子生成过程中的生殖系细胞:精原细胞、精母细胞、圆形和拉长的精细胞以及精子。相反,同一睾丸的退化小管中,TRA98阳性生殖系细胞分布异常。
2.2 Rad18-/-雄小鼠随年龄增长精原细胞的变化
2、6、12月龄WT小鼠睾丸组织中正常生精小管(第IV类)比例无明显变化(图2A),分别为97.00%、97.54%和96.82%;但2、6、12月龄Rad18-/-小鼠睾丸组织中正常生精小管比例明显下降(图2B),分别为99.42%、83.79%和58.54%,两组相比差异有显著性意义(P<0.05);同时,Rad18-/-小鼠睾丸组织中第0、I 和II类异常生精小管比例均随着年龄增长而逐渐增高,2、6、12月龄时,这3类异常结构比例总和为:0.58%、15.08%和39.50%(图2B),而2、6、12月龄WT小鼠中总和分别为0.70%、1.99%和2.76%(图2A),这3类异常结构的共同特点即缺乏含有精原干细胞的精原细胞,12月龄Rad18-/-雄小鼠39.50%的生精小管中缺失早期精原细胞,与WT小鼠的2.76%比较差异有显著性意义(P<0.05);WT和Rad18-/-小鼠中第III类异常小管比例均无显著变化(图2)。
2.3 12月龄Rad18-/-雄小鼠精子形态
虽然12月龄Rad18-/-雄小鼠39.5%的生精小管中缺失早期精原细胞,但在附睾中的精子形态与WT相比未见异常,未见TRA98阳性未完成分化的生殖细胞提前释放,见图3。图1C-F中可见形态正常的Sertoli细胞。
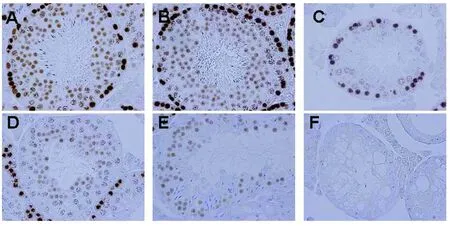
图1 12月龄Rad18-/-小鼠睾丸中生殖细胞特异性标记TRA98的表达 ×400Fig 1 Expression of germ line cell-specific marker TRA98 in 12-month-old Rad18-/- testes ×400A:12月龄WT小鼠生精小管;B:12月龄Rad18-/小鼠正常生精小管;C-F:12月龄Rad18-/-小鼠退化生精小管

图2 根据生殖细胞存在情况小鼠生精小管分类及分布Fig 2 Distribution of the seminiferous tubules showing each category of germline cellsA:WT小鼠 B:Rad18-/-小鼠

图3 Rad18-/-小鼠附睾中未见TRA98阳性生殖细胞 ×400Fig 3 The spermatozoa in the epididymis of 12-month-old Rad18-/- mice displayed normal morphology ×400 A:WT小鼠 B:Rad18-/-小鼠
2.4 Rad18在野生雄小鼠精原细胞中的表达
在6周龄WT雄小鼠生精小管中,Rad18蛋白在精母细胞中表达,尤其定位在XY体上。Rad18蛋白在精原细胞细胞核中表达。原位杂交显示Rad18 mRNA在精原细胞和精母细胞都表达。1周龄WT小鼠精原细胞处于未分化精原细胞增殖激活状态,免疫组化结果显示1周龄WT小鼠睾丸中的精原细胞核中表达Rad18蛋白,见图4。
3 讨 论
多项研究表明,RAD18不但参与了PRR[11],而且参与了DNA损伤诱导基因的转录调节[12]、DNA损伤信号的传导[13],也参与了DNA单链断裂和断裂的修复[14-17]。Miyase等[18]报道Rad18-/-小鼠细胞中有明显的复制后修复缺陷。Rad18敲除的mESCs对多种遗传毒素试剂敏感,异常重组频率提高,说明RAD18对维持细胞基因组稳定起重要的作用[7]。作者已经建立了Rad18-/-小鼠模型,该小鼠出生、成长正常,但随年龄增加雄小鼠生育力下降,睾丸重量减轻,生精小管退化、生殖细胞丢失,并且研究表明这种退化不是因激素变化而引起。
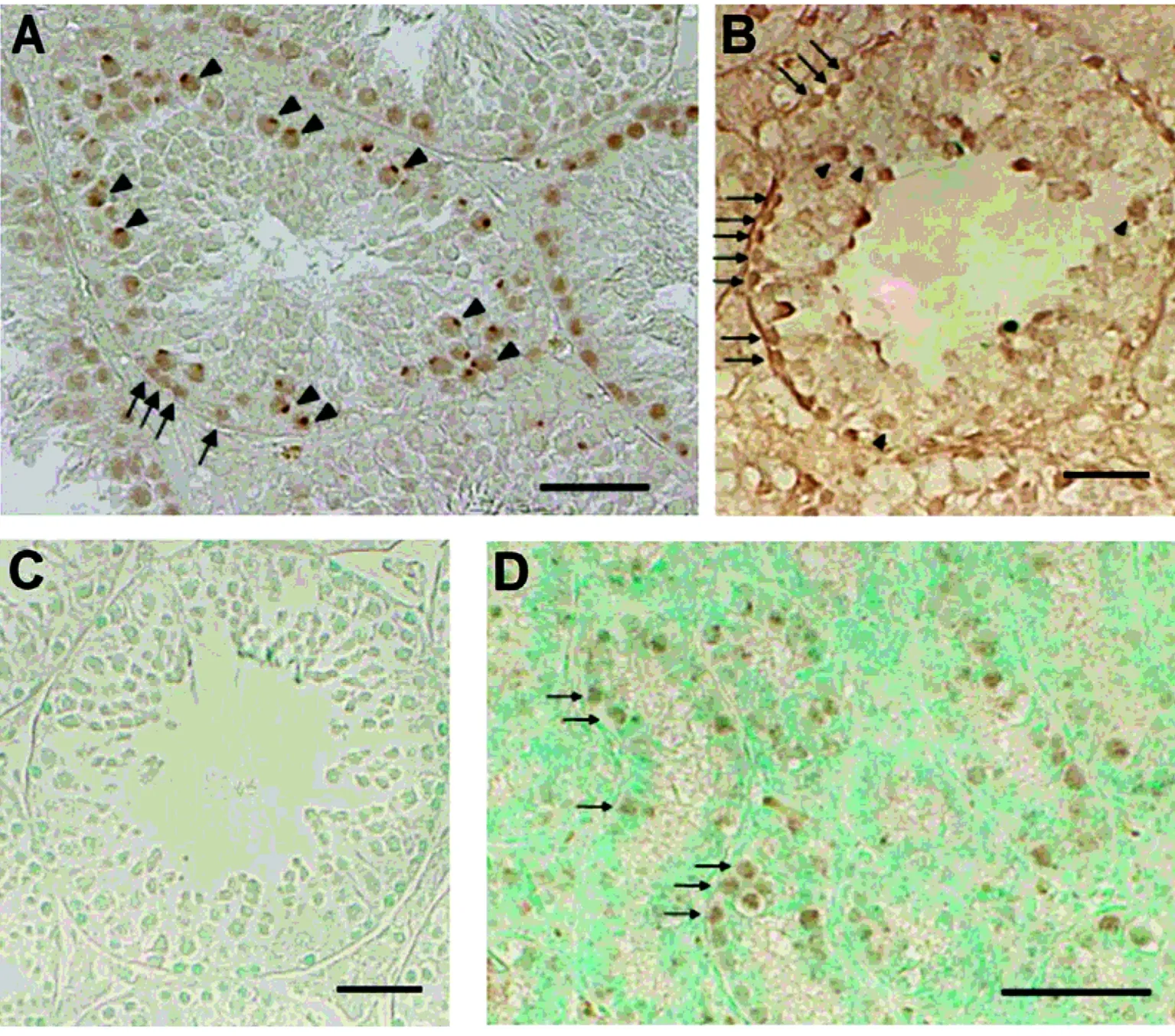
图4 Rad18蛋白和mRNA在WT小鼠睾丸中的表达Fig 4 The expression of Rad18 in WT mice
本研究应用免疫组织化学方法检测生殖细胞特异标记物TRA98在2、6、12月龄Rad18-/-雄小鼠生精小管生殖细胞中的表达和分布,发现伴随着正常生精小管比例的下降,缺乏精原细胞的退化小管比例增加,12月龄时已达39.50%,与同龄WT小鼠2.76%相比差异有显著意义,与此同时,退化小管中仍可见处于不同分化阶段的生殖细胞:精母细胞、圆形和拉长的精细胞以及精子,并且Sertoli细胞形态正常,附睾中未见异常生殖细胞,提示已分化的生殖细胞可完成精子形成,精原细胞的耗尽导致Rad18-/-雄小鼠生育力下降。
精原细胞中存在精原干细胞,精原干细胞整倍性维持对遗传信息传递起关键作用。研究已表明,多种DNA损伤修复机制参与了干细胞的维持,包括非同源末端连接(NHEJ)和核苷酸切除修复(NER)[19-20]。DNA连接酶IV 介导的NHEJ 完成DNA双链断裂修复。随年龄增加,DNA连接酶IV次形态突变(Lig4Y288C)引起小鼠造血干细胞和骨髓细胞逐渐丢失,严重影响了组织培养和移植中干细胞功能[23]。运动失调性毛细血管扩张症(Atm)突变基因通过激活DNA修复中细胞周期关键蛋白维持基因组稳定。Atm突变小鼠24周出现因造血干细胞缺陷而导致的骨髓缺陷[21]。Takubo等[22]发现Atm-null小鼠睾丸中逐渐失去减数分裂前生殖细胞。因此,DNA修复机制对于维持干细胞整倍性和遗传信息传递起关键作用。
尽管Rad18蛋白在成年睾丸精母细胞中高表达,但是本研究检测到Rad18转录水平在精原细胞而非精母细胞高表达。此外,1周龄WT小鼠睾丸中未分化精原细胞表达Rad18蛋白,说明Rad18在增殖的未分化精原细胞具有活性。在Rad18-/-小鼠睾丸中,由于Rad18功能丧失,DNA损伤加剧,随着年龄增加内源性DNA损伤或基因组重排可能加速精原细胞增殖,导致长期细胞周期阻滞,精原干细胞耗尽。
本研究结果提示,Rad18参与维持DNA复制中基因组DNA整倍性,对精原干细胞维持起重要作用。
[1] Broomfield S, Hryciw T, Xiao W. DNA postreplication repair and mutagenesis in Saccharomyces cerevisiae [J]. Mutat Res, 2001,486(3):167-184.
[2] Bailly V, Prakash S, Prakash L.Domains required for dimerization of yeast Rad6 ubiquitin-conjugating enzyme and Rad18 DNA binding protein [J].Mol Cell Biol, 1997, 17(8): 4536-4543.
[3] Stelter P, Ulrich HD. Control of spontaneous and damage induced mutagenesis by SUMO and ubiquitin conjugation [J].Nature, 2003, 425(6954):188-191.
[4] Tateishi S, Sakuraba Y, Masuyama S, et al.Dysfunction of human Rad18 results in defective postreplication repair and hypersensitivity to multiple mutagens [J].Proc Natl Acad Sci USA, 2000, 97(14): 7927-7932.
[5] Koken MH, Reynolds P, Jaspers-Dekker I,et al. Structural and functional conservation of two human homologs of the yeast DNA repair gene RAD6 [J]. Proc Natl Acad Sci USA, 1991,88(20): 8865-8869.
[6] Van der Laan R, Roest HP, Hoogerbrugge JW, et al. Characterization of mRAD18Sc, a mouse homolog of the yeast postreplication repair gene RAD18 [J]. Genomics, 2000, 69(1): 86-94.
[7] Masuyama S, Tateishi S, Yomogida K, et al. Regulated expression and dynamic changes in subnuclear localization of mammalian Rad18 under normal and genotoxic conditions [J]. Genes Cells, 2005, 10(8):753-762.
[8] Van der Laan R, Uringa EJ, Wassenaar E, et al. Ubiquitin ligase Rad18Sc localizes to the XY body and to other chromosomal regions that are unpaired and transcriptionally silenced during male meiotic prophase [J]. J Cell Sci, 2004,117(Pt21):5023-5033.
[9] Roest HP, van Klaveren J, deWit J, et al. Inactivation of the HR6B ubiquitin-conjugating DNA repair enzyme in mice causes male sterility associated with chromatin modification [J]. Cell, 1996, 86(5): 799-810.
[10] Yomogida K, Yagura Y, Tadokoro Y, et al. Dramatic expansion of germinal stem cells by ectopically expressed human glial cell line-derived neurotrophic factor in mouse Sertoli cells [J]. Biol Reprod. 2003, 69(4):1303-1307.
[11] Tsuji Y, Watanabe K, Araki K, et al. Recognition of forked and single-stranded DNA structures by human RAD18 complexed with RAD6B protein triggers its recruitment to stalled replication forks [J]. Genes Cells, 2008,133(4):343-354.
[12] Fu Y, Zhu Y, Zhang K, et al. Rad6-Rad18 Mediates a eukaryotic SOS response by ubiquitinating the 9-1-1 checkpoint clamp [J]. Cell, 2008, 133(4):601-611.
[13] Huang J, Huen MSY, Kim H, et al. RAD18 transmits DNA damage signaling to elicit homologous recombination repair [J]. Nat Cell Biol, 2009,11(5):592-603.
[14] Shiomi N, Mori M, Tsuji H, et al. Human RAD18 is involved in S phase-specific single-strand break repair without PCNA monoubiquitination[J].Nucleic Acids Res,2007, 35(2):1-12.
[15] Watanabe K, Iwabuchi K, Sun J, et al. RAD18 promotes DNA double-strand break repair during G1 phase through chromatin retention of 53BP1 [J].Nucleic Acids Res, 2009, 37(7):2176-2193.
[16] Ting L, Jun H, Junjie C. RAD18 lives a double life: Its implication in DNA double-strand break repair[J]. DNA Repair, 2010, 9(12):1241-1248.
[17] Liu T, Chen H, Kim H, et al. RAD18-BRCTx interaction is required for efficient repair of UV-induced DNA damage [J]. DNA Repair,2012,11(2):131-138.
[18] Miyase S, Tateishi S, Watanabe K, et al. Differential regulation of Rad18 through Rad6-dependent mono- and polyubiquitination [J]. J Biol Chem,2005,280(1): 515-524.
[19] Nijnik A, Woodbine L, Marchetti C, et al. DNA repair is limiting for haematopoietic stem cells during ageing [J]. Nature, 2007,447(7145):686-690.
[20] Rossi DJ, Bryder D, Seita J, et al. Deficiencies in DNA damage repair limit the function of haematopoietic stem cells with age [J]. Nature, 2007, 447(7145):725-729.
[21] Ito K, Hirao A, Arai F, et al. Regulation of oxidative stress by ATM is required for self-renewal of haematopoietic stem cells [J]. Nature, 2004, 431(7011):997-1002.
[22] Takubo K, Hirao A, Ohmura M, et al. Premeiotic germ cell defect in seminiferous tubules of Atm-null testis [J].Biochem Biophys Res Commun,2006,351(4):993-998.
