Gefitinib获得性耐药产生时非小细胞肺癌上皮性标志EGFR及E-cadherin表达的变化
2012-01-17赵宝霞田丽敏吕海辰
赵宝霞,田丽敏,窦 薇,吕海辰,李 梅,吕 申
(1. 大连医科大学 附属第二医院 实验中心,辽宁 大连 116027; 2. 大连医科大学 检验医学院, 辽宁 大连 116044; 3. 复旦大学上海医学院 临床医学(8年制),上海 200032)
肺癌的发病率和死亡率均居各种癌症之首。非小细胞肺癌(Non-small cell lung cancer, NSCLC)占肺癌的80%以上,目前手术切除是对其治疗最有效的方法。然而,多数患者在肿瘤发现时已处于临床晚期,失去了手术时机,另外即使接受了外科治疗的患者也常需要化疗辅助。因此,化疗仍是目前临床治疗NSCLC应用最广的手段。然而,传统化疗药物因其特异性差、毒副作用大在临床应用中受到很大的限制。近年来,以表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)为靶点的肿瘤分子靶向治疗在晚期NSCLC应用中疗效显著,其中应用最广的药物是gefitinib和erlotinib。研究表明对EGFR-TKI敏感的NSCLC常有EGFR18、19、21位外显子突变,而这些突变多见于亚裔、女性、非吸烟患者的腺癌。值得注意的是,随着EGFR-TKI临床应用的拓展和时间的推延,一些原本对该药敏感的NSCLC会产生获得性耐药,而获得性耐药是用该药治疗失败的主要原因。探讨NSCLC中 EGFR-TKI获得性耐药的发生机制已成为该药临床应用中亟待解决的问题。
文献报道,有EGFR突变的NSCLC常会高表达EGFR和E-cadherin,多数高表达EGFR和E-cadherin的NSCLC对EGFR-TKI敏感[1-2]。那么,当NSCLC患者对EGFR-TKI产生耐药性时其携带的肿瘤是否会有EGFR和E-cadherin蛋白表达的变化?本研究采用逐步递增药物浓度、间歇作用体外诱导法诱导人肺癌细胞株NCI-H1975,建立了gefitinib获得性耐药细胞株——人肺癌细胞株NCI-H1975/GR,比较获得性耐药细胞株与亲本株细胞的EGFR及E-cadherin蛋白表达变化,希望能为探讨NSCLC的EGFR-TKI获得性耐药产生机制提供数据。
1 材料和方法
1.1 实验材料
细胞株:人肺腺癌细胞株NCI-H1975,购自中国医学科学院基础研究所,国家中医药管理局大连医科大学附属第二医院分子生物学实验室保存。
主要试剂:gefitinib(Selleck公司,美国)、鼠抗人 EGFR单克隆抗体(克隆号111.6, NeoMarkers,美国)及鼠抗人E-cadherin单克隆抗体(北京中杉金桥生物技术公司,中国)。
1.2 实验方法
1.2.1 人肺癌细胞株NCI-H1975的培养:用RPMI-1640完全培养基(含10%胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素),在37 ℃、5%CO2、饱和湿度条件下培养细胞株NCI-H1975,每隔3~4 d消化、传代1次。培养细胞呈单层贴壁生长。
1.2.2 Gefitinib获得性耐药细胞株NCI-H1975/GR的建立:采用逐步递增gefitinib浓度、间歇作用体外诱导法诱导NCI-H1975细胞耐药。Gefitinib以起始浓度12 μmol/L作用于对数生长期的细胞,24 h后弃去含药培养基,加入新鲜培养基,继续培养,待其恢复正常生长,消化传代后复用相同浓度的gefitinib作用24 h,如此每一浓度反复两次,药物浓度递增,反复换液传代,历时6个月获得了能够在含gefitinib浓度80 μmol/L培养基中良好生长的耐药细胞株(命名为NCI-H1975/gefitinib resistance,简写为NCI-H1975/GR)。
1.2.3 形态学观察:倒置显微镜下直接观察存活状态的NCI-H1975与NCI-H1975/GR的细胞形态,特别是加入gefitinib后二者的细胞状态变化。
1.2.4 生长曲线测定:将浓度为1×104/mL 的NCI-H1975和NCI-H1975/GR的细胞悬液接种于24孔板中,每孔1.5 mL。每24 h计数其中3孔的细胞数,取平均值,连续7 d。以时间天数为横坐标,以每天的细胞数为纵坐标,绘制生长曲线。 按照公式 T=tlg2/lgNt-lgN0计算细胞的倍增时间(其中T为群体倍增时间,t为连续培养时间,Nt为终末细胞数,N0为初始细胞数,单位为小时)。
1.2.5 NCI-H1975及NCI-H1975/GR细胞的EGFR及E-cadherin蛋白表达检测:细胞爬片生长后,用冷丙酮固定细胞15 min,采用SP法进行免疫细胞化学染色,DAB法显色,苏木素复染,封片。用PBS代替一抗作阴性对照。
1.2.6 判断标准:(1)EGFR蛋白表达的判断标准:以细胞膜或细胞浆出现棕黄色颗粒者为阳性表达,分别记录表达部位,其表达强弱与亲本细胞株的相应表达部位比较。(2)E-cadherin蛋白表达的判断标准:以细胞膜出现棕黄色颗粒为阳性表达,其表达强弱与亲本细胞的细胞膜表达比较。
1.3 统计学方法
采用SPSS19.0软件对数据进行整理,t检验进行统计分析,P<0.05为差异有统计学意义。
2 结 果
2.1 形态学变化
光镜下NCI-H1975细胞呈上皮样单层排列生长,细胞大小不一,长梭形,细胞边界清楚,核大,圆形或椭圆形(图1A);gefitinib加入24 h后,细胞边界不清,有的变成圆形,胞核内可见粗颗粒(图1B),撤药后1周左右细胞基本恢复到未加gefitinib前生长状态;gefitinib加入后与NCI-H1975细胞相比,NCI-H1975/GR细胞体积略小,多数为长梭形,有的为圆形或纺锤形(图1C)。
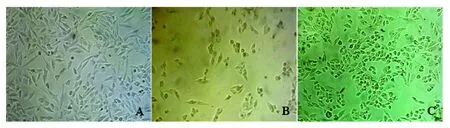
图1 gefitinib诱导人肺腺癌NCI-H1975细胞耐药过程中细胞形态的变化(10×10)
2.2 生长曲线
NCI-H1975和NCI-H1975/GR两者的群体倍增时间分别为28.65 h和35.79 h,耐药细胞生长时间较亲本细胞延长7.14 h (P<0.05)。生长曲线见图2。
2.3 NCI-H1975及NCI-H1975/GR细胞的EGFR及E-cadherin蛋白表达
(1)EGFR蛋白的表达:该蛋白在NCI-H1975与NCI-H1975/GR细胞的细胞膜和细胞浆均呈阳性表达,在两细胞株细胞膜的表达强度相近,但在细胞浆的表达耐药株NCI-H1975/GR明显强于亲本株NCI-H1975(图3)。
(2)E-cadherin蛋白的表达:在NCI-H1975与NCI-H1975/GR细胞均呈阳性表达,但二者的表达部位不同,在NCI-H1975细胞主要表达于细胞膜,而在NCI-H1975/GR细胞则主要表达于细胞浆,在细胞膜的表达明显减弱(图4)。

图2 人肺癌NCI-H1975与NCI-H1975/GR细胞的生长曲线
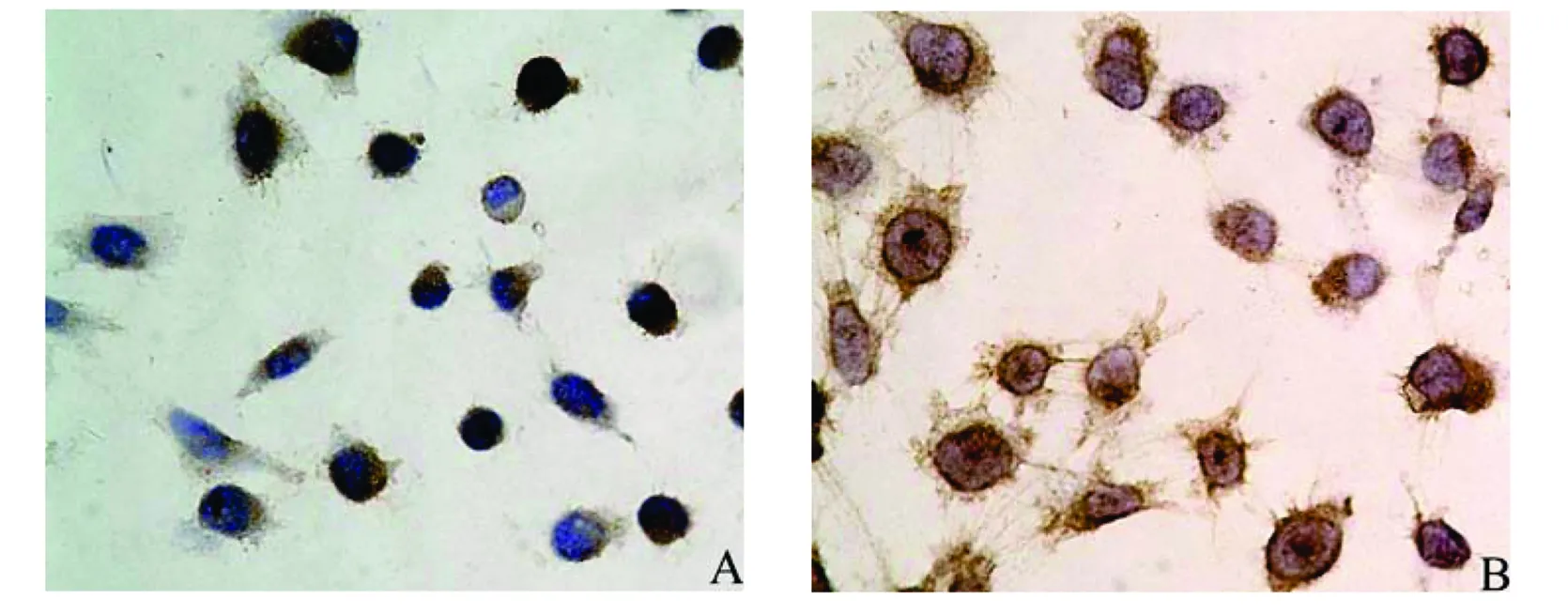
图3 EGFR蛋白在人肺腺癌NCI-H1975与NCI-H1975/GR细胞中的表达(10×40)Fig 3 The protein expressions of EGFR in human lung adenocarcinoma cell lines NCI-H1975 and NCI-H1975/GR (10×40)A:NCI-H1975细胞;B:NCI-H1975/GR细胞
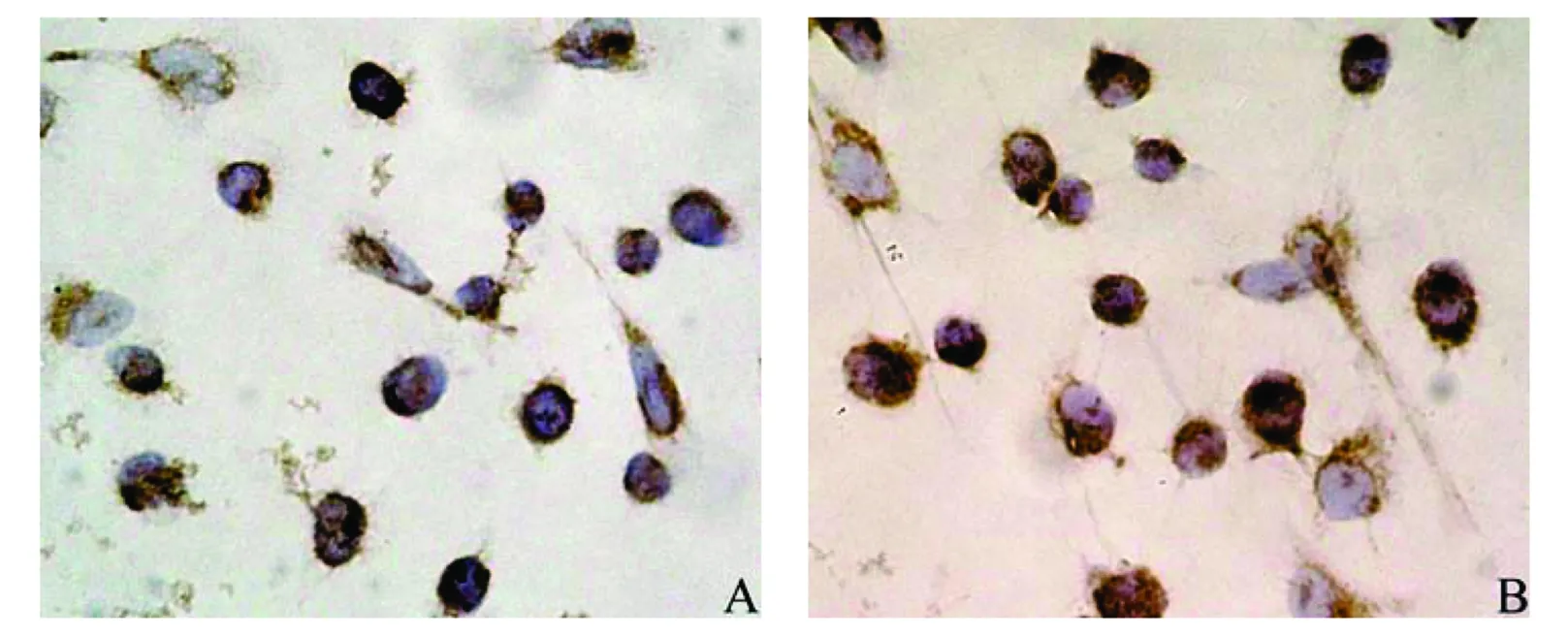
图4 E-cadherin蛋白在人肺腺癌NCI-H1975与NCI-H1975/GR细胞中的表达(10×40)Fig 4 The protein expressions of E-cadherin in human lung adenocarcinoma cell lines NCI-H1975 and NCI-H1975/GR (10×40)A:NCI-H1975细胞;B:NCI-H1975/GR细胞
3 讨 论
目前,EGFR-TKI的耐药机制主要涉及以下几个方面:(1)靶基因或靶蛋白的改变,如EGFR 20外显子继发突变,引起EGFR的构象改变,使EGFR-TKI失去了作用靶点[3-4];(2)癌基因的扩增,如MET基因扩增激活另一信号传导途径ErbB3-PI3K[5-6];(3)下游信号分子的自身活化,如K-RAS和(或)B-RAF基因外显子突变,引起信号传导通路下游分子的自身活化或敏感性增强[7];(4)癌组织通过上皮-间质转化,失去上皮组织特性,使药物失去作用靶点[8]。要研究这些机制,体外EGFR-TKI获得性耐药模型必不可少。在本研究中建立的EGFR-TKI获得性耐药细胞株NCI-H1975/GR能在含80 μmol/L的gefitinib培养基中良好生长;与NCI-H1975相比药物作用后的形态变化不一样,群体倍增时间也明显延长,即生长减慢。检测结果表明NCI-H1975/GR细胞株已为gefitinib获得性耐药细胞株,可以用于该药的耐药机制研究。
EGFR是一种具有酪氨酸激酶活性的跨膜糖蛋白,是生长因子受体家族成员之一,在结构上包括3个主要功能区:胞外配体结合区、疏水跨膜区和胞质酪氨酸激酶区。当EGFR与它的配体如EGF结合后,促进受体内的酪氨酸激酶激活,导致受体酪氨酸残基自身磷酸化,形成二聚体,从而激活信号传导通路,引起细胞的增殖和分化[9-10]。EGFR主要表达于正常上皮细胞表面,在包括NSCLC在内的一些上皮源性肿瘤细胞常过表达。作为EGRF-TKI的作用靶蛋白,EGFR表达水平常与EGFR-TKI的治疗效果密切相关。在本研究中,该蛋白在NCI-H1975与NCI-H1975/GR细胞的细胞膜和细胞浆均呈阳性表达,在两细胞株细胞膜的表达强度相近,但在细胞浆的表达耐药株NCI-H1975/GR强于亲本株NCI-H1975。这提示gefitinib获得性耐药细胞的细胞浆有较多的EGFR蛋白表达。这可能是由于EGFR-TKI阻断了EGFR的活化,信号不能传导到其下游途径,使细胞生长速度减慢。此时,细胞需不断合成EGFR蛋白以促进细胞生长,但由于细胞膜上原已存在EGFR,新合成的EGFR不能到达细胞膜行使功能,只能在细胞浆大量堆积。是否细胞浆EGFR表达增高可作为EGFR-TKI获得性耐药的标志,有待在临床研究中证实。
E-cadherin 是一类主要介导细胞之间相互粘附的钙依赖性跨膜蛋白,主要表达在上皮细胞,广泛参与细胞间的连接。E-cadherin正常表达对上皮细胞的分化起着重要作用;其异常表达被认为与上皮-间质转化产生直接相关。据报道,用gefitinib诱导人肺腺癌细胞株A549或用erlotinib诱导人肺腺癌细胞HCC4006产生获得性耐药,耐药细胞都发生了上皮-间质转化,即E-cadherin表达的下降[11-12]。在本研究中, E-cadherin在NCI-H1975与NCI-H1975/GR细胞均呈阳性表达,但二者的表达部位不同,在NCI-H1975细胞主要表达于细胞膜,而在NCI-H1975/GR细胞则主要表达于细胞浆,在细胞膜的表达明显减弱。这提示在细胞发生gefitinib获得性耐药后E-cadherin在它的功能部位,细胞膜的表达降低,即此时这些细胞上皮分化减弱,失去部分上皮组织特性,但这些细胞是否、何时会出现间质标记蛋白的表达,即发生间质转化还需要进一步研究。
总之,EGFR作为EGFR-TKI的靶蛋白,E-cadherin作为维持细胞上皮分化的蛋白均在NSCLC细胞中高表达,可作为NSCLC上皮分化的标志蛋白。这两种蛋白因功能的不同,在gefitinib获得性耐药产生过程中它们表达的变化也不同;在获得性耐药细胞株中,EGFR在细胞浆的表达明显增高;E-cadherin在细胞膜的表达明显降低。
[1] Carlson JJ, Garrison LP, Ramsey SD, et al. Epidermal growth factor receptor genomic variation in NSCLC patients receiving tyrosine kinase inhibitor therapy: a systematic review and meta-analysis[J]. J Cancer Res Clin Oncol,2009,135(11):1483-1493.
[2] Deng QF, Zhou CC, Su CX. Clinicopathological features and epidermal growth factor receptor mutations associated with epithelial-mesenchymal transition in non-small cell lung cancer[J]. Respirology,2009,14(3):371-376.
[3] Kobayashi S, Boggon TJ, Dayaram T,et al. EGFR mutation and resistance of non-small-cell lung cancer to gefitinib[J]. N Engl J Med,2005,352:786-792.
[4] Pao W, Miller VA, Politi KA, et al. Acquired resistance of lung adenocarcinomas to gefitinib or erlotinib is associated with a second mutation in the EGFR kinase domain[J]. PLoS Med,2005,2(3):e73.
[5] Bean J, Brennan C, Shih JY, et al. MET amplification occurs with or without T790M mutations in EGFR mutant lung tumors with acquired resistance to gefitinib or erlotinib[J]. Proc Natl Acad Sci USA,2007,104(52):20932-20937.
[6] Engelman JA, Zejnullahu K, Mitsudomi T,et al. MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling[J]. Science, 2007,316(5827):1039-1043.
[7] Pao W, Wang TY, Riely GJ, et al. KRAS mutations and primary resistance of lung adenocarcinomasto gefitinib or erlotinib[J]. PLoS Med, 2005,2(1):e17.
[8] Yauch RL, Januario T, Eberhard DA, et al. Epithelial versus mesenchymal phenotype determines in vitro sensitivity and predicts clinical activity of erlotinib in lung cancer patients[J].Clin Cancer Res,2005,11(24):8686-8698.
[9] Ogiso H, Ishitani R, Nureki O, et al. Crystal structure of the complex of human epidermal growth factor and receptor extracellular domains[J]. Cell,2002,110(6):775-787.
[10] Schlessinger J. Ligand-induced, receptor-mediated dimerization and activation of EGF receptor[J].Cell,2002,110(6):669-672.
[11] Rho JK, Choi YJ, Lee JK, et al. Epithelial to mesenchymal transition derived from repeated exposure to gefitinib determines the sensitivity to EGFR inhibitors in A549, a non-small cell lung cancer cell line[J]. Lung Cancer,2009,63(2):219-226.
[12] Suda K, Tomizawa K, Fujii M,et al. Epithelial to mesenchymal transition in an epidermal growth factor receptor-mutant lung cancer cell line with acquired resistance to erlotinib[J]. J Thorac Oncol,2011,6(7):1152-1161.
