血清睾酮及体重指数与前列腺癌关系的研究
2012-01-17彭川渡范治璐
彭川渡,范治璐
(大连医科大学 附属第二医院 泌尿外科,辽宁 大连 116027)
前列腺癌作为男性泌尿系统常见肿瘤,已严重威胁到中老年男性的身体健康和生活质量,是泌尿外科疾病诊疗难题之一。2011年美国新发前列腺癌240 890例,居男性癌症新发病例第1位;同年,美国前列腺癌死亡病例33 720人,仅次于肺癌居第2位[1]。目前中国前列腺癌的发病率也正呈逐年上升的趋势,其在男性泌尿生殖系统的恶性肿瘤中居第3位[2-3]。国内外学者普遍认为遗传、年龄、种族、饮食、生活环境、生活方式、前列腺炎等与前列腺癌的发生和发展密切相关[4-5]。也有学者报道血清睾酮(serum testosterone,T)、体重指数(BMI)可作为前列腺癌诊断及判断预后的指标。
睾酮为男性体内最重要的雄激素。前列腺的发育和功能的维持均需要一定剂量的雄激素,同时前列腺癌与其也有一定的相关性,一定水平的雄激素可以促进肿瘤细胞的生长,但分化差、恶性程度高、预后不良的前列腺癌患者体内雄激素的水平却相对较低。已有研究表明乳腺癌、结肠癌与肥胖关系密切,肥胖人群的患病率显著高于正常体重和超重人群[6]。但前列腺癌的发生、发展是否与肥胖相关,仍有待进一步探讨。
与此同时,业内同行发现体重指数与血清睾酮之间存在负相关关系,即肥胖男性血清睾酮水平相对较低。又由于人体血容量占体重的7%~8%,即体重大者血容量较多,因此,在研究中可带入血清睾酮与体重指数的比值,以调整体重和血容量带来的影响。本研究通过回顾性分析,探求T、BMI、T/BMI与前列腺癌的关系。
1 资料与方法
1.1 研究对象
2008年8月—2012年3月间在大连医科大学附属第二医院行前列腺穿刺的患者中筛选出56例, 所有患者均满足《中国泌尿外科疾病诊断治疗指南手册》的前列腺穿刺适应证:(1)直肠指检时发现前列腺内结节,任何PSA值;(2)B超发现前列腺低回声区或磁共振发现异常信号,任何PSA值;(3)PSA>10 ng/mL,任何f/tPSA和PSAD值;(4)PSA 4~10 ng/mL,f/tPSA异常或PSAD值异常。
患者年龄55~85岁,平均年龄72.4岁。血清PSA≤4 ng/mL的患者4例,血清PSA>10 ng/mL的患者38例,f/tPSA≤0.16患者6例。共28例患者在直肠指诊发现前列腺结节,其中结节位于前列腺左侧叶的有13例,10例结节位于前列腺右侧叶,另外5例患者前列腺左右两侧叶均发现结节。B超探及前列腺内低回声光斑患者31例。56例患者血清总睾酮范围10.09~26.24 nmol/L,平均值为18.97 nmol/L。
1.2 穿 刺
根据患者身体情况,于穿刺前后以抗生素预防感染。自动活检枪在经直肠超声引导下进行穿刺,穿刺集中在外周带,避开较大的搏动性血管,深度为1 cm,共计13针,见图1。如果病灶明确,可在该处另穿刺1针。
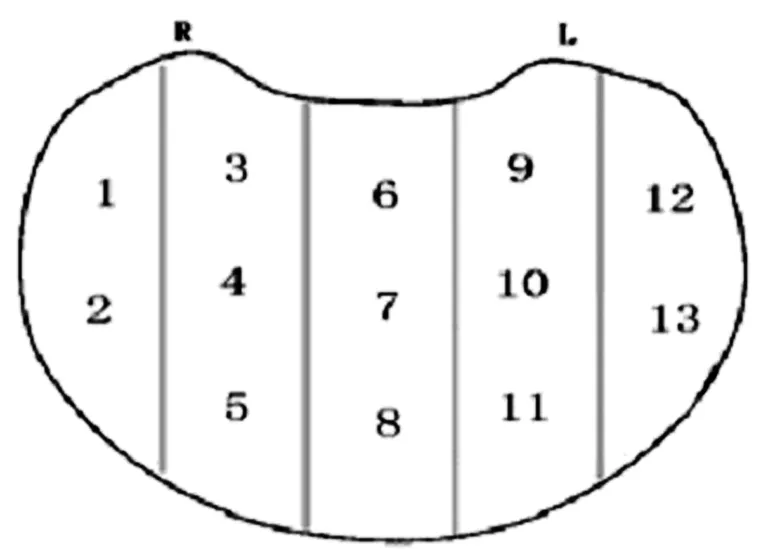
图1 前列腺13针穿刺示意图Fig 1 13 needle puncture of prostate
1.3 穿刺标本的病理诊断
采用Gleason分级法,根据肿瘤腺体的分化程度和腺体在间质中的生长方式来判断肿瘤的恶性程度。Gleason分值为1~5分,Gleason评分为主要和次要两种生长方式的评分之和。因此,肿瘤分化最好者为(1+1)2分,分化最差者为(5+5)10分。所以Gleason系统是两方面、五分级,十分计的分级法[7]。
穿刺病理诊断结果:良性前列腺增生(BPH)21例,占37.5%,患者年龄55~80岁,平均72.8岁;前列腺上皮内瘤样变(PIN)9例,占16.07%,患者年龄56~77岁,平均70.8岁;前列腺癌(PCa)26例,占46.43%,患者年龄61~85岁,平均73.7岁,其中Gleason评分≤6的患者10例, Gleason评分=7的患者8例(Gleason3+4者4例,Gleason4+3者4例),Gleason评分≥8的患者8例。
1.4 计算BMI和T/BMI
根据所测得患者的身高、体重及血清睾酮水平,计算出各自的BMI和T/BMI。
1.5 病例分组
将所有病例根据病理诊断结果分为前列腺癌组和非癌组(前列腺上皮内瘤样变在临床上被视为良性病变,故与前列腺增生归为一组)。
根据Gleason评分将前列腺癌组分为两组,即Gleason≤7组和Gleason≥7组(本研究中Gleason7分的患者有3+4和4+3两种,虽然这些患者同为7分,但3+4患者远期癌特异性生存率、无瘤进展生存率均高于4+3患者[8],且3+4患者的生化复发和疾病进展的风险明显较4+3患者低[9]。故在本研究中将Gleason评分低于7分以及3+4分的患者归为一组,Gleason评分高于7分以及4+3分的患者归为一组)。
1.6 统计学方法
应用统计学软件SPSS19.0对定量资料予相关性分析,并对独立样本进行正态性检验、齐次性检验、t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 年龄与血清睾酮水平分析
对56例患者的年龄与血清睾酮水平做相关性分析,结果显示两者无显著相关性(r=-0.162,P=0.232)。
2.2 前列腺癌组和非癌组的比较
两组间的年龄差异无显著性意义(P>0.05);前列腺癌组的平均睾酮为18.07 nmol/L,低于非癌组的20.23 nmol/L,差异有显著性意义(P=0.036);前列腺癌组的平均BMI为24.90,非癌组为23.54,两者差异有显著性意义(P=0.029);前列腺癌组的T/BMI低于非癌组(P=0.026)。
2.3 Gleason评分≤7组与Gleason评分≥7组两组间的比较
两组间年龄、BMI、T/BMI的差异没有显著性意义(P>0.05);Gleason评分≥7组的血清睾酮均值为16.62 nmol/L,Gleason评分≤7组的血清睾酮均值为19.32 nmol/L,两者的差异有显著性意义(P=0.045)。
3 讨 论
前列腺癌是男性泌尿系统的常见肿瘤,其发病率正逐年上升。研究表明脂肪的摄入与前列腺癌密切相关,在体内、外实验中,高水平的脂肪均能刺激前列腺细胞,尤其是雄激素依赖性前列腺癌细胞增生。
3.1 血清睾酮与前列腺癌
雄激素对前列腺的发育及功能的维持有重要作用,并影响前列腺上皮细胞的增殖与分化,在正常男性血液中,最重要的雄激素是睾酮,其95%由睾丸间质细胞合成。孕烯醇酮为睾酮的前体,其经过一系列可逆反应后转变成睾酮。睾酮也可在芳香化酶的作用下不可逆地转化为雌激素,男性体内大多数雌激素均是来自于此。外源性雌激素可用于治疗前列腺癌,目的是形成一个负反馈作用,进而减少睾丸间质细胞内睾酮的合成和分泌。豆类植物富含某些有雌激素活性的物质,从而在食用后影响了体内睾酮的含量,也可能正是因为大量豆类食品的摄入致使中国和日本前列腺癌的发病率远低于欧美国家。
尽管有研究表明睾酮与前列腺癌的发病无相关性[10-11],但越来越多的学者仍认为雄激素与前列腺癌的发生有着密切的关系,但两者之间并不是单纯的剂量-效应关系。一定水平的雄激素可以促进肿瘤细胞的生长,但高于这一剂量的雄激素反而对肿瘤的生长起了抑制作用[12],有学者发现预后不良的前列腺癌患者体内血清睾酮水平相对较低,因此血清睾酮可以作为一项预测因子来判断肿瘤是否已向前列腺外侵袭,其值与前列腺癌的恶性程度呈负相关[13-14]。另一项研究显示如果PSA值<10 ng/mL,前列腺癌患者的血清睾酮高于良性前列腺增生患者,在PCa患者中,Gleason评分7~10的患者血清睾酮显著低于Gleason评分在7以下的患者[15]。
上述血清睾酮水平与前列腺癌呈负相关关系可能并不是由睾酮直接引起,相反,导致这种相关性的原因可能是前列腺的恶性肿瘤细胞促使体内睾酮分泌减少,因为有学者发现:当前列腺癌患者接受前列腺根治性切除术后,其血清总睾酮和游离睾酮的值均较术前明显回升[16]。这可能是因为前列腺癌细胞能分泌某些对丘脑-垂体-性腺轴起负反馈作用的因子,当肿瘤外侵突破前列腺包膜后,该因子大量入血,致使雄激素的合成和分泌减少,当手术切除前列腺后,负反馈作用撤除,血清雄激素较术前升高。
男性睾酮的分泌在一天之内随时间的变化有所波动:清晨比夜间高出20%~40%,清晨和中午保持相对稳定,下午开始下降,老年男性随年龄增长睾酮的分泌逐渐减少[17]。本研究中所有患者的采血时间均在清晨,避免了激素分泌的波动对研究结果的影响,相关性分析结果显示患者血清睾酮的水平随年龄的变化并不明显。前列腺癌组患者的血清睾酮低于非癌组患者;高Gleason评分者的血清睾酮低于低Gleason评分者。
3.2 体重指数与前列腺癌
肥胖能导致许多慢性疾病的发生,包括高血压、高血脂、糖尿病等心脑血管及代谢性疾病,还增加了乳腺癌、结肠癌的患病风险[6]。人体内过多的白色脂肪会刺激机体产生一些细胞因子,例如白介素、转化生长因子等,它们能使前列腺细胞产生氧化应激反应,并有可能进一步发生癌变[18],即肥胖增加了罹患前列腺癌的风险,同时也提高了Gleason评分、根治术中切缘阳性率及死亡率[19],并且肥胖患者在放疗后有较高的复发风险[20]。虽然很多研究支持这一观点,但是也有学者提出了不同的看法,认为肥胖减少了前列腺癌的发病风险[21-23]。
本研究中,前列腺癌组的BMI平均为24.90,非前列腺癌组的BMI平均为23.54,两组的差异具有显著性意义,这一结果支持肥胖可以增加前列腺癌患病风险的论点。但在26例前列腺癌患者中,不同Gleason评分患者的体重指数没有明显差异,提示体重指数与前列腺癌细胞的分化程度并不相关。
3.3 体重指数与血清睾酮
肥胖与血清睾酮的水平也有一定的关系,一项针对1 548名年龄在25~84岁的男性的调查表明,腰围越大的男性其血清总睾酮与游离睾酮水平越低[24]。另有研究指出老年男性的血清睾酮水平与其体重指数呈负相关[25]。Snad等[26]的研究表明:性腺功能减退者在接受睾酮替代治疗9个月之后腰围明显下降,且下降的程度具有明显剂量依赖性。导致上述血清睾酮与肥胖呈负相关关系的原因可以概括为:(1)睾酮能够降低腹部脂肪组织的沉积作用,肥胖男性体内的睾酮在减少脂肪沉积的过程中有所消耗,从而导致肥胖者血清睾酮水平降低;(2)体内芳香化酶受到脂肪组织的影响,脂肪组织越多其受影响程度越大,从而使更多的雄激素转化为雌激素,直接降低了血清雄激素的水平;(3)肥胖促进糖皮质激素的转化和分泌,对下丘脑-垂体-肾上腺轴行成负反馈调节,导致男性雄性激素水平下降[25,27]。同时,由于不同体重者血容量存在差异,体重与血容量呈正相关,故肥胖者的高血容量可能对循环中的睾酮具有一定的稀释作用,在本研究中引入血清睾酮与体重指数的比值(T/BMI)来调整肥胖所带来的影响,结果显示前列腺癌组的T/BMI要低于非前列腺癌组,表明T/BMI低者患前列腺癌的风险较高,但T/BMI与肿瘤的分化程度不相关。
本研究表明血清睾酮、体重指数与前列腺癌具有一定的相关性,同时由于血清睾酮与体重指数呈负相关,因此可以将两者结合起来,将T/BMI作为一项指标,与PSA、DRE、影像学检查一起为诊断前列腺癌、评估其预后及选择治疗方案提供依据。
[1] Siegel R, Ward E,Brawley O,et al. Cancer statistics, 2011:the impact of eliminating socioeconomic and raciac disparities on premature cancer deaths[J].CA Cancer J Clin, 2011, 61(4): 212-236.
[2] 孙颖浩.我国前列腺癌的研究现状[J].中华泌尿外科杂志,2004,25(2):77-80.
[3] 张元芳,姜吴文.前列腺癌临床诊治的若干问题[J].中华医学杂志,2010,90:937-939.
[4] 仇成轩,施侣元.饮食与前列腺癌危险性关系的病例对照研究[J].中国慢性病预防与控制,2001,9(2):75-77.
[5] Stryker JE,Fishman J,Emmons KM, et al. Cancer risk communication in mainstream and ethnic newspapers [J]. Prev Chronic Dis,2009,6(1):23.
[6] Bray GA. The underling basis for obesity: relationship to cancer [J]. J Nutr, 2002,132:3451S-3455S.
[7] Gleason DF. Veterans administration cooperative urological research group: histological grading and clinical staging of prostatic carcinoma. In Tannenbaum Med: urological Pathology: The prostate[M].Philadelphia: Lea&Febiger. 1977.171-197.
[8] Tollefson MK, Leibovich BC, Slezak JM, et al. Long-term prognostic significance of primary Gleason pattern in patients with Gleason score 7 prostate cancer: impact on prostate cancer specific survival [J].J Urol, 2006,175:547-551.
[9] Kang DE, Fitzsimons NJ, Presti JC Jr, et al. Risk stratification of men with Gleason score 7 to 10 tumors by primary and secondary Gleason score: results from the SEARCH database [J].Urology, 2007, 70:277-282.
[10] Wiren S,Stocks T,Rinaldi S,et al. Androgens and Prostate cancer risk:a prospective study[J].Prostate,2007,67(11):1230-1237.
[11] Endogenous Hormones and Prostate Cancer Collaborative Group,Roddam AW,Allen NE,et al. Endogenous sex hormones and prostate cancer:a collaborative analysis of 18 prosPective studies[J].J Natl Cancer Inst,2008,100(3):170-183.
[12] Morgentaler A.Testosterone and prostate cancer:an historical perspective on a modern myth[J].Eur Urol,2006,50:935-939.
[13] 张振声,许传亮,高旭,等.治疗前睾酮水平与前列腺癌预后因素相关性的初步研究[J].中国男科学杂志, 2010,24(5):12-15.
[14] Isom-Batz,Bianco FJ Jr,Kattan MW,et al. Testosterone as a predictor of pathological stage in clinically localized prostate cancer[J]. J Urol, 2005,173(6):1935-1937.
[15] Masashi Y, Takashi I, Hiroyoshi S,et al.The clinical potential of pretreatment serum testosterone level to improve the efficiency of prostate cancer screening[J]. Eur Urol, 2007,51:375-380.
[16] Zhang PL,Rosen S,Veeramachaneni R,et al. Association between prostate cancer and serum testosterone level[J].Prostate,2002,53(3):179-182.
[17] Crawford ED, Barqawi AB. The association of time of day and serum testosterone concentration in a large screening population[J].BJU Internatonal,2007,100(3):509-513.
[18] Trayhum P,Wood IS. AdiPokines: Inflammation and the PleiotroPic role of White adipose tissue [J].Br J Nutr,2004,92:347-355.
[19] Calle EE,Rodriguez C,Walker-Thurlnond K,et al.Over-weight,obesity,and mortality from cancer in a prospectively studied cohort of US adults[J]. N Engl J Med,2003, 348:1625-1638.
[20] David P, Tom P,Scott T. Obesity as a predictor of biochemical recurrence and survival after radiation therapy for prostate cancer[J].BJU International,2007,100(2):315-319.
[21] Gong Z,Neuhouser ML,Goodman PJ,et al.Obesity,diabetes,and risk of prostate cancer: results from the prostate cancer prevention trial[J].Cancer Epidemiol Biomarkers Prv,2006,15:1977-1983.
[22] Littman AJ, White E, Kristal AR. Anthropometrics and Prostate Cancer Risk[J]. Am J Epidemiol,2007,165:1271-1279.
[23] Rodriguez C,Freedland S J,Jacobs EJ,et al. Body mass Index, weight Change, and risk of prostate Cancer in the cancer prevention study II nutrition cohort[J].Cancer Epidemiol Biomarkers Prev, 2007,16:63-69.
[24] Svartberg J, von Muhlen D, Sundsfjord J, et al. Waist circumference and testosterone levels in community dwelling men [J]. Eur J Epidemiol,2004,19(7):657-663.
[25] 郝卫军,曹剑,朱冰坡,等.老年男性肥胖患者性激素及其受体的变化[J].武警医学,2009,20(10):904-907.
[26] Snad F,Gooren U,Haider A,et al.A dose-response study of testosterone on sexual dysfunction and features of the metabolic syndrome using testosterone gel and parenteral testosterone undecanoate[J].J Androl, 2008,29:102-105.
[27] 张晓乐,张克勤.睾酮与男性代谢综合征[J].国际内分泌代谢杂志,2010,30(3):208-210.
