锂离子电池正极材料硅酸亚铁锂的研究现状
2012-01-16杨金龙木士春
杨金龙,木士春
(武汉理工大学材料复合新技术国家重点实验室,湖北 武汉 430070)
聚阴离子系材料具有价格低廉、资源丰富、安全性好及循环性能稳定等优点,被认为是锂离子动力电池的良好正极材料。聚阴离子型化合物正极材料具有与金属氧化物正极材料不同的晶相结构,以及由结构决定的各种突出性能[1]。首先,材料的晶体框架结构稳定,当Li+在正极材料中嵌脱时,结构重排很小;其次,存在M—O—X键,易于调变材料的放电电位平台,可设计充放电电位符合应用要求的材料。
磷酸铁锂(LiFePO4)是锂离子电池研究的热点,但理论比容量较低(约170 mAh/g),且离子和电子导电率及振实密度偏低。与LiFePO4相比,聚阴离子型硅酸盐类正极材料硅酸亚铁锂(Li2FeSiO4)在理论上1个分子可嵌脱2个Li+离子,理论比容量达320 mAh/g[2]。且Si与P元素在周期表中的位置相邻,Li2FeSiO4具有与LiFePO4相似的化学结构和化学稳定性能,同属于正交晶系[3]。正硅酸盐具有很强的Si-O结合力,Li-Fe-Si-O具有较强的晶格稳定性效应,拥有较好的循环性能和高温安全性[4]。Si比P具有更低的电负性,Fe2+/Fe3+电位降低[5]。
1 Li2FeSiO4的结构及充放电特性
用于锂离子电池的硅酸盐类正极材料Li2FeSiO4,其结构与低温Li3PO4的相似,所有阳离子都以四面体配位的形式存在,晶体结构属于正交晶系,晶胞参数a=0.626 61 nm,b=0.532 95 nm,c=0.501 48 nm,为Pmn21空间群。
S.Nishimura等[6]报道了Li2FeSiO4晶体结构的特点,FeO4和SiO4四面体以有规律的旋转方式排列。在Li+嵌脱的过程中,理论上 Li2FeSiO4材料可提供2个Li+的嵌脱。A.Nytén等[7]利用现场 XRD和 Mossbauer光谱研究了Li2FeSiO4材料在前2次循环过程中的嵌脱锂机理。材料首次循环后,充电平台由3.10 V降为 2.80 V,随后,电压平台稳定在2.6~2.8 V。这与P.Larsson等[5]由密度泛函理论计算的Li2FeSiO4的平均电位2.77 V(vs.Li/Li+)、能量密度1 200 Wh/L及比能量440 Wh/kg基本一致。M.Arroyo-de等[2]指出:硅酸盐类正极材料局限于 1个 Li+的嵌脱,是因为在第2个Li+的脱出时,电子的脱出电压大于4.8 V,超过了目前商业电解液的极限。若以1个 Li+进行嵌脱,Li2FeSiO4的理论比容量为166 mAh/g,发生的电化学反应见式(1):
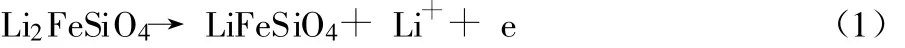
当第2个Li+脱出时,反应式见式(2):
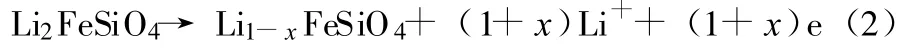
目前的研究主要集中在:通过对Li2FeSiO4晶体结构的分析,制备无杂质的 Li2FeSiO4,以及细化晶粒大小、掺混导电剂和不同元素的取代等途径,提高Li2FeSiO4的充放电特性。
2 Li2FeSiO4的合成
与LiFePO4的制备类似,Li2FeSiO4的合成方法主要有高温固相法、溶胶-凝胶法、微波法、水热法和水热辅助溶胶-凝胶法等。
2.1 高温固相法
高温固相反应法合成Li2FeSiO4通常可分为一步加热和二步加热法。先将原料按化学计量比混匀,一步法是直接升温到600~800℃,并保持一定时间;二步法是在300~350℃加热约3~5 h,使反应物预分解,将前驱体充分研磨后,再在600~800℃下焙烧10~36 h。为了防止 Fe2+被氧化为Fe3+,一般使用惰性气体保护。A.Nytén等[7]以 FeC2O4·2H2O和Li2SiO3为原料,在球磨过程中加入10%碳凝胶,在CO/CO2气氛中、750℃下加热24 h,得到 Li2FeSiO4材料。材料在 60℃下以 C/16在1.5~4.8 V充放电,首次充电比容量为165 mAh/g(理论值的99%),经过几次循环后,充放电比容量稳定在 140 mAh/g。K.Zaghib等[8]以 FeC2O4·2H2O和Li2SiO3为原料,在800℃真空条件下处理12 h,合成了粒度约为80 nm的Li2FeSiO4。循环伏安研究表明:首次循环时,材料的结构稳定,氧化峰、还原峰分别位于2.80 V(vs.Li)和2.74 V(vs.Li)。高温固相法生成产物时,化学键必须断裂和重组,涉及大量的结构重排,且原子或离子迁移的距离很长,需要高温使原子或离子晶体扩散到新的反应界面,易导致物相不均匀,形貌不规则,晶体颗粒粒度分布较宽,且煅烧时间长。
2.2 溶胶-凝胶法
溶胶-凝胶法具有化学均匀性好、反应易控制、合成温度低及可容纳不溶性或不沉淀性组分的特点。产物的粒径分布窄、纯度高、颗粒粒径小且比表面积大,但醇盐对人体有害,且价格昂贵,同时处理周期过长。R.Dominko等[9]用柠檬酸铁和硝酸铁混合形成溶胶,再加入LiOH和SiO2,在惰性气氛下加热,得到干凝胶,煅烧后获得50 nm左右的碳包覆样品。在60℃下,以C/20在1.5~4.8 V充放电,首次比容量为100 mAh/g,C/2放电比容量为C/20时的75%。
2.3 微波法
微波合成法的优点是所需的反应时间短、合成效率高,产物的颗粒均匀、纯度较高、形貌均匀且电化学性能较好,此外,由于利用活性炭吸收微波后产生的还原性气氛快速加热前驱体,使反应物的上面包覆一层乙炔炭黑,代替惰性气体提供保护气氛,进一步节约了成本。Z.D.Peng等[10]用微波法合成了 Li2FeSiO4正极材料,在 60℃下以C/20在1.5~4.8 V充放电,首次放电比容量为119.5 mAh/g,第10次循环的放电比容量为116.2 mAh/g。微波法的缺点是产品质量不稳定,一级品率低。
2.4 水热法
水热法与固相法及溶胶-凝胶法相比,流程简单,在工业应用中有很大的优势;缺点是设备要求高,技术难度大,安全性能差。R.Dominko等[9]以 LiOH、SiO2和 FeCl2为原料,在150℃下水热反应4 d,制备出Li2FeSiO4,但结构与Pmn21空间群略有不同,XRD分析显示:一些峰位发生了偏移或缺失。张有新等[11]认为:Li-Fe-Si-H2O体系由于pH值大于15,溶液中的Fe2+易被氧化,难以合成高纯度的 Li2FeSiO4。
2.5 水热辅助溶胶-凝胶法
溶胶-凝胶法使用FeC2O4·2H2O作为Fe源,难以实现凝胶前驱体的均匀混合,因此产物的纯度很难保证。杂质的存在严重影响所得材料的电化学性能。为了实现凝胶前驱体的均匀混合,得到粒径小且分布均匀、均一性好、相纯度高的Li2FeSiO4材料,提高产物的电化学性能。Z.L.Gong等[12]以可溶性醋酸亚铁Fe(Ac)2为原料,在120℃水热条件下完成溶胶-凝胶过程,实现了凝胶前驱体的均匀混合,并制备出Li2FeSiO4材料。以 C/16在1.5~4.8 V充放电,首次放电比容量为160 mAh/g,2 C首次放电比容量高达125 mAh/g,而且循环50次,容量无衰减。
3 Li2FeSiO4的改性
3.1 制备Li2FeSiO4复合材料提高导电性能
表面包覆导电碳可作为正极材料的保护层,抑制金属离子的溶解,减小电荷传递阻抗;并能提高材料的表面电子电导率,改善材料颗粒之间的电接触,且碳的引入会成为成核剂,使得粒径减小,可缩短Li+在颗粒内部的扩散路径[13]。C.K.Kinson等[14]以柠檬酸为碳源,采用高能球磨制备了纳米级的Li2FeSiO4/C复合材料,获得了102 mAh/g的放电比容量且循环性能稳定。蔡舒等[15]制备多孔碳包覆Li2FeSiO4正极材料,以聚乙二醇为造孔剂,通过正硅酸乙酯的水解缩合形成凝胶。在前驱体煅烧过程中,由于聚乙二醇热解形成连续的骨架和贯通的大孔/介孔孔道,通过正硅酸乙酯的水解缩合,形成三维网络结构,降低了离子在晶格重组时迁移的距离和所需的活化能,有利于降低反应温度、缩短反应时间。多孔结构增加了材料的比表面积,不仅有利于电解液在颗粒中的渗透,提高晶体内部Li+的嵌脱概率,还避免了晶粒在煅烧过程中的长大与充放电过程中的聚集,可提高正极材料的电化学性能。碳材料除了作为导电添加物对材料进行包覆外,还可作为掺混材料。X.B.Huang等[16]混合掺入沥青和碳纳米管(CNT),制备碳掺混的Li2FeSiO4/C/CNT复合材料。CNT在颗粒之间能起到良好的导电桥作用。以10 C高倍率在 1.5~4.8 V测试,比容量仍有 80 mAh/g,以1 C循环100次,比容量维持在初始值的95.1%。
3.2 金属离子掺杂
Li2FeSiO4正极材料的金属离子掺杂包括:Mn2+、Ni2+、Co2+、稀土金属离子、Cr2+和Mg2+等。L M.Li等[17]合成了Li2Fe0.9Ni0.1SiO4/C正极材料。Ni掺杂的Li2FeSiO4的电导率提高了2.5倍(Li2Fe0.9Ni0.1SiO4/C为 3.34×10-12cm2/s,Li2FeSiO4/C为 1.38×10-12cm2/s),以 C/16在1.5~4.8 V充放电,首次充放电比容量为160.1 mAh/g,第10次循环的比容量为153.9 mAh/g。S.Zhang等[18]制得掺Cr的正极材料Li2Fe0.97Cr0.03SiO4,产物的粒径较小,比表面积是未掺杂时的2倍,具有更高的活性,更大的可逆容量和更好的倍率性能。S.Zhang等[19]用Mg2+掺杂,制得 Li2Fe0.97Mg0.03SiO4正极材料。Mg2+在充放电过程中不变价,能很好地稳定晶格,使产物具有较好的可逆容量、倍率性能和循环稳定性。金属离子掺杂,能改善Li2FeSiO4的导电性能或Li+扩散性能,获得可变的电压平台和较好的电化学性能。
3.3 形貌控制
形貌对Li2FeSiO4正极材料的电化学性能影响较大。活性物质的颗粒过大,颗粒的比表面积较小,Li+扩散路径较长、扩散速率较小,都会导致利用率较低、放电容量不高。这是目前固相法制备材料的主要缺点。用溶胶-凝胶法制备的纳米级Li2FeSiO4,比表面积大,粒径分布均匀,有较好的结构稳定性,有利于Li+的嵌脱,提高比容量。若颗粒过细,粉体比表面积大,材料难以在有机溶剂中分散,涂覆电极时很难分布均匀,也会影响电池的性能。粉体过细,还易引起表面缺陷,增大极化。多孔材料具有较高的比表面积,缩短了Li+嵌脱路径,电解质易通过孔道进入正极材料内部,电子导电率和Li+扩散速率均较好,解决了正极材料的导电率低的问题。X.Y.Fan等[20]制备了平均粒径为 5 μ m、带有孔径为100 nm小孔的Li2FeSiO4/C正极材料。以 C/10在1.5~4.8 V充放电,首次放电比容量为134 mAh/g,但随后比容量有增加的趋势,第190次循环的比容量维持在155 mAh/g。杨金龙[21]采用经预处理并带有大孔的导电活性炭材料、吸附离子态的金属原料和液态硅原料,煅烧制备多孔纳米颗粒Li2FeSiO4/C正极材料。产物以0.1 C在1.5~4.8 V循环 30次,比容量稳定在 160 mAh/g,1.0 C比容量在120 mAh/g。
3.4 获得高于1个 Li+嵌脱的方法
受电解液的限制,目前很难实现2个Li+的嵌脱,造成锂的浪费,限制了 Li2FeSiO4的应用。对 Li2FeSiO4本体进行金属掺杂和非金属掺杂,并改进合成方法,可以获得高于1个Li+的嵌脱。Z.L.Gong等[22]采用Mn2+掺杂改性制备的Li2FexMn1-xSiO4/C实现了多于1个Li+的嵌脱。原理是利用锰的二次嵌脱锂电压较低,掺杂一定量的锰制备Li2FeSiO4和Li2MnSiO4的固溶体,Fe2+能起到固定晶格结构、减少锰流失的作用。这种固溶体中的铁和锰能起到相互协同的作用,提高比容量。D.P.Lv等[23]采用铁粉与柠檬酸混合反应、10 h煅烧热处理,得到纳米结构的Li2FeSiO4/C复合正极材料,在60℃以下C/16在1.5~4.8 V充放电,比容量达220 mAh/g,超过了1个Li+的嵌脱比容量。M.Armand等[24]通过第一原理计算,在晶格中掺入氮元素制备的Li2FeSiO3.5N0.5和Li2FeSiO3N,可降低材料的二次嵌脱锂电压,提高 Li2FeSiO4正极材料的比容量。D.Rangappa等[25]用快速超临界流体的方法合成超薄的Li2FeSiO4纳米毡,克服了Li+难扩散和结构不稳定的问题,实现了2个Li+的嵌脱,放电比容量达340 mAh/g,且前20次循环的性能稳定。
4 展望
聚阴离子型硅酸盐正极材料具有理论容量较高、安全性好的优点,其中,Li2FeSiO4是很有潜力的动力电池聚阴离子正极材料,但研究较晚,对结构及充放电机理的认识仍不清晰。Li2FeSiO4正极材料的电导率不高、循环性能差和倍率性能不佳,是目前急需解决的问题。明确材料的电化学嵌脱锂机理以及材料在充放电过程中的结构相变过程是解决上述问题的关键所在。采用掺杂改性和颗粒纳米化等手段获得较多的Li+嵌脱,得到较好的倍率性能和循环性能的材料以适合动力电池的需求,也是今后发展和研究的重要方向。
[1] Padhi A K,Nanjundaswamy K S,Goodenough J B,et al.Phosphoolivines as positive-electrode materials for rechargeable lithium batteries[J].J Electrochem Soc,1997,144(4):1 188-1 194.
[2] Arroyo-de M,Dompablo E,Armand M,et al.On-demand design of polyoxianionic cathode materials based on electronegativity correlations:an exploration of the Li2MSiO4system(M=Fe,Mn,Co,Ni)[J].Electrochem Commun,2006,8(8):1 292-1 298.
[3] Zhou F,Cococcioni M,Kang K,et al.The Li intercalation potential of LiM PO4and LiMSiO4olivines with M=Fe,Mn,Co,Ni[J].Electrochem Commun,2004,11(6):1 144-1 148.
[4] Gregor M,Chutchamon S,Christian M,et al.Li2FeSiO4polymorphs probed by 6Li MAS NMR and 57Fe Mossbauer spectroscopy[J].Chem Mater,2011,23(11):2 735-2 744.
[5] Larsson P,Ahuj A R,Nytén A,et al.An ab initio study of the Liion battery cathode material Li2FeSiO4[J].Electrochem Commun,2006,8(5):797-800.
[6] Nishimura S,Hayase S,Kanno R,et al.Structure of Li2FeSiO4[J].J Am Chem Soc,2008,130(40):13 212-13 213.
[7] Nytén A,Abouimrane A,Armand M,et al.Electrochemical performance of Li2FeSiO4as a new Li-battery cathode material[J].Electrochem Commun,2005,7(2):156-160.
[8] Zaghib K,Salah A A,Ravet N,et al.Structural,magnetic and electrochemical properties of lithium iron orthosilicate[J].J Power Sources,2006,160(2):1 381-1 386.
[9] Dominko R,Conte D E,Hanzel D,et al.Impact of synthesis conditions on the structure and performance of Li2FeSiO4[J].J Power Sources,2008,178(2):842-847.
[10] Peng Z D,Cao Y B,Hu G R,et al.Microwave synthesis of Li2FeSiO4cathode materials for lithium ion batteries[J].Chin Chem Lett,2009,20(8):1 000-1 004.
[11] ZhANG You-xin(张有新),CAO Cai-fang(曹才放),LIU Xuheng(刘旭恒).Li-Fe-Si-H2O体系的热力学分析[J].Journal of Central South University(Science and Technology)[中南大学学报(自然科学版)],2010,41(2):428-433.
[12] Gong Z L,Li Y X,He G N,et al.Nanostructured Li2FeSiO4electrode material synthesized through hydrothermal-assisted solgel process[J].Electrochem Solid-State Lett,2008,11(5):A60-A63.
[13] Yun N J,Ha H W,Jeong K H,et al.Synthesis and electrochemical properties of olivine-type LiFePO4/C composite cathode material prepared from a poly(vinyl alcohol)-containing precursor[J].J Power Sources,2006,160:1 361-1 368.
[14] Kinson C K,Torbjö rn G,John O T.Synthesis and electrochemical properties of nanostructured Li2FeSiO4/C cathode material for Li-ion batteries[J].Solid State Ionics,2011,192(1):356-359.
[15] CAI Shu(蔡舒),YAN Zi-peng(燕子鹏),ZHOU Xing(周幸).多孔碳包覆硅酸亚铁锂正极材料及制备方法[P].CN:101847711A,2010-09-29.
[16] Huang X B,Li X,Wang H Y,et al.Synthesis and electrochemical performance of Li2FeSiO4/carbon/carbon nano-tubes for lithium ion battery[J].Electrochim Acta,2010,55(24):7 362-7 366.
[17] Li L M,Guo H J,Li X H,et al.Effects of roasting temperature and modification on properties of Li2FeSiO4/C cathode[J].J Power Sources,2009,189(1):45-50.
[18] Zhang S,Deng C,Fu B L,et al.Effects of Cr doping on the electrochemical properties of Li2FeSiO4cathode material for lithiumion batteries[J].Electrochim Acta,2010,55(28):8 482-8 489.
[19] Zhang S,Deng C,Fu B L,et al.Doping effects of magnesium on the electrochemical performance of Li2FeSiO4for lithium ion batteries[J].J Electroanal Chem,2010,644(2):150-154.
[20] Fan X Y,Li Y,Wang J J,et al.Synthesis and electrochemical performance of porous Li2FeSiO4/C cathode material for long-life lithium-ion batteries[J].J Alloys Compd,2009,493(1-2):77-80.
[21] YANG Jin-long(杨金龙).改性Li2FeSiO4/C复合锂离子电池正极材料的研究[D].Wuhan(武汉):Wuhan University of Technology(武汉理工大学),2011.
[22] Gong Z L,Li Y X,Yang Y.Synthesis and characterization of Li2MnxFe1-xSiO4as a cathode material for lithium-ion batteries[J].Electrochem Solid-State Lett,2006,9(12):A542-A544.
[23] Lv D P,Wen W,Huang X K,et al.A novel Li2FeSiO4/C composite:synthesis,characterization and high storage capacity[J].J Mater Chem,2011,21(26):9 506-9 512.
[24] Armand M,Arroyo y de Dompablo M E,et al.Benefits of N for O substitution in polyoxoanionic electrode materials:a first principles investigation of the electrochemical properties of Li2FeSiO4-yNy(y=0,0.5,1)[J].J Mater Chem,2011,21(27):10 026-10 034.
[25] Rangappa D,Murukanahally K D,Tomai T,et al.Ultrathin nanosheets of Li2MSiO4(M=Fe,Mn)as high-capacity Li-ion battery electrode[J].Nano Letters,2012,12(3):1 146-1 151.
