四种木本植物叶芽不同生长期SOD的检测研究
2012-01-12蒋本国张旭凡刘长建
蒋本国,张旭凡,刘长建
(大连民族学院生命科学学院,辽宁大连 116605)
四种木本植物叶芽不同生长期SOD的检测研究
蒋本国,张旭凡,刘长建
(大连民族学院生命科学学院,辽宁大连 116605)
对枫藤等四种木本植物叶芽不同生长期的SOD使用连苯三酚自氧化法进行了检测,以确定SOD含量较高的植物材料及其所在生长阶段,并研究了Mg2+及Ca2+对雪松SOD活力的影响。实验表明,枫藤叶芽在开始取样后第9天SOD活力达到最大值,为159.24 μ·g-1;辽东冷杉与雪松在第一次取样时SOD活力达到最大值,分别为83.57和190.71 u·g-1;Mg2+、Ca2+加入均在0.1 mL(4 mg·mL-1)时,对雪松SOD活力的增强作用达到最大,分别为148%,138%。
超氧化物歧化酶(SOD);叶芽;生长期;Mg2+;Ca2+
超氧化物歧化酶(SOD)广泛存在于植物中,用于清除植物体内自由基,保护植物细胞免受O2
·-的毒害作用[1]。SOD在食品、医疗领域中的应用价值已经得到了广泛的关注。SOD可以防止皮肤变皱、变黑,形成老年斑[2];可以预防并缓解肺气肿和动脉粥样硬化[3];可作为罐头、果汁、啤酒等的添加剂,防止过氧化物引起的食品变质及腐败现象;还可作为水果、蔬菜等的良好保鲜剂[4]。本文使用连苯三酚自氧化法研究了枫藤等四种木本植物叶芽不同生长阶段SOD活力的变化[5],以获得较好的可用于提取制备SOD的材料。
1 材料与方法
1.1 材料
枫藤叶芽、辽东冷杉叶芽、马尾松叶芽、雪松叶芽,以上四种叶芽都是在其叶芽萌发到长度为1 cm左右进行第一次取样,测定SOD活力,以后每隔3 d采样测定一次,直至叶片成熟。
1.2 仪器及试剂
紫外分光光度计(UV-2100)(龙尼柯仪器有限公司),高速台式冷冻离心机(TGL-16)(长沙湘仪离心机仪器有限公司),匀浆机(T25basic) (IKA),pH计(SX-610)(上海精密科学仪器有限公司)。试剂均为分析纯(AR)。
1.3 方法
1.3.1 SOD酶液的提取
称取4 g即采植物叶芽样品,剪碎,放入匀浆管中,向管中加入20 mL 0.05 mol·L-1,pH 7.8 Na2HPO4-NaH2PO4缓冲液,在冰浴中匀浆,匀浆后经12 000 r·min-1、4℃下离心15 min,取上清液在60℃水浴锅中保持15 min后用于活力测定。每隔3 d对植物叶芽采样进行测定。
1.3.2 邻苯三酚自氧化速率的测定
空白管、自氧化管与样品管组成见表1。取两支试管按表1加入25℃预热过的pH8.2、50 mmol·L-1Tris-HCl缓冲液,然后加入预热过的5 mmol·L-1邻苯三酚(空白管用10 mmol·L-1HCl代替邻苯三酚),迅速摇匀,立即倾入1 cm比色杯中,在325 nm波长处测定光吸收值,每隔30 s读数一次,测定4 min内每分钟光吸收值的变化。要求自氧化速率控制在每分钟的光吸收值增量为0.07[6](可增减邻苯三酚的加入量,以控制光吸收值)。实验中邻苯三酚的加入量均为80 μL。

表1 空白管、自氧化管及样品管的组成
1.3.3 SOD样品的酶活力测定
按表1配制溶液,样品管测定时先加入预热的待测酶液,再加入邻苯三酚,其余步骤同邻苯三酚自氧化速率的测定。
1.3.4 Mg2+、Ca2+对雪松SOD活力的影响
空白管与加金属离子的样品管组成见表2。以雪松叶芽第9天采集材料所制备的SOD样液进行Mg2+、Ca2+对雪松SOD活力影响的测定,将2,4, 6,8,10 mg·mL-1的Mg2+、Ca2+溶液按表2中的量分别加入配制空白管与样品管试液进行测定。

表2 空白管与加金属离子的样品管组成
1.3.5 数据处理方法
样品酶活力单位表示在25℃恒温条件下,每毫升反应液中,每分钟抑制邻苯三酚自氧化速率50%的酶量定义为一个酶活力单位。实验按下式进行数据处理。
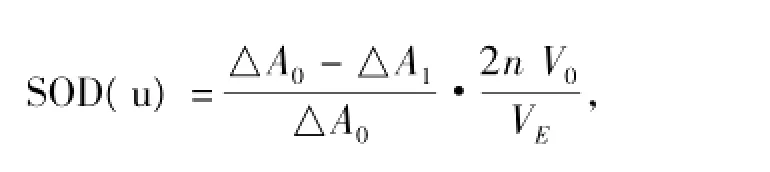
式中,△A0为联苯三酚的自氧化率,△A1为加入待测液后邻苯三酚的自氧化率,V0为反应液总体积,n为酶液稀释倍数,VE为所加酶液体积。
2 结果与讨论
2.1 植物不同生长期叶芽SOD活力测定
2.1.1 枫藤
枫藤SOD活力变化曲线如图1。可以看出,枫藤SOD活力总体呈振荡上升的趋势,采样第9天时SOD活力达到测定阶段的最高值,为159.24 u·g-1。因此,提取枫藤SOD时应该选择在萌芽(从1 cm开始)采样后的第9天进行。此期间枫藤SOD活力随其叶芽生长而增加,叶片接近成熟时其生物量较大,SOD活力总值显著提高,之后则有所下降。
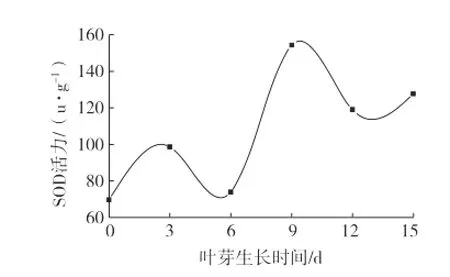
图1 枫藤SOD活力变化曲线
2.1.2 辽东冷杉
辽东冷杉SOD活力变化曲线如图2。可以看出,第一次采样(1 cm)的冷杉SOD活力最高,达到83.57 u·g-1。此时冷杉处于刚开始萌发的阶段,叶子还没舒展开,说明此时冷杉需要更多SOD的保护,把外界环境对幼芽的伤害降到最低。但其SOD活力随着叶芽生长快速降低,SOD活力较高的叶芽生物量较少,难以采集叶芽用于SOD的提取制备。因此虽然辽东冷杉生长初期SOD活力较高,但并不适于SOD的提取制备。

图2 辽东冷杉SOD活力变化曲线
2.1.3 马尾松
马尾松SOD活力变化曲线如图3。可以看出,马尾松SOD酶活力总体呈振荡下降的趋势,第2次采样的叶芽达到最大,为73.93 u·g-1。说明马尾松刚开始发芽时需要产生更多的SOD以达到保护嫩芽的作用,但随着叶子的逐渐成熟SOD活力下降,这与辽东冷杉类似。其适于SOD提取的叶芽生物量小,因而不适于进行SOD的提取制备。

图3 马尾松SOD活力变化曲线
2.1.4 雪松
雪松SOD活力变化曲线如图4。可以看出,雪松中SOD活力随着叶子的生长,呈平稳下降趋势,初期嫩芽SOD活力最高,达到190.71 u·g-1。随着叶片生长接近成熟,SOD活力较低,但由于雪松中SOD活力初期较其他生物材料高很多,叶片接近成熟时SOD活力仍然比辽东冷杉、马尾松初期叶芽高,因此在生物量较大时雪松叶片是比较适于SOD提取制备的材料。
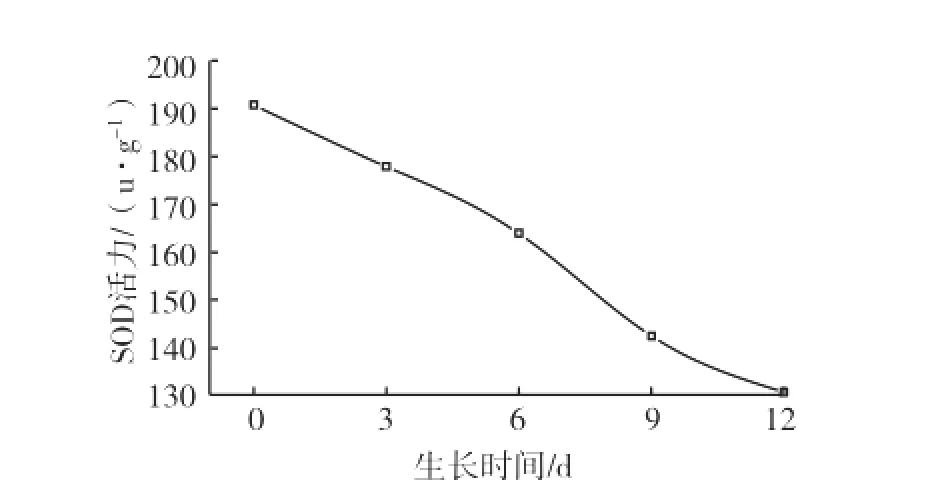
图4 雪松SOD活力变化曲线
2.2 Mg2+、Ca2+对SOD活力的影响
本实验以雪松为例,Mg2+、Ca2+对其SOD活力的影响曲线如图5。可以看到,在分别加入2,4,6,8 mg·mL-1质量分数的Mg2+溶液各0.1 mL时,对雪松叶芽SOD活力都有不同程度的促进作用,4 mg·mL-1时达到最大,为220.71 u· g-1。Mg2+浓度过低或过高对SOD活力促进作用有所降低,若浓度低于实验中的最低值,或浓度高于实验中的最高值对SOD活力有抑制作用。
在分别加入2,4,6,8 mg·mL-1质量分数的Ca2+溶液各0.1 mL时对雪松SOD活力都有不同程度的促进作用,4 mg·mL-1时达到最大,为204.64 u·g-1,而在2,10 mg·mL-1时对SOD活力有明显的抑制作用,Ca2+浓度过高或过低均会抑制SOD活力。
Mg2+、Ca2+离子在酶促反应中可以作为亲电辅助因子促进反应的进行,适当浓度时对SOD活力的提高有明显的促进作用。
3 结论
(1)枫藤中SOD活力随着叶芽生长呈增加趋势,在开始采样后第9天达到最大值,为159.24 u·g-1,辽东冷杉和马尾松中SOD酶随着叶芽生长呈减少趋势,雪松在第一次取样时测得的SOD活力最大,为190.71 u·g-1,之后逐渐下降,至叶片近成熟时仍有130 u·g-1左右。经对比,辽东冷杉和马尾松叶芽中在其生物量较大时SOD活力较低,不适于作为SOD提取材料;枫藤和雪松叶芽均在生物量较大时具有较高的SOD活力,作为SOD提取材料较适宜。
(2)Mg2+、Ca2+对雪松叶芽中SOD活力影响研究中获知,Mg2+、Ca2+在分别加入质量分数为4 mg·mL-1溶液0.1 mL时,对SOD活力的增强作用最大,分别为148%,138%。
[1]TAKENAGA Mitsuko,OHTA Yuki,TOKURA Yukie.Lecithinized superoxide dismutase(PC-SOD)improved spinal cord injury-induced motor dysfunction through suppression of oxidative stress and enhancement of neurotrophic factor production[J].Journal of Controlled Release,2006,110(2):283-289.
[2]HEE Soon Choi,JAE Jin An.PEP-1-SOD fusion protein efficiently proteets against paraquat-indueed dopaminergie neuron damage in a Parkiuson disease mouse model[J].FreeRadical Biology&Medieine,2006,41: 1058-1068.
[3]TASAKI H,YAMASHITA K.Heparin-released extracellular superexide dismutase is reduced in patients with coronaryarteryatherosclerosis[J].Atheroscleresis (Amsterdam,Netherlands),2006,187(1):131-138.
[4]YE Nanhui,LIU Shutao,LIN Yanyun,et al.Protective effects of intraperitoneal injection of TAT-SOD against focal cerebral ischemia/reperfusion injury in rats[J].Life Sciences,2011,89(23-24):868-874.
[5]静天玉,赵晓瑜.用终止剂改进超氧化物歧化酶邻苯三酚测活法[J].生物化学与生物物理进展,1995,22 (1):84-86.
[6]张宏,谭竹钧.四种邻苯三酚自氧化法测定超氧化物歧化酶活性方法的比较[J].内蒙古大学学报,2002,33(6):677-681.
Study on Detection of SOD of Four Woody Plant Buds in Different Growth Periods
JIANG Ben-Guo,ZHANG Xu-fang,LIU Chang-Jian
(College of Life Science,Dalian Nationalities University,Dalian Liaoning 116605,China)
The autoxidation of pyrogallol is used in the analysis and detection of SOD of Japanese creeper and other three kinds of woody plant buds in different growth periods,which was used to determine the species of plants and growth period with higher SOD.Meanwhile we also analyze the influence on the activity of SOD of cedar from Mg2+,Ca2+.The activity of SOD from japanese creeper'leaves reaches maximum value,159.24 u·g-1,in the ninth day after being sample.The activity of SOD of Liaodong fir and cedar in the first sample analysis reaches maximum value,83.57 u·g-1and 190.71 u·g-1,respectively.When Mg2+and Ca2+with 0.1 mL(4 mg·mL-1)are added into cedar,the enhancement effect of the activity of SOD of cedar is best with 148%and 138%,respectively.
super-oxide dismutase;leaf bud;growth period;Mg2+;Ca2+
Q554.6
A
1009-315X(2012)03-0202-03
2012-03-07;最后
2012-03-20
蒋本国(1954-),男,黑龙江望奎人,副教授,主要从事有机化学与生物化学研究。
(责任编辑 邹永红)
